早期有丝分裂抑制因子1在膀胱癌组织中的表达及临床意义
2022-08-10方志伟杨小明魏晓松易成智宋东奎
方志伟,杨小明,杨 阳,魏晓松,易成智,宋东奎
郑州大学第一附属医院泌尿外科 郑州 450052
膀胱癌是常见的泌尿系统恶性肿瘤,2015年在我国居泌尿系统肿瘤年发病率第一位,且呈逐年上升趋势[1-3]。膀胱癌预后很差。如何精准判断膀胱癌预后,个体化制定诊疗方案,开发新的治疗靶点,改善预后是目前研究的热点。早期有丝分裂抑制因子1(early mitotic inhibitor 1,EMI1)属于F-box蛋白家族,具有调控细胞进入有丝分裂S期的功能。EMI1过表达会导致单极或三极纺锤体、染色体错误分离、多中心体形成、胞质分裂失败等严重错误,进一步导致双核细胞、多倍体形成及基因组不稳定[4-5]。已有研究[6]显示EMI1在多种实体瘤中表达上调,且表达水平与肿瘤恶性程度呈正相关。在乳腺癌的长期生存随访中发现,EMI1高表达的患者总体生存期缩短[7]。本研究采用免疫组化SP法检测膀胱癌及癌旁正常膀胱组织中EMI1的表达,探讨其与膀胱癌临床病理特征和预后的关系,为膀胱癌的诊断及预后判断提供指导。
1 材料与方法
1.1 临床资料收集郑州大学第一附属医院泌尿外科2014年1月1日至2017年1月1日经尿道膀胱肿瘤电切术或膀胱癌根治术切除的膀胱癌病理组织112例,及其配对的癌旁正常组织86例。膀胱癌患者中男69例,女43例,年龄39~82岁,所有病例均有完整的临床及病理资料(表1)。
1.2 膀胱癌组织和癌旁正常组织中EMI1蛋白表达的检测采用免疫组化SP法。EMI1鼠抗人单克隆抗体购自美国Santa Cruz公司,HRP标记的羊抗鼠二抗购自英国Abcam公司。石蜡组织标本4 μm切片,置于65 ℃烤箱中烘烤过夜。切片完全浸没于二甲苯中5 min×4 次;梯度乙醇脱水各20 s,最后浸入蒸馏水1 min;95 ℃柠檬酸-柠檬酸钠缓冲液浸泡20 min,自然冷却至室温;滴加新鲜配制的质量分数30 g/L的H2O2,完全覆盖组织,室温下避光孵育10 min;PBS冲洗3 次,去除H2O2;滴加体积分数10%的正常羊血清封闭液,孵育20 min。EMI1一抗(用抗体稀释液稀释100倍)滴片,置入保湿盒内,4 ℃过夜。HRP标记的羊抗鼠二抗(用PBS稀释1 000倍)滴片,37 ℃ 20 min。DAB滴片,常温下孵育2 min,浸水终止反应。苏木精染核1 min。中性树脂封片。以细胞核或细胞质出现棕黄色颗粒为EMI1阳性细胞。于低倍镜(×100)下选取5个视野,高倍镜(×400)下每个视野计数100个细胞。按阳性细胞百分比评分,0为0分,~25%为1分,~50%为2分,>50%为3分。按染色强度评分:淡黄色为1分,棕黄色为2分,黄褐色为3分。以上两项评分乘积<6分为低表达,≥6分为高表达。由两位具有3 a以上临床经验的病理医师独立判读,结果取平均值,差异较大的切片送第3位病理医师判读,舍弃偏差较大的结果后取平均值。
1.3 随访患者从手术日开始随访,随访方式为复诊和电话随访。随访时间15~63个月,中位随访时间46个月,以死亡为终点事件。生存时间为自手术日至患者死亡时间或随访截止时间。
1.4 统计学处理采用SPSS 16.0分析,不同临床病理特征患者EMI高表达率的比较采用χ2检验,86例膀胱癌与其配对癌旁正常组织中EMI1表达的比较采用配对χ2检验。采用Kaplan-Meier法绘制膀胱癌患者EMI1高表达组与低表达组的生存曲线,并进行Log-rank检验。采用Cox回归单因素及多因素分析膀胱癌预后的危险因素,检验水准α=0.05。
2 结果
2.1 膀胱癌及癌旁正常膀胱组织中EMI1蛋白表达的比较结果见图1、表1。

表1 两种组织中EMT1蛋白的表达 例

A:癌旁正常膀胱组织;B:膀胱癌组织
2.2 不同临床病理特征膀胱癌患者EMI1表达水平的比较不同性别、年龄、肿瘤大小、淋巴结转移的膀胱癌组织中EMI1高表达率差异无统计学意义,组织类型、T分期、TNM分期、病理分级差异有统计学意义(表2)。

表2 EMI1表达水平与膀胱癌患者临床病理特征的关系 例(%)
2.3 EMI1表达与膀胱癌患者预后的关系EMI1高表达组和低表达组的生存曲线差异有统计学意义(χ2=14.402,P<0.001,图2),低表达组预后优于高表达组。单因素分析显示T分期、TNM分期、病理级别、远处转移、EMI1表达水平是膀胱癌预后的影响因素。将差异有统计学意义的因素纳入多因素Cox回归分析结果表明远处转移、TNM分期Ⅲ+Ⅳ期、EMI1高表达是膀胱癌预后的危险因素(表3)。
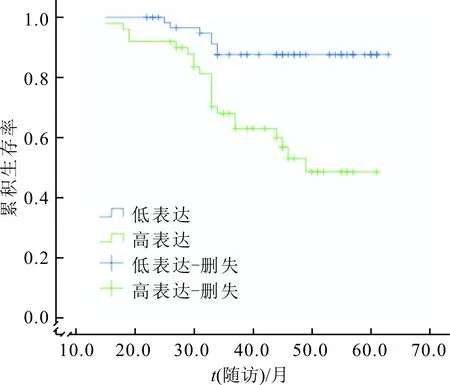
图2 EMI1高表达与低表达组膀胱患者生存曲线
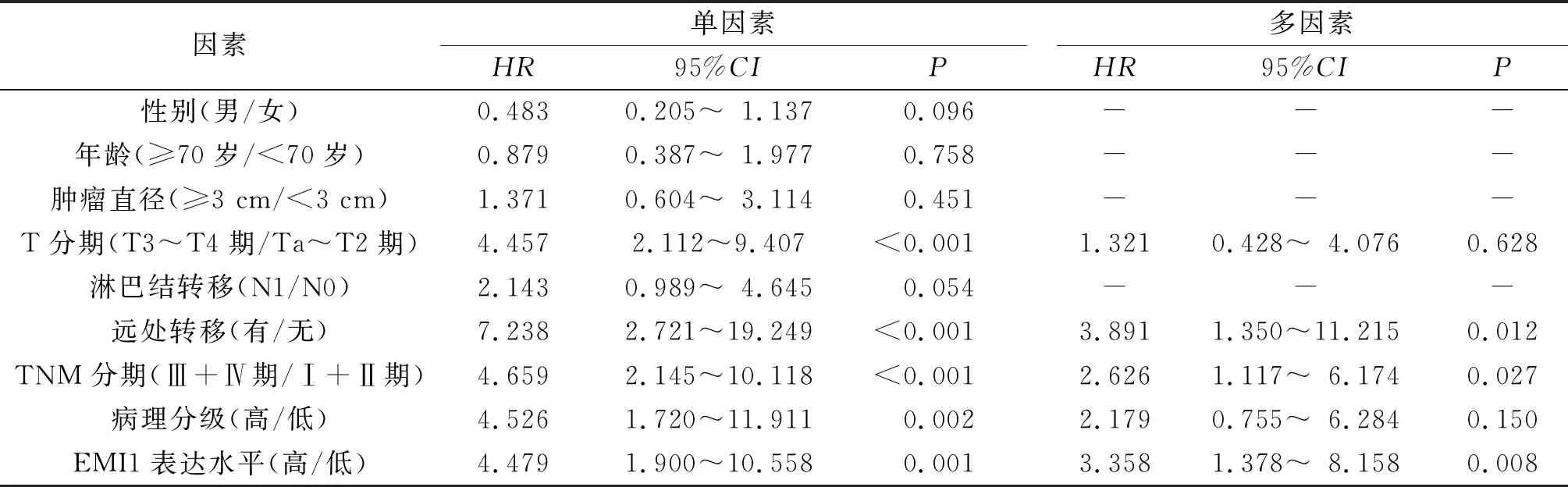
表3 膀胱癌预后因素的Cox回归分析结果
3 讨论
EMI1基因于2001年首次在非洲爪蟾提取物中被发现,它可通过与细胞分裂周期蛋白20结合抑制有丝分裂后期促进复合物(anaphase promoting complex,APC)活化,积累细胞周期蛋白B,促进细胞有丝分裂进入M期[8-9]。EMI1可以抑制APC泛素化,促进有丝分裂进入S期;是有丝分裂的关键调节因子,EMI1表达异常影响染色体的稳定性及细胞正常分裂[5]。而染色体的稳定性及细胞正常分裂是维持机体正常功能的重要前提,多倍体形成、染色体不稳定是诱发肿瘤的重要原因,也是肿瘤的重要标志[10]。研究[11]发现,除血液肿瘤外,EMI1在神经胶质瘤、乳腺癌、肺癌、卵巢癌、骨肿瘤中表达上调,其表达水平与乳腺癌、肺癌、卵巢癌恶性程度呈正相关,与骨肿瘤临床分期呈正相关,EMI1高表达组乳腺癌及肺癌总体生存期显著缩短。我们的研究发现膀胱癌组织中EMI1表达水平升高,EMI1表达水平与肿瘤恶性程度、TNM分期等有关。既往研究[12-13]显示膀胱癌肿瘤大小、淋巴结转移、远处转移、病理分级为影响肿瘤预后的因素。本研究结果表明淋巴结转移、TNM分期及EMI1表达水平是影响膀胱癌预后的因素。EMI1高表达组患者生存期缩短,提示EMI1过表达可能影响膀胱癌细胞的生物学行为,对判断膀胱癌患者的预后具有一定的指导意义。
膀胱癌治疗是手术联合放化疗的综合治疗,本研究中EMI1高表达组患者生存期缩短可能与EMI1高表达影响膀胱癌对放化疗的敏感性有关。事实上EMI1对放化疗敏感性的影响较为复杂。既往研究[7,14]发现EMI1低表达与三阴乳腺癌合并BRCA1基因突变患者对PARPi耐药相关,上调EMI1表达水平,三阴乳腺癌患者对PARPi治疗敏感性增高。研究[15]发现EMI1低表达同样与其他影响细胞周期的细胞毒药物(顺铂及CHK1抑制剂)耐药相关。也有研究[16]表明EMI1表达下调后多倍体细胞增多,细胞周期阻滞于S期,对阿霉素、依托泊苷敏感性升高,且DNA双链断端增多,放疗敏感性增高。此外,通过siRNA下调皮肤鳞癌细胞系中EMI1表达水平,细胞存活仅为对照组的10%左右[17]。
综上所述,EMI1在膀胱癌组织表达升高,且表达水平与膀胱癌病理分级及TNM分期有关,EMI1高表达患者预后不佳,EMI1有望成为膀胱癌患者的预后指标及临床治疗靶点,相关机制尚需进一步研究。