配对血浆滤过吸附对脓毒性休克并ARDS患者血流动力学的影响
2022-08-10高延秋晁琳琳许瑞涛李双凤李晓燕
高延秋,明 月,晁琳琳,许瑞涛,李双凤,李晓燕
郑州大学附属郑州中心医院呼吸重症医学科 郑州 450007
脓毒症是由于宿主对感染反应失调而导致的危及生命的器官功能障碍,脓毒性休克是脓毒症合并严重的循环、细胞及代谢紊乱,易并发急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),病死率达50%~90%[1-2]。目前研究[3]认为,大量内皮细胞、中性粒细胞、单核巨噬细胞的过度激活和炎症介质的过度释放是脓毒性休克发生的根本原因。在脓毒性休克发生发展的过程中,体内出现大量炎症介质,它们之间相互作用导致“瀑布效应”,继而引起多器官功能不全综合征(multiple organ dysfunction syndrome,MODS)。ARDS特征性病理表现是由于炎症反应导致的肺毛细血管内皮及肺泡上皮严重损伤[4]。针对脓毒性休克并ARDS患者,除了积极地抗感染、抗休克及选择合适的呼吸支持等治疗外,控制过度的炎症反应是阻断其病理生理恶化的关键。血液净化技术可有效清除机体内毒素和炎性细胞因子。连续性静脉血液滤过(continuous veno-venous hemofiltration,CVVH)是传统的连续性血液净化(continuous renal replacement therapy,CRRT)模式,其通过对流方式清除中小分子溶质,用滤过膜吸附部分的中大分子溶质。但是,有研究[5]显示CVVH并不能有效、持续地改变血浆中细胞因子的水平。配对血浆滤过吸附(coupled plasma filtration adsorption,CPFA)作为一种新型血液净化技术,引入吸附装置,大大提高了对可溶性炎症介质的清除,更有利于脓毒性休克并ARDS的治疗。一项回顾性研究[6]表明,CPFA在改善血流动力学及炎症反应方面有很大的前景。本研究旨在探讨CPFA对脓毒性休克并ARDS患者血流动力学等的影响,现将结果报道如下。
1 对象与方法
1.1 研究对象选取郑州大学附属郑州中心医院呼吸重症监护室(RICU)2018年1月至2020年12月收治的脓毒性休克并ARDS患者60例。纳入标准:①均符合2012年《急性呼吸窘迫综合征柏林标准》的中、重度ARDS诊断标准。②脓毒性休克诊断符合国际脓毒症3.0诊断标准。③均行有创机械通气。④均行CRRT治疗。排除标准:①年龄<18岁。②APACHEⅡ评分<15分。③合并严重出血倾向的血液系统疾病、严重心功能不全或严重心律失常不能耐受体外循环、重度贫血未纠正者。60例患者在液体复苏的同时,均应用血管活性药物。本研究所有检测及治疗均获得患者或家属的知情同意。
1.2 治疗及CVVH、CPFA操作方法
1.2.1治疗方法 所有患者均按照《国际脓毒症和脓毒性休克管理指南(2016)》《急性呼吸窘迫综合征患者机械通气指南(2016)》及《急性肺损伤/急性呼吸窘迫综合征诊断与治疗指南(2006)》标准进行抗感染、抗炎、液体复苏、应用血管活性药物、呼吸道管理和机械通气等常规治疗。
1.2.2CVVH操作方法 30例行CVVH。Seldinger法穿刺右颈内静脉或股静脉,留置双腔导管建立血管通路,所用机器型号为Prismaflex 8.0(美国百特公司),M150滤器(AN69膜,1.5 m2)。采用血浆滤过基础置换液配方,后稀释方式补液,血流量120~200 mL/min,置换液流量2 L/h。净化过程中监测凝血功能。每天更换滤器,连续治疗3 d。
1.2.3CPFA操作方法 30例行CPFA。Seldinger法穿刺右颈内静脉或股静脉,留置双腔导管建立血管通路,所用机器为Prismaflex 8.0(美国百特公司)、Prismaflex TPE 2000 set血浆分离器(美国百特公司),吸附器为HA330血浆灌流器(珠海健帆生物科技股份有限公司),F6血液透析器(德国费森尤斯公司)。血流量120~150 mL/min,血浆分离速度30~40 mL/min,采用血浆滤过基础置换液配方。治疗前先用50 g/L葡萄糖溶液1 000 mL及生理盐水1 000 mL加普通肝素40 mg预冲洗HA330血浆灌流器30 min。对于血压偏低者,引血前补充同型血浆200 mL以预防引血加重低血压。每天CPFA 2.5 h,继续CVVH 21.5 h;连续3 d。
1.3 观测指标①患者入RICU第0、1、2、3天的炎症指标[降钙素原(PCT)、C反应蛋白(CRP)、TNF-α、IL-6、IL-10]、心率(HR)、平均动脉压(MAP)、血乳酸(Lac)。②患者入RICU第0、3、7天的氧合指数(OI),并进行APACHEⅡ评分和序贯器官衰竭评分(SOFA评分),计算3 d Lac清除率[(第0天Lac-第3天Lac)/第0天Lac×100%]、3 d ΔSOFA评分(第0天SOFA评分-第3天SOFA评分)、3 d ΔAPACHEⅡ评分(第0天APACHEⅡ评分-第3天APACHEⅡ评分)。
患者在入RICU第0、1、2、3天抽取静脉血,分离血清,采用免疫荧光定量法测定CRP(试剂盒购自杭州丽珠医疗器械有限公司),电化学发光法测定PCT(试剂盒购自武汉华美生物工程有限公司),ELISA法测定IL-6、IL-10、TNF-α(试剂盒购自美国DPC公司);在入RICU第0、1、2、3天抽取动脉血,采用全自动血气分析仪(丹麦雷度米特医疗设备上海有限公司)测定Lac;在入RICU第0、3、7天测定氧分压,并计算OI。
1.4 随访14 d内是否停用血管活性药物,血流动力学是否稳定。
1.5 统计学处理数据采用SPSS 20.0进行处理。两组性别、感染部位和基础疾病等的比较采用χ2检验;年龄、APACHEⅡ评分和SOFA评分均采用两独立样本的t检验;两组不同时间点血清炎症介质水平、HR、MAP、血清Lac、OI和SOFA评分的比较采用重复测量数据的方差分析;采用Logistic回归分析患者14 d内停用血管活性药物的影响因素。检验水准α=0.05。
2 结果
2.1 两组患者一般资料比较两组患者年龄、性别、感染部位、基础疾病、第0天的APACHEⅡ评分等一般情况比较,差异均无统计学意义,见表1。

表1 两组患者的一般资料比较
2.2 两组患者血清炎症介质水平的比较两组患者治疗后各炎症介质水平均下降,且CPFA组IL-6、IL-10、TNF-α水平下降程度大于CVVH组,见表2。

表2 两组患者血清炎症介质水平的变化
2.3 两组患者HR、MAP、血清Lac的比较两组患者治疗后MAP均上升,HR和Lac均下降,两组间各指标变化程度差异无统计学意义,见表3。
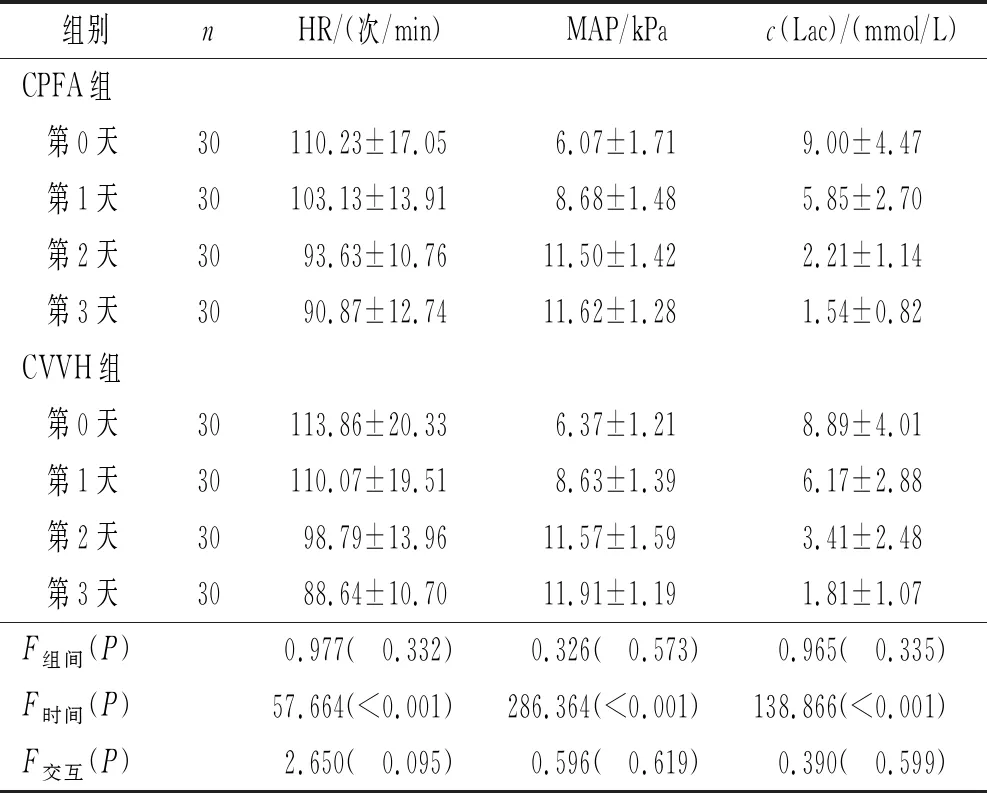
表3 两组患者HR、MAP和血清Lac的变化
2.4 两组患者OI和SOFA评分的比较两组患者治疗后OI均上升,SOFA评分均下降,两组间各指标相比差异无统计学意义,见表4。

表4 两组患者OI和SOFA评分的变化
2.5 CPFA、CVVH对14 d内血管活性药物停用的影响60例中3例14 d内死亡,5例数据不完整。应用CPFA的28例患者中,20例(71.43%)于14 d内停用血管活性药物;应用CVVH的24例患者中,9例(37.50%)于14 d内停用血管活性药物(χ2=6.031,P=0.014)。14 d内停用和未停用血管活性药物的患者临床资料的比较见表5。

表5 14 d内停用和未停用血管活性药物的患者临床资料的比较
以14 d内是否停用血管活性药物为因变量(停用为1,未停用为0),将有统计学意义的指标作为自变量(其中应用CPFA为1、未应用为0,其他指标根据实测值),行Logistic回归分析,结果显示CPFA、3 d Lac清除率和3 d ΔSOFA评分是影响血管活性药物应用时间长短的因素,见表6。

表6 脓毒性休克并ARDS患者14 d内停用血管活性药物影响因素的Logistic回归分析
3 讨论
脓毒性休克是脓毒症进展的最危重阶段,大量的炎症介质持续作用于肺部,炎症级联反应持续存在进展,最终演变为ARDS。研究[7]显示,感染所致ARDS患者的预后与全身炎症反应水平和免疫功能低下有关,因此早期及时阻断炎症介质的持续作用对改善患者预后至关重要。
脓毒性休克并发ARDS患者均存在血流动力学紊乱,表现为血压下降、HR增快、血Lac升高、OI下降,纠正其紊乱是治疗ARDS的重要组成部分。在传统治疗基础上,应用血液净化技术,早期及时阻断炎症介质的持续作用至关重要。CPFA为一种新型的血液净化技术,大大强化了吸附机制对可溶性炎症介质的清除,且其对血小板、红细胞及凝血功能的影响小,不需要输入外源性血浆及白蛋白,可避免输血等不良反应,理论上应该更有利于脓毒症相关ARDS的治疗。
脓毒性休克并ARDS的发病过程中,体内出现大量炎症因子如TNF-α、TNF-β、IL-6、IL-8、IL-10等,它们之间相互作用,形成正反馈,引起“瀑布效应”,使机体促炎/抗炎机制失衡,继而导致组织损伤及多器官功能不全。IL-6是在一定刺激条件下由T细胞、B细胞和单核-巨噬细胞等产生的,其诱导B细胞分化和产生抗体,并诱导T细胞增殖和分化,参与机体的免疫应答,是炎性反应的促发剂,反映宿主炎症反应与疾病严重程度[8]。TNF-α是一种由激活的巨噬细胞产生的细胞因子,是炎症反应过程中出现最早、最重要的炎性介质,能激活中性粒细胞和淋巴细胞,使血管内皮细胞通透性增加,间接介导强烈的血管舒张,导致低血压和组织灌注减少[9-10]。炎症反应在导致促炎介质产生的同时,也诱发抗炎介质产生,如IL-10和TGF-α。研究[11]表明,在ICU住院期间未存活的急性肾功能衰竭患者的促炎因子(IL-6和IL-8)及抗炎因子(IL-10)水平明显高于幸存者,且不管是否存在脓毒症,这3种炎症因子水平的增加都与死亡风险的增加有关。炎症反应的转归取决于促炎及抗炎介质这两类物质的平衡[12]。本研究发现CPFA治疗后,IL-6和TNF-α等促炎介质水平均下降,同时IL-10等抗炎介质水平也明显下降,这与以往研究[13]结果一致。
既往研究[14]表明,在脓毒性休克患者中CPFA治疗后MAP增加,同时患者的心脏指数及血管紧张度也逐渐改善。本研究发现,在脓毒性休克并ARDS患者中,CPFA治疗后MAP均上升,但与CVVH组相比差异无统计学意义,可能原因在于两组常规治疗时,CVVH组血管活性药物用量比CPFA组大,造成MAP上升。本研究结果表明,CPFA是影响脓毒性休克并ARDS患者14 d内停用血管活性药物的因素。应用CPFA的28例患者中,20例于14 d内停用血管活性药物,而应用CVVH的24例患者中,9例于14 d内停用血管活性药物,表明与CVVH模式相比,CPFA模式能有效地缩短脓毒性休克并ARDS患者血管活性药物的应用时间,有助于尽快稳定患者血流动力学。ARDS是血流动力学在肺部的表现,肺的气血交换屏障遭到破坏,肺毛细血管通透性增加,导致肺水肿,患者发生严重的低氧血症。本研究发现,CPFA治疗后患者OI明显升高,SOFA评分显著下降,说明CPFA可改善肺气血交换功能,减轻肺水肿,同时改善全身器官功能[15]。
综上所述,CPFA与传统的血液净化模式CVVH相比,能有效清除炎症介质,削弱系统性炎症反应的瀑布式级联反应,使促炎/抗炎尽快达到平衡,恢复机体的免疫内稳态,更快稳定血流动力学,改善器官功能,值得临床推广使用。