基于单细胞RNA测序的人羊水间充质干细胞异质性分析
2022-08-10郑玉婷朱晓帆杨宇霞郭瑞霞孔祥东
郑玉婷,朱晓帆,杨宇霞,郭瑞霞,孔祥东
1)郑州大学第一附属医院遗传与产前诊断中心 郑州 450052 2)郑州大学第一附属医院急诊内科 郑州 450052 3)郑州大学第一附属医院妇产科 郑州 450052
间充质干细胞(mesenchymal stromal cell,MSC)是具有自我更新、多向分化和免疫调节特性的多能细胞[1],它可以从多种组织获得,如骨髓、脂肪组织、脐带和胎盘[2-3]。2006年,国际细胞治疗学会确立了MSC细胞的基本判定标准,包括细胞表面表达CD90、CD105和CD73,以及不表达CD45、CD34、CD14、CD79和HLA-DR[4],但该标准只定义了基本的形态和功能特征。MSC存在异质性,且MSC的异质性被认为是其基础和转化研究进展以及MSC疗法发展中的主要障碍[5-6]。人羊水间充质干细胞(amniotic fluid mesenchymal stem cell,AF-MSC)是在富含血清的培养条件下从羊水中分离出来的一种贴壁细胞[7-8],在自体移植的临床应用中安全性较高[9]。对AF-MSC异质性的潜在分子机制的研究有助于亚型的鉴定,细化其细胞亚群的体外分离。
近年来,单细胞RNA测序(scRNA-seq)技术已成为研究组织和细胞异质性的有力工具,而10x scRNA-seq平台因其能一次性获取大量单细胞而被广泛应用。ScRNA-seq可以在单细胞分辨率下生成单个细胞的独特的转录组并建立基因调控网络,细化细胞亚群分类,获得不同亚群间的分子标志。本研究基于10x scRNA-seq平台对体外培养的人AF-MSC进行分析,确定人AF-MSC的细胞亚群和各群的分子标志物,为人AF-MSC更好地应用提供基础。
1 材料与方法
1.1 羊水获取选取2018至2020年于郑州大学第一附属医院遗传与产前诊断中心进行孕期检查的孕16~24周孕妇,于超声引导下行羊膜腔穿刺术抽取羊水10~15 mL,将常规检查后提示正常的剩余羊水样本保存备用。本研究经该院伦理委员会审核批准(KS-2018-KY-36),并取得孕妇的知情同意。
1.2 人AF-MSC的分离和培养将收集到的正常羊水室温下1 500 r/min离心8 min,沉淀用8 mL羊水细胞培养基(以色列 BI公司)重悬并转移至2个T25培养瓶中。原代羊水细胞培养7 d,镜下观察到有散在的贴壁细胞出现;更换培养液,贴壁细胞继续培养3 d,镜下观察细胞形态,标记出成纤维样细胞集落的生长范围,然后用无菌细胞刮刀刮除标定区域以外的上皮样细胞集落,用PBS溶液轻轻冲洗3次,并向每个培养瓶中添加5 mL完全培养基继续培养,每2 d换液;重复上述操作3次,剩余成纤维样细胞呈漩涡状排列,即得到初步纯化的成纤维样细胞。待成纤维样细胞生长至80%融合时,按1∶3的比例传代。通过流式细胞术对第5代贴壁细胞表面标记物进行鉴定,确定其为AF-MSC细胞。
1.3 单细胞文库制备和测序取检测剩余第5代贴壁细胞,用2.5 g/L胰蛋白酶溶液(美国Sigma公司)消化,PBS洗涤3遍。使用Countess®Ⅱ Automated Cell Counter进行细胞计数和细胞活率测定,要求细胞大小均一,细胞活率≥85%。调整细胞密度至1×106个/mL。采用10x scRNA-seq平台,按照10x Genomics Single Cell 3′v3试剂盒(美国Genomics公司)说明书操作,进行油包水实验,制备单细胞微滴并制备测序文库。应用Illumina测序平台的双端测序模式对建好的文库进行高通量测序。
1.4 数据分析利用10x Genomics平台推荐分析的软件Cell Ranger 5.0对原始数据进行过滤、比对、定量,并对潜在的多细胞进行筛选,最终得到各细胞的基因表达矩阵。采用R 4.1.0对数据进行过滤、标准化,应用Seurat包中的FindClusters函数进行细胞聚类分群,应用CellCycleScoring函数对细胞周期进行判定,应用FindAllMarkers函数获得亚群的标记基因,应用Schwalie等[10]的方法对亚群的分化能力进行预测;应用ClusterProfiler包对亚群标记基因进行GO通路富集分析。同时对一些细胞表面标志物在本研究中的表达水平进行了分析。
2 结果
2.1 人AF-MSC的10x scRNA-seq数据质控结果此次10x scRNA-seq实验中悬液上样量为700~1 000个/μL,上样体积<10 μL,单样本捕获量设定为3 000个细胞。上样细胞得率为75%~80%,符合预期。下机结果分析后显示共检测到7 443个细胞,每个细胞基因检测数中位数为5 971。根据图1中的基因数和线粒体数分别设置过滤参数及阈值。过滤掉多重细胞、基因数小于200以及线粒体基因比例大于20%的低质量细胞,剩余 6 717个细胞参与后续分析。
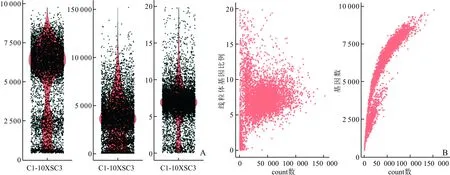
A:AF-MSC的基因数,count数,线粒体比率的小提琴图;B:AF-MSC的count数与线粒体基因比例和基因数之间的关系图
2.2 人AF-MSC单细胞聚类结果利用Seurat包中的FindClusters函数,将主成分分析中的dim值设置为30,分辨率设置为0.2,细胞被细分为7个亚群(图2A)。因为AF-MSC具有自我更新的特性,故我们分析了细胞周期对细胞聚类产生的影响,结果见图2B、C、D。其中亚群0、1、4、6由C1期、G2M期和S期细胞构成,亚群0和1构成比例相近,亚群4和6中G2M期细胞占比较低;亚群2和5由G1期和S期细胞组成,构成比相近;亚群3中G1期细胞占比最多。
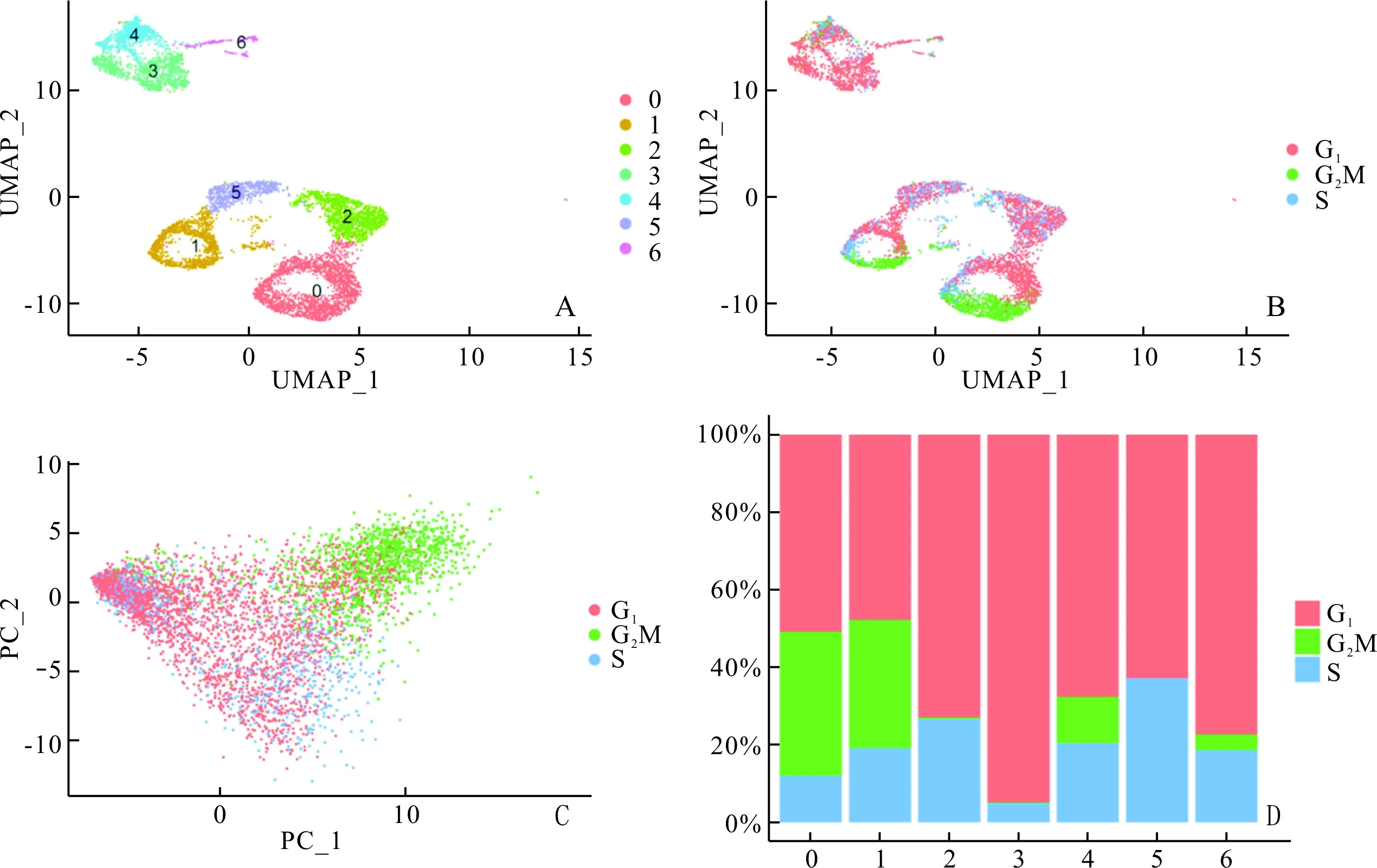
A、B:UMAP图展示细胞聚类分布情况,每个点代表一个细胞;C:细胞周期对主成分分析的影响;D:不同周期细胞在亚群中的占比
2.3 不同亚群的标记基因及其表达利用Seurat包中的FindAllMarkers函数获得不同亚群细胞的标记基因,并进行表达热图汇总,结果见图3A。对不同亚群标记基因表达水平进行分析,结果见图3B、C。与其他6组亚群相比,亚群4的基因表达量总体较低,且MSC表面标志物基因CD105、CD73、CD90表达量均较低,考虑其可能为非MSC。
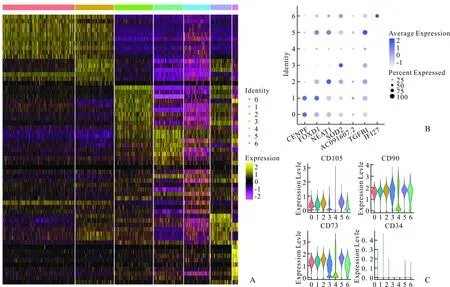
A:表达热图,显示亚群前10个表达差异显著的基因,黄色代表基因表达水平升高,颜色的亮度代表升高的程度,黄亮度最高的区域代表对应细胞亚群中差异显著的特异性标记基因;B:气泡图,显示亚群标记基因的表达水平;C:小提琴图,显示所有亚群MSC标记基因CD105、CD90、CD73、CD34的表达情况
2.4 不同亚群的分化能力预测及分析各亚群体外分化能力预测结果见图4。其中亚群5向各个方向分化的评分均较高;亚群2与亚群5评分相近,但其在成肌细胞分化方向得分较低。亚群0和1在软骨、成骨和神经方向的分化评分相似,但亚群1在成肌细胞分化方向的得分更高。而亚群4在各个方向的分化潜能均处于较低水平。
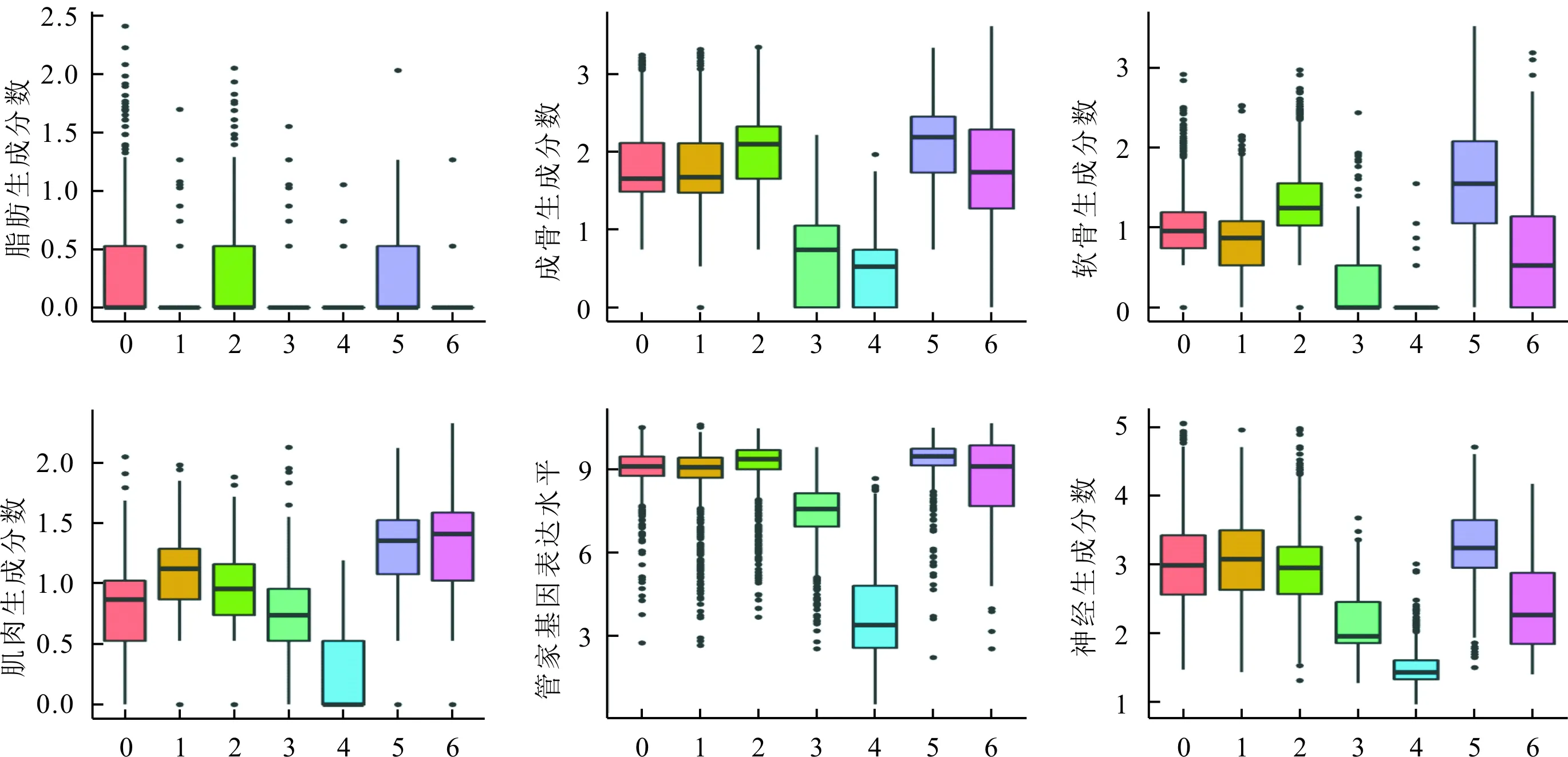
图4 不同细胞亚群(横坐标)分化能力预测
2.5 亚群标记物的通路富集分析对不同亚群的标记基因进行GO通路富集分析,结果见图5。分析结果显示亚群0和亚群1的标记物主要与细胞分裂期的RNA表达相关,集中在姐妹染色单体分离、有丝核分裂、染色体分离等通路;亚群2主要与内胚层的形成、细胞基质黏附、成骨作用相关;亚群3主要与核转录mRNA分解代谢过程、内质网蛋白质的定位相关;亚群4主要富集在氧化磷酸化、ATP代谢相关通路;亚群5主要与胶原代谢和对压力激素的反应相关;亚群6主要与细胞外基质的组成相关。
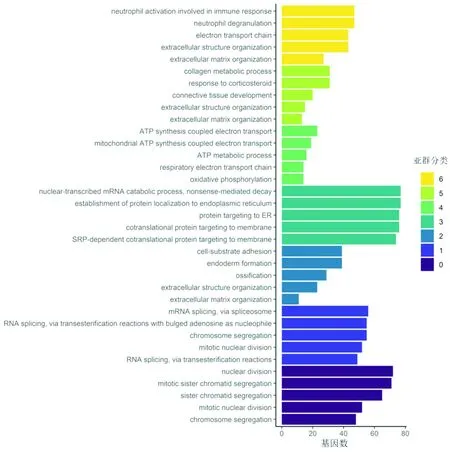
图5 不同亚群差异基因GO通路富集分析柱状图
2.6 人AF-MSC表面标志物表达情况见图6。多能干细胞表面标志物Oct-4、Nanog,内皮和造血干细胞表面标志物CD34、CD45和CD133,选择素如CD62E、CD62L、CD62P在人AF-MSC中均未见表达;整合素表面标志物ITGB1和ITGA5阳性表达,ITGA4和CD11a未见明显表达;表面抗原CD44阳性表达,而ICAM1和VCAM1在少量细胞中表达,CD31未见表达。
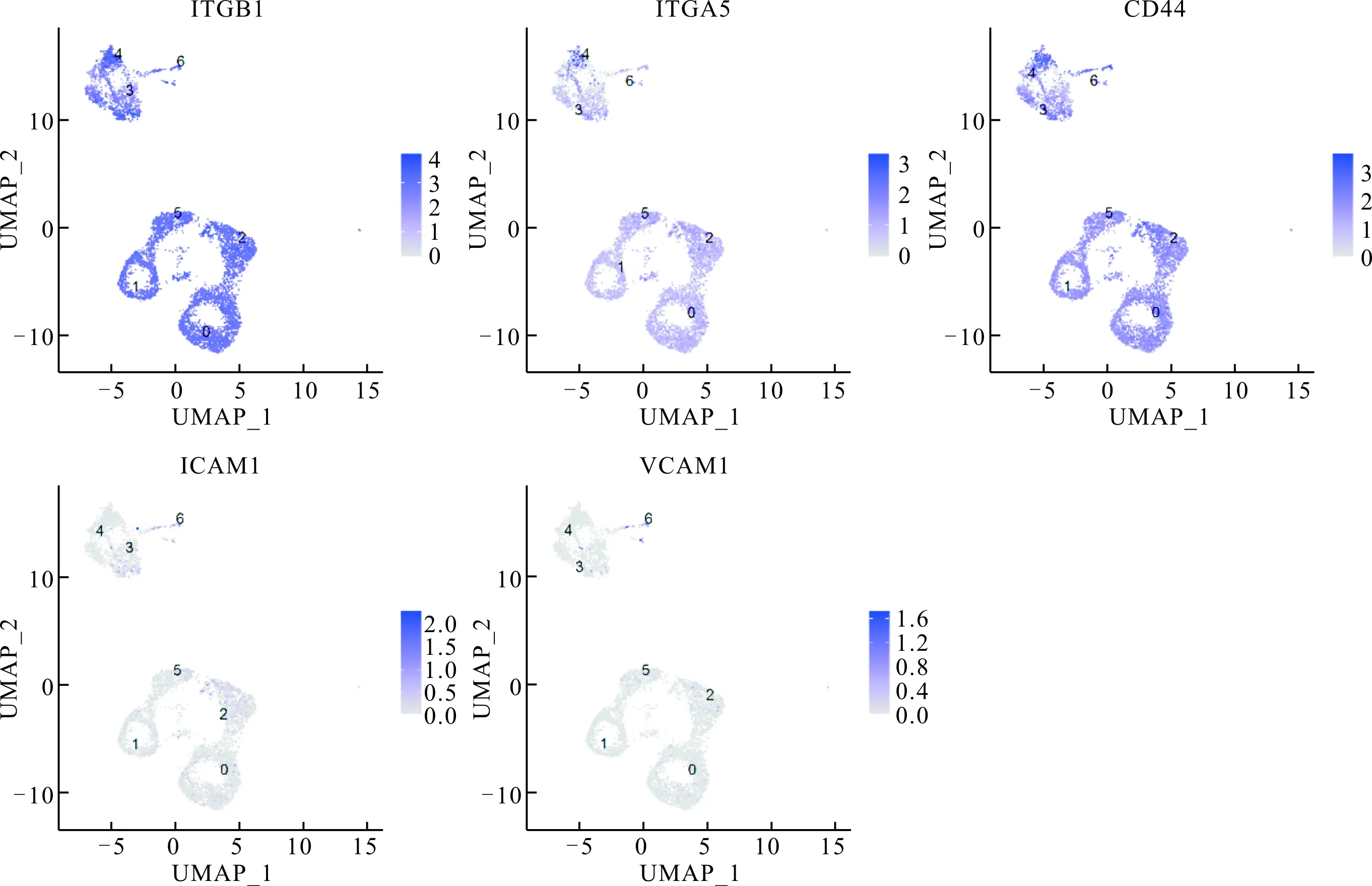
图右侧的纵向标识颜色表示基因在单个细胞中的表达情况
3 讨论
MSC在促进组织再生、抑制炎症、免疫治疗等方面具有巨大潜力,具有向多个方向分化的能力,在细胞治疗中具有重要的应用前景,但MSC的异质性却成为其临床转化的主要障碍。近来有研究通过单细胞转录组分析对培养型MSC的异质性进行了探究:Freeman 等[11]对小鼠骨髓MSC进行scRNA-seq,发现单细胞间多能性相关基因表达水平基本一致,但与成骨、成软骨、成脂、神经及血管平滑肌分化相关基因的表达水平有差异,免疫调节相关基因的表达也不一致;Wang等[12]进一步证实了骨髓MSC在人体内的异质性;Huang等[13]分析了361个来自2个脐带MSC的转录组,提出脐血MSC的异质性有限,且主要是由不同细胞周期所致;Liu等[5]对来自3名供者的 24 358 个离体培养的脂肪来源的MSC进行scRNA-seq,建立了脂肪MSC的转录组数据集。但人AF-MSC作为MSC的来源之一,其转录组异质性尚未在单细胞水平上得到研究。
本课题组前期临床研究[14]发现相同条件下体外培养的AF-MSC细胞表面标志物符合MSC要求,且传代后的细胞形态、染色体核型无明显改变。本研究对AF-MSC进行scRNA-seq,每个细胞检测基因中位数为5 971个基因,与文献[15]报道的MSC的scRNA-seq结果相一致。对单个细胞中基因数进行统计结果显示,部分细胞基因表达数在2 500个左右存在一个小的峰值,进一步对基因数为200~3 000的细胞进行分析,结果显示细胞聚类为7个亚群,且主要在亚群3(44%)和亚群4(48%)中,结合后续分析结果,考虑亚群3可能为初步分化的细胞,亚群4类型暂无法确定。本研究证实细胞周期对聚类分群产生了影响:不同周期细胞在亚群的分布情况及GO通路富集结果显示,细胞周期对于亚群的影响较大,该结果与Huang等[13]、Sun等[15]的研究结果相似。同时我们对AF-MSC表面标志物的表达情况进行了分析,结果与既往研究[16]结果相似。对于细胞表面标志物VCAM1,在Di Trapani等[16]和Cananzi等[17]的研究结果中有差异,而在我们的结果中显示在少量细胞阳性表达,提示单细胞测序可显示单个细胞水平的基因表达,可对基因表达情况进行更精确的判定。
综上所述,本实验结果与利用流式细胞术对AF-MSC的研究结果相吻合;且通过scRNA-seq对AF-MSC可以进行更细致的分群,为后续进一步研究AF-MSC的特征提供了研究基础。但本研究也有一定的局限性,由于纳入样本较少,且未进行后续实验验证,发现的结果仅具有一定的提示性,需要扩大样本量进一步验证。
