不同阴囊围度湖羊睾酮和雌二醇浓度及其合成相关基因的表达水平
2022-08-10刘佳美路婷婷要荣宇李发弟乐祥鹏李万宏
刘佳美,路婷婷,姚 婷,要荣宇,李发弟,2,乐祥鹏,李万宏
(1. 兰州大学草地农业生态系统国家重点实验室 / 农业农村部草牧业创新重点实验室 / 草地农业教育部工程研究中心 /草地农业科技学院, 甘肃 兰州 730020;2. 甘肃省肉羊繁育生物技术工程实验室, 甘肃 民勤 733300)
睾丸是公羊精子发生的场所,其发育质量直接关系到公羊的繁殖能力。Zamiri 等[1]研究表明公羊睾丸周长与精子浓度呈正相关关系。Yarney 等[2]发现13 月龄睾丸直径较大的公羊每日精子产量较高,17 月龄睾丸直径较大的公羊产生更多的精子,且精子活力更高。在牛的研究中也有类似结果,Palasz等[3]发现公牛阴囊围度与精子畸形率负相关。阴囊围较大的公牛所配的母牛受胎率也较高[4]。基于睾丸大小与精子发生和精液质量呈正相关关系,生产上,往往将睾丸大小作为选择种公羊繁殖力的重要指标之一。在对睾丸的测量方法中,阴囊围度测定简单、遗传力高,是初步评估性成熟后种公畜繁殖力的最佳指标[5]。因此,根据阴囊围度大小,选育具有高繁殖力的优良种公羊,提高精子产量和质量,从而提高受精率并增加优良种公羊的后代的数量,也是养羊生产提高经济效益的主要途径之一。
睾丸大小主要由睾丸支持细胞数目所决定,同时支持细胞数目还决定了精子产量。睾丸发育和精子发生受到下丘脑-垂体-性腺轴系的激素调控,垂体分泌的促性腺激素分别与睾丸间质细胞和支持细胞上受体结合后,通过调节类固醇激素合成和释放进而影响睾丸内细胞增殖、精子发生等生物学事件。以往关于睾丸大小和精子发生的研究主要集中在公羊配种期阶段,而初情期到性成熟阶段是湖羊出生后睾丸快速发育的关键时期,其睾丸内环境对睾丸发育和成年后繁殖能力至关重要。孙武[6]研究发现湖羊精子发生与睾丸大小密切相关,与小睾丸组相比,大睾丸组生殖细胞的体积和细胞核明显较大,且生殖细胞间的胞质桥明显增大,GO 富集分析结果显示促黄体素受体LHR(luteinizing hormone receptor)被显著富集到精子发生条目。因此,为了探究不同繁殖力公羊睾丸内类固醇激素合成差异,本研究选择断奶后在相同饲养条件下生长至165 日龄的湖羊公羔,根据阴囊围大小,选择大围度组(高繁殖力)和小围度组(低繁殖力)公羊个体,采用ELISA、实时荧光定量qPCR 及H.E 染色等方法,研究其外周血液睾酮、雌二醇水平、睾丸内促性腺激素受体、类固醇激素合成相关基因及蛋白的表达、睾丸组织形态学以及附睾精子数的差异,为根据阴囊围度大小选择繁殖力高的公羔提供科学依据。
1 材料与方法
1.1 试剂
Trizol 购于TransGen Biotech,反转录试剂盒及荧光定量qPCR 试剂盒购于Takara,绵羊睾酮和雌二醇ELISA 检测试剂盒购于CUSABIO,BCA 蛋白浓度测定试剂盒和PMSF 购于碧云天生物技术有限公 司,Tris-HCl (pH 7.4)、Tris-HCl (pH 8.8)、Tris-HCl(pH 6.8)、SDS 购于Solarbio,TPER 组织蛋白抽提剂和超敏ECL 化学发光试剂盒购于Thermo Scientific,5 × 上样缓冲液购于Biosharp,0.45 μm PVDF 膜购于Millipore,兔多抗ACTB 购于proteintech,兔多抗FSHR、兔多抗HSD3B1 以及羊抗兔IgG (HRP)购于Abcam,三色蛋白预染marker 购于上海翊圣生物科技有限公司,Tween 20 和脱脂奶粉购于Biofroxx。
1.2 试验动物与样品采集
参照莫负涛[7]方法,选择137 只体况良好的断奶湖羊公羔在民勤中天羊业有限公司饲喂相同日粮,在相同环境下饲养至165 日龄。用软尺测量所有羊只阴囊围度大小,根据睾丸发育状况[6]和阴囊围大小,选取两侧睾丸发育一致的个体18 只,分为小围度组S [(18.53 ± 0.42) cm]和大围度组L [(27.29 ±1.13 cm],每组9 只。颈静脉采集血液后进行屠宰,分离睾丸鞘膜和精索后,利用天平分别测定睾丸和附睾重量,利用排水法测定睾丸体积。采集左侧睾丸组织,一份保存于液氮,另一份多聚甲醛固定。
阴囊围度为两侧睾丸并行时,阴囊最大处的水平周径。
睾丸体积利用排水法测定,即将睾丸放入盛满生理盐水的烧杯中,溢出水的体积计为睾丸体积。
睾丸系数 = 睾丸重量/体重 × 100%。
1.3 试验方法
1.3.1 睾酮和雌二醇浓度测定
将外周血液在4 ℃条件下1 000 r·min−1离心30 min分离血清。按照说明书,利用绵羊睾酮、雌二醇ELISA 检测试剂盒测定血清中睾酮和雌二醇。
1.3.2 附睾精子数测定
采集左侧附睾尾部,称取重量后剪碎,加入50 mL生理盐水后放在37 ℃水浴锅孵育30 min,然后利用血球计数板统计精子数量,精子密度用附睾组织重量进行校准。
1.3.3 睾丸组织H.E 染色
取睾丸组织(1 cm3)在10 %多聚甲醛中固定,脱水、透明、石蜡包埋后制作成厚度为4 μm 的切片。经H.E 染色后,用Scopeimage 9.0 软件在100 倍拍照并测量,每个睾丸随机选择6~10 个生精小管利用十字交叉法测量其直径。
1.3.4 睾丸组织RNA 提取与反转录
利用Trizol 法提取睾丸组织总RNA,经电泳和NanoDrop 2000 检测总RNA 的质量后,取总RNA 2 μL,依次加入5 μL RNase free H2O,1 μL gDNA eraser和2 μL 5 × gDNA Eraser Buffer,42 ℃ 10 min 去 除
DNA 残留,冰水冷却后加入1 μL RNase free H2O,4 μL Primer Mix,4 μL 5 × PrimerScript Buffer 和1 μL RT Enzyme Mix,混匀后经42 ℃ 25 min 反转录合成cDNA,85 ℃ 5 s 灭活后稀释20 倍备用[8]。
1.3.5 实时荧光定量qPCR
利用实时荧光定量qPCR 方法检测促性腺激素受体基因FSHR、LHR以及类固醇激素代谢相关基因STAR、HSD3B1、CYP19A1、CYP11A1和ABP表达量。引物由上海生工合成(表1)。PCR 反应体系为:10 μL 2 × SYBR Ex Taq,4 μL ddH2O,1 μL 引物和5 μL cDNA。混匀后95 ℃ 4 min;然后95 ℃ 15 s,60 ℃35 s,40 个循环。通过熔解曲线判断引物特异性。以ACTB作为内参基因,利用2−ΔΔCt法计算各基因的相对表达量。

表1 荧光定量PCR 引物Table 1 Primer sequences used for qPCR
1.3.6 Western Blot (WB)
在液氮中充分研磨睾丸组织样品,按照重量体积比为1 ∶ 20 将组织粉末加入到混有PMSF 的TPER 组织蛋白抽提剂(TPER ∶ PMSF=100 ∶ 1),涡旋振荡1 min,在4 ℃和 − 20 ℃反复冻融两次,取上清液,用BCA蛋白浓度测定试剂盒检测蛋白浓度。取稀释至2 μg·μL−1的蛋白样品20 μL,加入5 μL 5 × 上样缓冲液,95 ℃变性5 min。恒压80 V 电泳约30 min,在浓缩胶中压成一条直线,再120 V 电泳1 h 30 min。采用负极-滤纸-胶-膜-滤纸-正极的三明治结构,恒流0.2 A 转膜2 h。之后用5%脱脂奶粉常温摇床封闭2 h。一抗采用兔抗ACTB、FSHR、HSD3B1,分别按照1 ∶ 4 000、1 ∶ 800 和1 ∶ 1 200 稀释,4 ℃孵育过夜。用1 ∶ 8 000 稀释的二抗常温摇床孵育1 h。将添加了显影液的PVDF 膜放置在BIO-RAD 凝胶成像仪中进行扫描。采用ImageJ 进行图像分析。
1.4 数据分析
试验结果以平均数 ± 标准误表示,利用SPSS 13.0 进行统计学分析,利用Levene 检验方差齐性,两组间差异比较使用独立样本t检验,P< 0.05 表示差异显著,P< 0.01 表示差异极显著。
2 结果
2.1 不同阴囊围度湖羊的睾丸发育状况及组织形态学观察
本研究测量的137 只湖羊阴囊围度分布中(图1),最小值为15.8 cm,最大为32.8 cm。选择用于后续研究的18 只羊睾丸参数表明(表2),L 组湖羊阴囊围度、睾丸重量、睾丸体积、睾丸系数、附睾重量和附睾尾部精子数量均极显著高于S 组湖羊(P< 0.01)。L 组睾丸组织曲细精管生精上皮有多层不同发育阶段的生精细胞,管腔内可见精子(图2),L 组睾丸组织曲细精管直径极显著高于S 组(P< 0.01)。
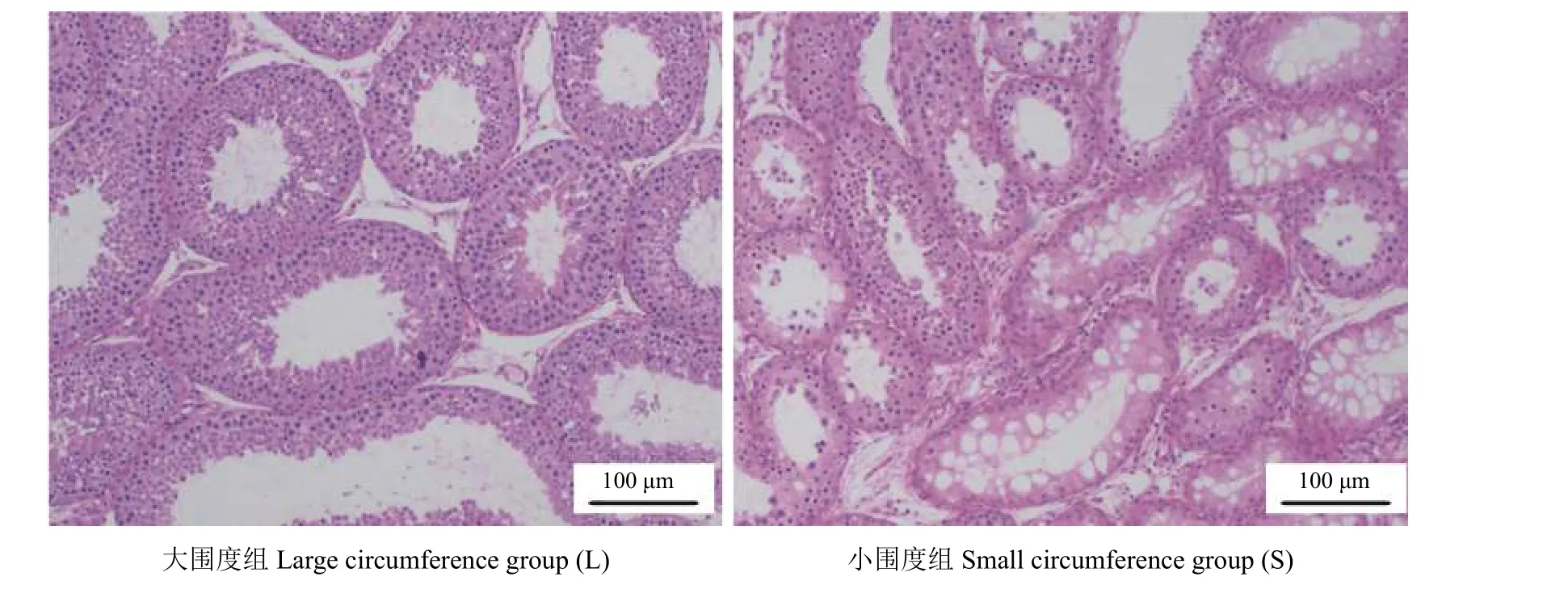
图2 不同阴囊围度湖羊睾丸组织形态学观察(100 × )Figure 2 Histomorphological observation of the testis of Hu sheep with different scrotal circumference (100 × )
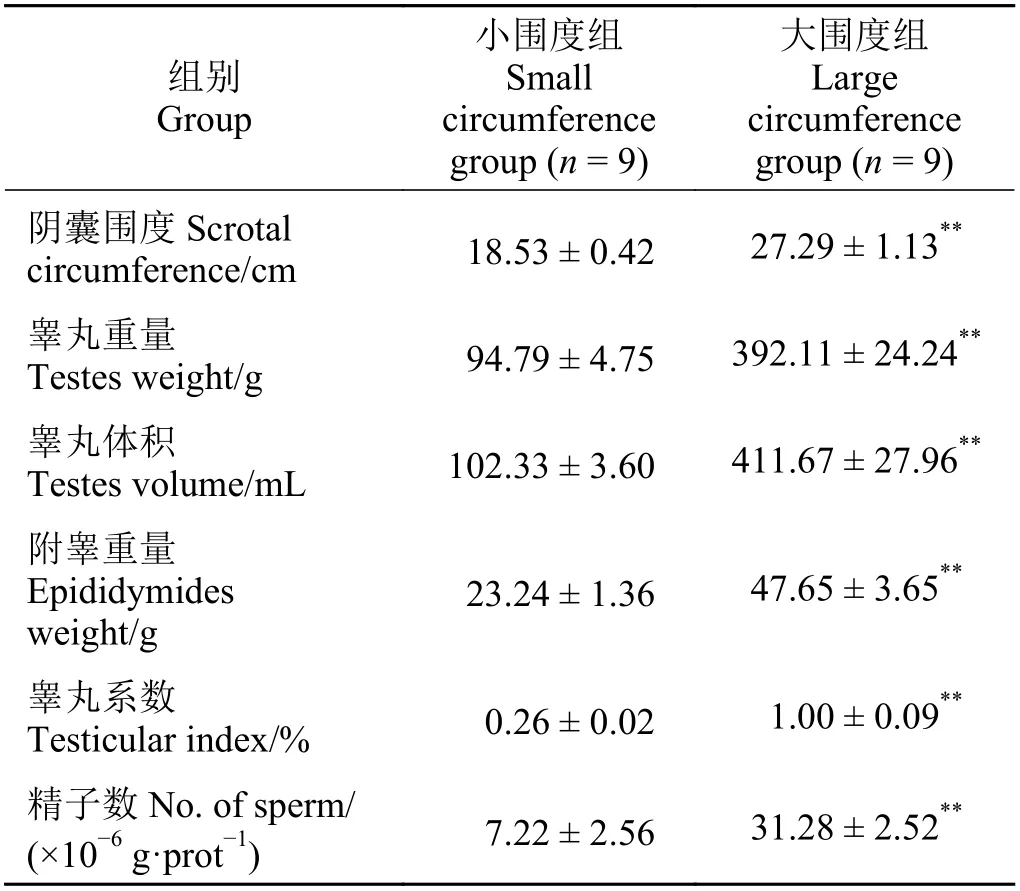
表2 不同阴囊围度湖羊的睾丸发育状况Table 2 Testicular development of Hu sheep with different scrotal circumference
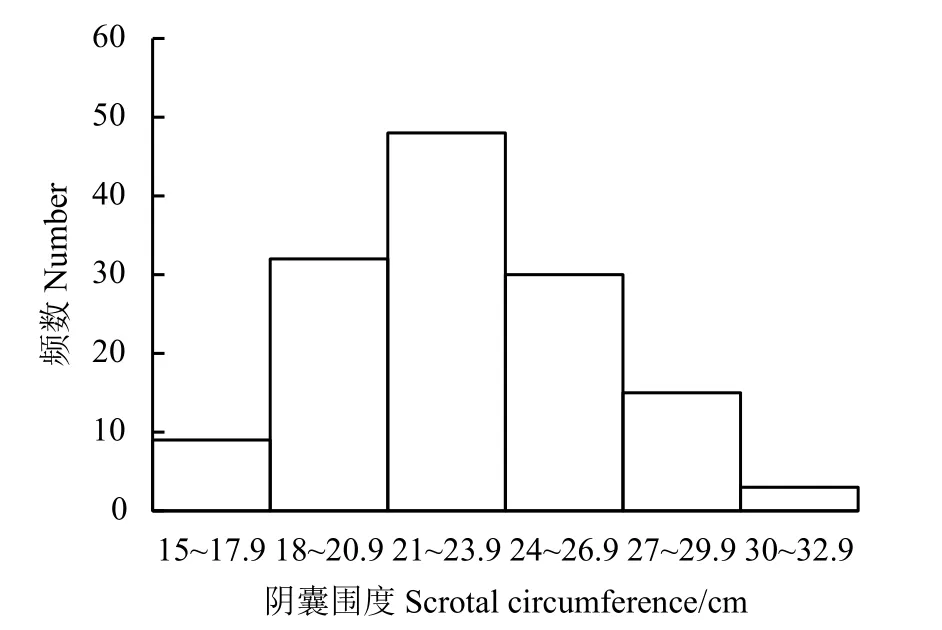
图1 试验羊阴囊围度直方图Figure 1 Histogram of scrotal circumference
2.2 不同阴囊围度湖羊外周血液睾酮和雌二醇浓度
与S 组相比,L 组湖羊外周血液中睾酮和雌二醇浓度均显著升高(P< 0.05) (表3)。

表3 不同阴囊围度湖羊外周血液睾酮和雌二醇浓度Table 3 Plasma concentration of testosterone and estradiol in Hu sheep with different scrotal circumference
2.3 不同阴囊围度湖羊睾丸组织中类固醇激素代谢相关基因及蛋白表达
与S 组相比,L 组HSD3B1、CYP19A1、ABP表达极显著上调(P< 0.01),STAR、FSHR、LHR表达显著上调(P< 0.05),CYP11A1基因表达上调,差异不显著(P= 0.086) (图3)。WB 结果显示,与S 组相比较,L 组HSD3B1 表达显著上调(P< 0.05) (图4、图5)。
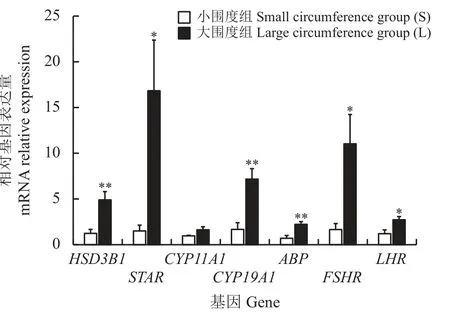
图3 不同阴囊围度湖羊睾丸组织中类固醇激素代谢相关基因表达Figure 3 Expression of steroidogenesis-related genes in testis of Hu sheep with different scrotal circumference
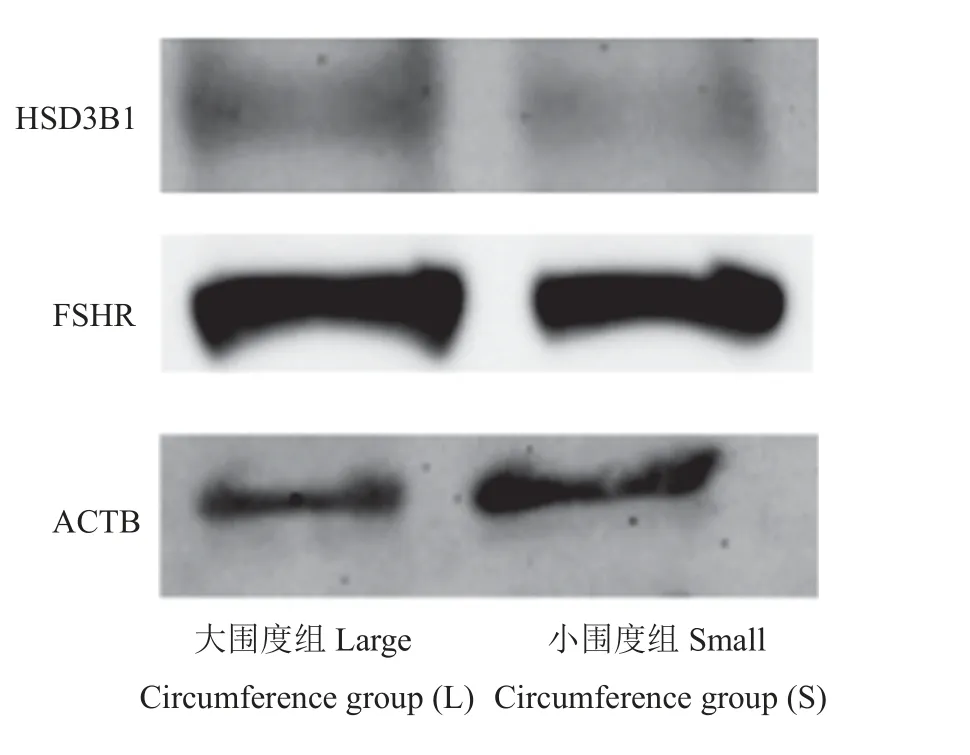
图4 不同阴囊围度湖羊睾丸组织中相关蛋白WB 分析Figure 4 WB analysis of steroidogenesis-related proteins in testis of Hu sheep with different scrotal circumference

图5 不同阴囊围度湖羊睾丸组织中相关蛋白表达分析Figure 5 WB analysis of steroidogenesis-related proteins in testis of Hu sheep with different scrotal circumference
3 讨论
睾酮是由睾丸间质细胞合成和分泌的类固醇激素,高浓度的睾酮能够促进睾丸发育[9]。间质细胞的增殖分化和睾酮的合成均受到垂体分泌的LH 的调控[10]。岳根华和张泉福[11]发现湖羊公羔出生后早期血浆LH 浓度与睾丸重量、直径正相关,且血浆LH 浓度高于晚熟品种考力代羊,说明湖羊出生后睾丸发育启动时间早、性成熟早与其生后早期较高血浆LH 水平有关。LH 与间质细胞上的LHR 结合后激活cAMP-PKA 途径和SF-1 途径[12],促进睾酮合成关键酶STAR 基因的表达[13]。胆固醇作为合成睾酮的原料,被STAR 转运至线粒体内膜,在芳香化酶CYP11A1 的催化作用下生成孕烯醇酮,然后在光面内质网处经HSD3B1 催化转化为孕酮,之后依次经过CYP17A1 和HSD17B3 的催化作用最终生成睾酮。在小鼠的研究中发现,LHR敲除小鼠血清睾酮含量显著低于野生型小鼠,睾丸曲细精管较窄,间质细胞的数量和大小显著减少,而且精子发生在圆形精子细胞阶段受阻[14]。与野生型相比,LHR基因敲除小鼠睾丸中 STAR、CYP11A1 和HSD17B3 的蛋白表达在3 周龄后均显著降低[15]。在本研究中,L 组参与调控睾酮合成的相关基因HSD3B1在mRNA 水平极显著上调,LHR、STAR的表达显著上调,CYP11A1的表达呈上调趋势,HSD3B1 蛋白水平也显著上调,促进类固醇激素合成,进而导致湖羊外周血液中睾酮水平显著升高。有研究表明,在初情期前LH 和睾酮浓度更高、睾丸更大的公羊,更有利于精子的发生[16]。在Palasz 等[3]的研究中,1 周岁肉牛的睾酮峰值水平与阴囊围度正相关。本研究中L 组间质细胞合成睾酮能力较强,引起外周血液睾酮浓度升高。同时合成的睾酮进入曲细精管管腔和支持细胞分泌的ABP 结合,在曲细精管管腔内形成局部高浓度睾酮的富集,刺激曲细精管发育和精子发生。本研究中L 组睾丸曲细精管直径增加,生精上皮有多层不同发育阶段的生精细胞,管腔内的成熟精子增多,附睾尾部精子数也明显增加,均说明睾酮促进了睾丸的发育,有利于维持精子的正常发生和成熟。
睾丸发育过程中,支持细胞的数量对睾丸的大小起着决定性作用,支持细胞在初情期时迅速增殖,在性成熟后停止增殖[17]。FSH 能够与支持细胞表面的FSHR 结合,刺激支持细胞增殖[18]。支持细胞成熟后激活精子发生,导致生精上皮中精子形成[19]。FSHR 基因敲除的小鼠,初情期后睾丸体积变小[20]。本研究中,L 组睾丸中FSHR在mRNA 水平的表达显著高于S 组,这与前期研究相一致。另外,间质细胞合成的睾酮还可以在支持细胞中经芳香化酶CYP19A1 的催化作用转化成雌二醇[21],促进支持细胞增殖和维持精子发生[22-23],有利于精子的存活[24]。睾丸组织中有大量的雌激素受体表达[25]。FSH 可通过支持细胞表面FSHR 的作用,显著提高未成年小鼠的芳香化酶活性,引起10 日龄的小鼠雌二醇分泌提高[26]。体外研究表明,雌二醇能抑制新生期小鼠睾丸支持细胞的分化,诱导支持细胞的增殖[27]。在本研究中,L 组湖羊睾丸中雌二醇合成关键酶基因CYP19A1表达极显著上调,外周血液中雌二醇含量也随之显著升高,进一步促进曲细精管发育和精子发生,这与附睾中精子数增加相一致。
4 结论
综上所述,阴囊围度大的165 日龄湖羊公羔控制类固醇激素合成相关蛋白以及基因表达水平显著高于阴囊围度小的湖羊公羔,进而导致阴囊围度大的湖羊公羔的睾酮和雌二醇分泌增强,其更具有较好的生精环境并有利于睾丸发育和精子发生。
