基于GEO数据库分析CRABP2在食管鳞癌中的表达及作用
2022-08-10李梦妍马遇庆
李 超,李梦妍,马遇庆
(新疆医科大学第一附属医院1呼吸与呼吸危重症医学科,2病理科,乌鲁木齐 830054)
食管癌是我国高发的恶性肿瘤之一[1],其组织病理分型多以食管鳞癌为主。据统计,我国食管癌每年新发病例数约32 万,死亡病例数约30 万[2-3]。全世界食管癌每年新发病例数约60.4万,死亡病例数54.4万[4],我国的食管癌占全球食管癌整体发病和死亡病例的50%[5]。食管癌具有高侵袭性、高转移性及高死亡率的特点,其确诊时常已伴有肿瘤进展或转移。我国70%的食管癌患者就诊时已属中晚期[6]。晚期或已远处转移的食管鳞癌患者的一线治疗疗效不佳,二线PD-1 单克隆抗体卡瑞利珠单抗治疗尚在III期临床研究阶段[7],因此探寻治疗食管鳞癌新的靶向药物尤为重要。细胞维甲酸结合蛋白(CRABP)保护维甲酸免受氧化,使维甲酸溶解并协助维甲酸转运,包括CRABP1和CRABP2两种亚型。CRABP2结合细胞内全反式维甲酸(ATRA)并转运至细胞核内,与维甲酸X受体(RXR)、维甲酸受体(RAR)结合发挥转录功能,抑制肿瘤发展。同时,CRABP2 还能对ATRA进行修饰。在乳腺癌细胞中,CRABP2通过RAR修饰ATRA 抑制肿瘤生长[8]。研究发现,CRABP2 高表达时,维甲酸入核与维甲酸受体(RAR)结合促进肿瘤细胞凋亡,抑制肿瘤增殖;而CRABP2低表达时,维甲酸与脂肪酸结合蛋白5(FABP5)结合并转运入核与过氧化物酶体增殖物激活受体δ/β(PPARδ/β)结合促进肿瘤形成[9]。全反式维甲酸(All trans retinoic acid,ATRA)属于类维甲酸家族成员,是维生素A的活性代谢产物,在细胞增殖、分化、凋亡和胚胎发育中具有重要作用。有研究发现,在乳腺癌[10]、肺癌[11-12]和口腔鳞癌[13]等肿瘤的治疗中,联合ATRA 化疗疗效优于单独化疗[14]。但目前有关CRAPB2 联合ATRA 在食管鳞癌的治疗研究中的报道较少。本研究检测食管鳞癌中CRABP2 的表达水平,观察CRABP2 联合ATRA对食管鳞癌细胞的作用,为今后食管鳞癌的临床治疗提供思路。
1 资料与方法
1.1 研究对象
1.1.1 GEO 数据库中食管鳞癌患者数据的收集 在GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)中以ESCC(食管鳞癌)为关键词进行检索,获得食管鳞癌相关数据集GSE20347(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE20347),包括17 例食管鳞癌患者的癌组织和食管正常组织,共34 个样本的mRNA测序数据。
1.1.2 食管鳞癌患者病理组织的收集 收集2008 年1月—2019 年6 月在新疆医科大学第一附属医院胸外科行“食管鳞癌根治手术”切除治疗的240 例食管鳞癌患者的癌及正常组织的组织芯片。纳入标准:术前未接受放疗或化疗;食管为原发病变部位。排除标准:非食管鳞癌患者;非食管原发肿瘤,其他部位肿瘤转移至食管者;非手术切除食管鳞癌患者;脱片造成的无法判断免疫组化染色结果者。资料收集已通过患者及家属知情同意,并通过新疆医科大学第一附属医院医学伦理委员会审批(20180223-08)。
1.1.3 食管鳞癌细胞株的培养 用短串重复序列(Short tandem repeats,STR)对KYSE150(武汉普诺赛生物科技有限公司)食管鳞癌细胞株进行分型技术鉴定,确保细胞株未发生变异,以便用于后续实验。培养条件:90%DMEM、10%胎牛血清,37℃,5%CO2的恒温细胞培养箱内培养。
1.2 方法
1.2.1 R软件处理GEO数据 采用R软件4.0进行GEO数据的下载、质量控制分析及处理。采用Limma包对GSE20347数据集中食管鳞癌组织和食管正常组织间的差异基因进行统计分析,以差异倍数|log2FC|>2,错误发现率(FDR)<0.05 为阈值筛选差异表达基因,观察CRABP2在食管鳞癌中的表达情况。
1.2.2 免疫组化染色 对所有组织芯片进行切片、脱蜡、3%过氧化氢液抗原修复、10%山羊血清封闭、加入兔单抗CRABP2(英国abcom 公司,ab211927)一抗4℃孵育过夜;第2 天加入兔/鼠通用二抗(中杉金桥,PV-6000)室温孵育30 min;DAB 显色,1%盐酸酒精分化,自来水返蓝、脱水,中性树胶封片,显微镜下观察并采集图像。
1.2.3 结果评定 由2 位病理科高级职称医师对切片进行综合评分,将染色强度阴性计为0 分、浅棕色计为1 分、棕色计为2 分、深棕色计为3 分;将染色阳性细胞百分率0%~10%计为0 分、11%~25%计为1 分、26%~50%计为2 分、51%~75%计为3 分、76%~100%计为4 分。根据上述指标计算出染色指数。染色指数=阳性细胞百分率×染色强度。染色指数总分为12分,大于1分判定为高表达,反之则判定为低表达[15]。
1.2.4 过表达CRABP2 稳转细胞株的构建 将KYSE150细胞以2×105个/孔的密度均匀铺板接种于6孔板,细胞完全贴壁生长,去除旧培养基,加入无血清培养基,按复感染指数(MOI)=20 加入慢病毒颗粒和HitransGA 100 μL,置于培养箱培养48~72 h,待细胞融合度达70%~80%时,用含嘌呤霉素的筛选培养基替换旧培养基,进行药物筛选稳转细胞株,构建过表达CRABP2(LV-CRABP2)稳转细胞株。
1.2.5 ATRA 干预浓度的确定 取处于对数生长期细胞,将生长状态良好的KYSE150细胞,以5×103个/孔,接入96 孔板,依次加入0、10、20、40、60、80、100 μmol/L 含ATRA 的培养基,培养48 h,每组设5 个复孔。每孔加入10 μL CCK-8,37℃培养4 h;测定450 nm 处的光密度值(OD),细胞存活率为70%~80%的浓度作为实验浓度,本实验将30 μmol/L 作为ATRA实验浓度。根据干预分为对照组(Control 组)、过表达CRABP2 组(LV-CRABP2 组)、全反式维甲酸组(ATRA 组)和过表达CRABP2 联合全反式维甲酸组(LV-CRABP2+ATRA组)。
1.2.6 蛋白免疫印迹实验 使用RIPA 裂解液(含蛋白酶抑制剂和磷酸酶抑制剂)裂解细胞。用BCA 蛋白质分析法(全式金公司,DQ111-01)定量后,加入loading 缓冲液(Solarbio 公司),在100℃下煮沸10 min蛋白质变性。SDS-PAGE 电泳并转膜,5%脱脂奶室温封闭0.5 h,加入一抗兔抗CRABP2(英国Abcam 公司,ab211927),4℃摇 床 孵 育 过 夜,用TBST(1%Tween20)洗涤3 次10 min,加入二抗HRP 标记羊抗兔二抗(博士德,BA1054),室温避光孵育2 h,洗膜后用Odyssey-Cx扫描并Band Scan分析胶片灰度值。
1.2.7 Transwell 实验 制备细胞悬液,将细胞以3×104个(300 μL)接种于Transwell 小室上室,将600 μL 含10%胎牛血清培养基接种于Transwell 小室下室,37℃、5%CO2孵育箱内培养72 h,用4%多聚甲醛液固定30 min,置于吉姆萨液中染色10 min,用棉签轻柔擦拭上室内Matrigel 基质胶,在倒置相差显微镜下观察细胞迁移、侵袭情况并拍照。
1.2.8 CCK-8实验 按实验分组进行96孔板内相同数量的活细胞铺种,铺种6 块96 孔板。分别在第0、1、2、3、4、5 天,在一块96孔板的实验孔中加入10%CCK-8 试剂100 μL,37℃避光孵育2 h,测定450 nm处的光密度值(OD)。
1.2.9 免疫荧光检测 按CCK-8 实验中的细胞分组制备细胞混悬液,将载玻片置于24孔板内,加入细胞混悬液,放入培养箱培养,待细胞贴壁后取出载玻片,用1 mL 4%多聚甲醛固定,1 mL 0.1%Triton-X100 透膜,5%PBS 脱脂乳封闭1 h,加入兔抗CRABP2,避光孵育4℃孵育过夜,加入羊抗兔IgG(H+L)(Alexa Flu⁃or 488)二抗,湿盒中37℃孵育1 h,DAPI 染色,50%甘油封片,激光共聚焦显微镜下观察,在红色和蓝色激发光下拍照记录。
1.3 统计学处理采用SPSS20.0 统计软件对数据进行分析,用GraphPad Prism9.0 对数据进行可视化处理。计量资料以均数±标准差(±s)表示,符合正态分布的数据采用t检验。计数资料以例(%)表示,采用χ2检验。多组间CCK-8 实验结果比较采用双因素重复测量方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 数据库分析结果GSE20347 数据集中发现,CRABP2 mRNA 在食管正常组织中的表达水平高于食管鳞癌组织,差异有统计学意义(P<0.05)(图1 A、1 B);CRABP2 在正常食管组织中的表达是食管鳞癌组织的9倍(log2FC=-3.19,FDR<0.001)(图1 C)。

图1 GSE20347数据集分析结果图
2.2 CRABP2 在食管组织中的表达情况240 例患者组织芯片中的172 例符合读片标准。免疫组化结果显示,CRABP2 在正常食管黏膜上皮细胞胞核、胞质中高表达(图2 A);在高表达食管鳞癌样本中,CRABP2 在胞质的表达升高,胞核表达相比胞质低(图2 B);低表达食管鳞癌样本中,CRABP2 在胞核、胞质中均未表达(图2 C)。CRABP2 在食管正常黏膜组织中的阳性表达率为100%(172/172),在食管鳞癌组织中CRABP2 的阳性表达率为75.6%(130/172),差异有统计学意义(χ2=47.84,P=0.000)。
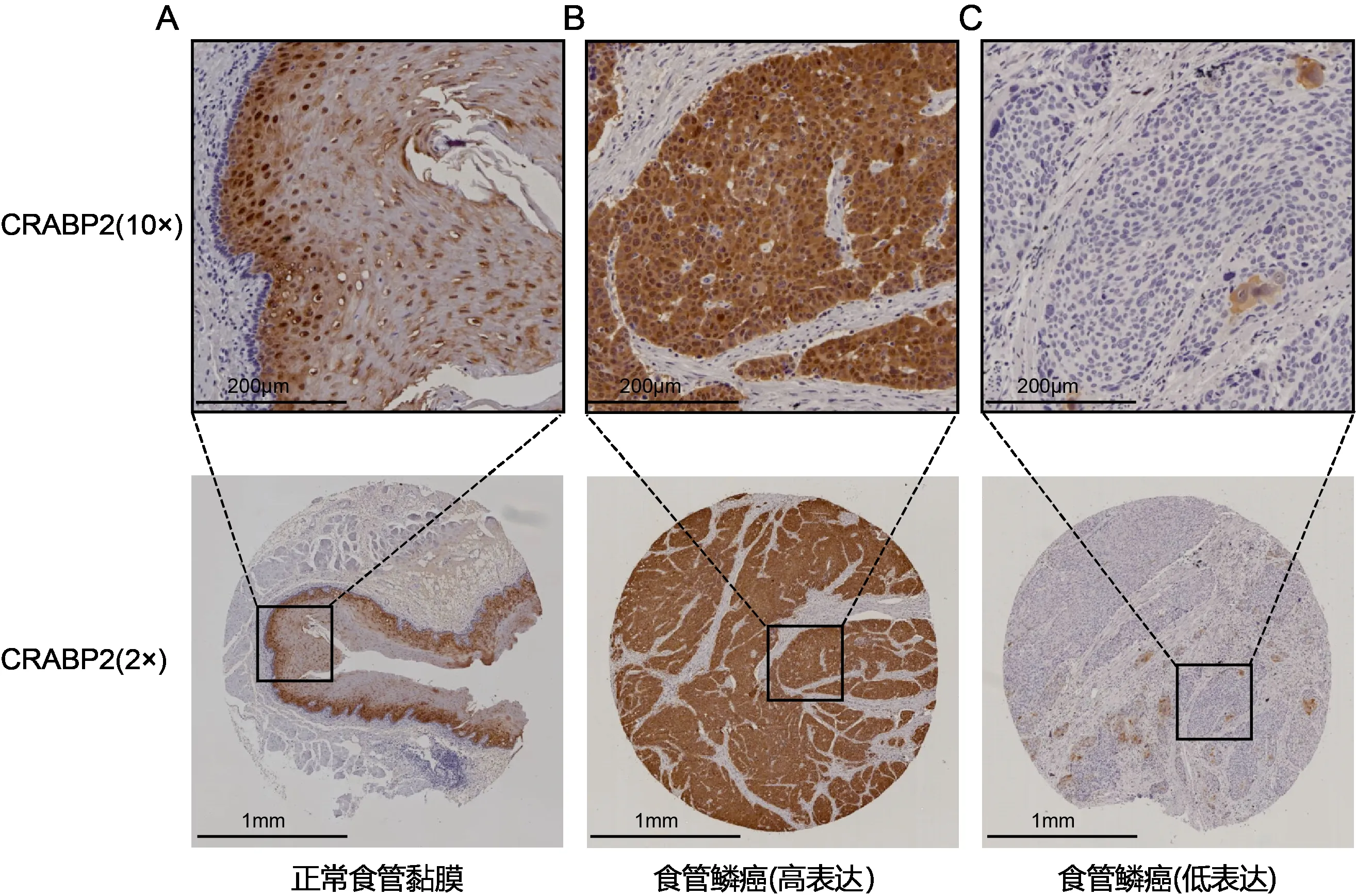
图2 CRABP2在正常食管黏膜组织和食管鳞癌组织中的表达情况
2.3 CRABP2联合ATRA对食管鳞癌细胞增殖、侵袭和迁移的影响Western blot结果显示,CRABP2、ATRA均可增加CRABP2蛋白表达水平,二者联用使CRABP2蛋白表达水平明显增加(图3 A)。Transwell 实验结果显 示,LV-CRABAP2 组、ATRA 组 和LV-CRABP2+ATRA 组与Control组比较,显著抑制细胞的迁移和侵袭,其中LV-CRABP2+ATRA 组与LV-CRABAP2 组、ATRA 组比较,抑制细胞的迁移和侵袭作用更加显著(图3 B)。CCK-8 实验结果显示,LV-CRABAP2 组、ATRA组、LV-CRABP2+ATRA 组与Control组比较,显著抑制了细胞的增殖,其中LV-CRABP2+ATRA 组与LV-CRABAP2组、ATRA组比较,抑制细胞增殖作用更加显著(图3 C)。免疫荧光实验显示,CRABP2在细胞质、细胞核中表达,其中以胞质表达为主;LV-CRABP2组未见CRABP2在胞质、胞核的表达显著增加,ATRA组和LV-CRABP2+ATRA组可见CRABP2在胞质的表达增加,尤其LV-CRABP2+ATRA 组中CRABP2 在胞质、胞核中的表达增加更为显著(图3 D)。

图3 CRABP2联合ATRA对食管鳞癌细胞增殖、侵袭和迁移的影响
3 讨论
ATRA 是维生素A 在体内发挥主要功能的活性代谢产物,维甲酸在肿瘤中发挥不同的作用取决于其结合的维甲酸受体,如结合维甲酸X受体(RXR)则激活分化、凋亡和细胞周期阻滞的基因;而结合PPARβ/δ 则诱导促进肿瘤增殖、血管生成和侵袭[16]。然而,维甲酸(RA)与受体结合取决于CRABP2 与脂肪酸结合蛋白5(FABP5)的蛋白浓度比值。比值高,RA激活RXR;比值低,RA激活PPARβ/δ[17]。CRABP2一直被认为是将RA 传递给RAR 的转运作用的蛋白质,但也有报道CRABP2 在RA 缺失条件下与人类抗原R(Human antigen R,HuR)结合共同调控众多转录本基因,参与调控肿瘤特性,发挥抑制肿瘤生长的作用[16]。
CRABP2 可能不仅是转运ATRA 入核的关键转运蛋白,也是有着决定细胞命运的关键蛋白。本课题组前期研究发现,食管鳞癌组织中CRABP2蛋白表达显著降低,而此次分析数据库研究中发现,食管鳞癌组织中CRABP2 mRNA 的表达显著低于食管正常组织,说明CRABP2在食管鳞癌中的转录和翻译水平的降低可能会导致ATRA 的转运作用的降低,促进食管肿瘤的发生、发展。目前,临床上ATRA 已成为治疗各类肿瘤的有效药物,还可能是增加分子靶向药物治疗疗效的重要辅助药物[18]。但CRABP2与ATRA在食管鳞癌中的作用研究较少。本研究发现,CRABP2 在食管鳞癌中低表达,进一步通过细胞功能实验发现,联合ATRA 能够显著增加CRABP2 的表达并能抑制细胞的增殖、迁移和侵袭。但既往研究发现CRABP2 在不同肿瘤中的作用有所不同[19],在甲状腺癌[20]、非小细胞肺癌[21]和肝癌[22]中,CRABP2 促进肿瘤细胞的增殖、侵袭及迁移。而Yang 等[23]的研究发现CRABP2在食管鳞癌中低表达,是食管鳞癌的抑癌基因,这与本研究的部分结果一致。本研究还发现,过表达CRABP2 或ATRA 使用能够增加食管鳞癌CRABP2 蛋白的表达并且抑制食管鳞癌细胞的增殖、迁移和侵袭;过表达CRABP2 联合ATRA 更加显著地增加CRABP2蛋白的表达,更有效地抑制食管鳞癌细胞增殖、迁移、侵袭的能力。说明CRABP2、ATRA 都能抑制食管鳞癌的发展,而二者联合使用效果更佳,这可以为维甲酸辅助治疗食管鳞癌提供实验依据。但本研究是基于临床组织样本的分析和体外细胞功能实验的研究,具体CRABP2联合维甲酸治疗食管鳞癌在体内成瘤实验中的效果有待动物实验进一步验证。
综上所述,CRABP2、ATRA 能够抑制食管鳞癌细胞的增殖、迁移和侵袭,而ATRA 联合CRABP2 抑制作用更佳,提示CRABP2可能是增强维甲酸抑制食管鳞癌发展的关键基因。
