中药渣有机肥+化肥对设施番茄和土壤细菌多样性的影响
2022-08-10刘晓梅苏文英王光飞郭德杰任立凯
刘晓梅,苏文英,纪 伟,王光飞,郭德杰,马 艳,任立凯*
(1.连云港市农业科学院,江苏 连云港 222000;2.江苏省农业科学院 资源与环境研究所,江苏 南京 210014)
随着我国农业结构的调整,设施蔬菜的种植面积逐年增加,并在我国农业生产中占据着重要地位。然而,在种植过程中,农户为了追求高产,农药和化肥的不合理使用导致土壤酸化、次生盐渍化、土传病害、水环境污染等问题日渐突出[1-2]。苏北设施蔬菜以产值高的茄果类蔬菜为主,其种植面积占江苏65%以上[3]。茄果类蔬菜因采收期长、产量大,盲目、过量施用畜禽类农家肥和化肥的现象更为突出,导致土壤养分过剩、理化性状恶化、整体质量下降[4]。设施蔬菜土壤质量的退化和生态环境的恶化不仅影响了蔬菜的生长,造成减产减收,而且严重威胁到食品安全和人类健康。因此,在设施蔬菜种植过程中,如何均衡合理配施有机无机肥料已成为当前研究的热点。大量研究表明,均衡合理配施有机无机肥料,不仅有利于促进土壤碳、氮转化、提升土壤肥力可持续性,而且能够提高和改善作物的产量与品质,减少作物发病率,改善土壤理化性状,增加土壤微生物多样性等[5-10]。
据统计,我国中药渣的年排放量达6000万~7000万t[11]。中药渣作为一种有机废弃物目前尚无大规模利用的有效途径,一般是作为废弃物,多采用简单粗放的手段堆放、填埋或焚烧处理,不仅造成了资源浪费,也极易对周围环境造成污染[12-13]。中药渣营养成分丰富,富含纤维、多糖、蛋白以及微量元素等营养成分,重金属含量低且不含病原菌和抗生素,质轻、通气性好,是一种优质的有机肥原料[14-15],将中药渣发酵成为有机肥,应用到农业栽培中进行改土培肥是实现中药渣资源化利用的有效方式之一[16-19]。
土壤微生物作为土壤生态链中的关键组成部分,直接参与土壤结构的形成,推动着土壤养分的循环和能量流动,在维持土壤生态功能中扮演着重要角色[20],其中细菌在土壤微生物数量中占有绝对优势,决定着土壤微生物总量的分布,影响着有机物的分解和转化[21]。设施蔬菜种植过程中土壤微生物多样性、群落组成和结构的变化可以作为土壤受损程度和质量变化的重要预警指标,理解土壤微生物及功能群的变化对揭示设施蔬菜栽培条件引起的土壤质量退化微生物学机制及保持设施土壤可持续性具有重要意义。
目前,对于中药渣有机肥的应用研究主要在于提高作物产量和改善品质等方面[22-23]。本试验探究了中药渣有机肥在与不同用量化肥的协同作用下,设施番茄的生长状况,并利用高通量测序技术,分析不同处理下土壤微生物多样性、群落组成和结构的差异,并揭示影响作物生长的关键土壤环境因素,阐明土壤微生物群落对设施生产条件变化的响应规律,为中药渣有机肥与化肥的科学合理化配施提供科学依据。
1 材料与方法
1.1 试验地概况和供试材料
试验在江苏省连云港市农业科学院东辛试验基地塑料大棚中进行。供试土壤基本理化性状为:pH值7.8、有机质含量22.32 g/kg、全氮2.0 g/kg、全磷1.7 g/kg、全钾15.7 g/kg。供试作物番茄为粉果,由淮安市农业科学研究院提供。供试化肥为金正大复合肥(15-15-15)、硫酸钾(K2O ≥52%)、磷酸二铵(N 18%、P2O546%)。中药渣有机肥由江苏好徕斯肥业有限公司提供,中药渣有机肥含有机质≥45%、N 1.78%、P2O50.92%、K2O 2.63%、水分含量40%。含微量元素的高钾水溶肥(顺欣15-15-30-TE)。
1.2 试验设计
试验共设4个处理。CMR60处理组施用3500 kg/667 m2中药渣有机肥+60 kg/667 m2NPK化肥、CMR70处理组施用3500 kg/667 m2中药渣有机肥+70 kg/667 m2NPK化肥、CMR80处理组施用3500 kg/667 m2中药渣有机肥+80 kg/667 m2NPK化肥、CMR90处理组施用3500 kg/667 m2中药渣有机肥+90 kg/667 m2NPK化肥,各处理肥料施用量见表1。每个处理4次重复,共16个小区,每小区面积为12.6 m2,每个小区种植3垄,每垄2行,每行8棵(行间距35 cm,株距30 cm),完全随机区组设计。中药渣有机肥作为基肥一次性施入,化肥基追肥的比例为1∶1.6。4月26日左右移栽,坐果后,每隔10~12 d冲施10 kg/667 m2高钾水溶肥(15-15-30-TE),整个生长期共追肥7次,各处理用量一致。

表1 不同处理中药渣有机肥和化肥的用量 kg/667 m2
1.3 土壤样品的采集与分析
土壤样品采集时间为2019年7月19日,用环刀取0~10 cm土层土壤样品测定其物理性质。另外,采集各处理耕层(0~20 cm)土壤样品,每小区多点混合采样,去除植物根系和石块,采用四分法分为2份:1份自然风干过筛用于测定土壤化学性质;1份装入无菌袋中带回实验室,-80 ℃冰箱保存用于微生物DNA的提取,各处理编号与采集土样编号一致。
1.4 番茄各项指标的测定
番茄植株生长指标、产量及品质的测定:定植后每隔30 d测定植株的株高、茎粗、叶绿素,共测定4次。于采收期测定植株产量,并测定果实的可溶性固形物和可滴定酸的含量。株高是番茄植株子叶到生长点的高度,用卷尺测量;茎粗是生长点以下第6~7片真叶间的茎的直径(移栽后第1次测量子叶与第1片真叶间的茎的直径);叶绿素采用叶绿素测定仪测量;可溶性固形物采用手持糖度计测定;可滴定酸采用酸碱滴定法测定。
土壤理化性质测定:土壤pH值采用pH计测定(土水比1∶2.5);有机质含量采用重铬酸钾滴定法测定;全氮(TON)采用凯氏定氮仪进行测定;全磷含量采用钼锑抗比色法测定;全钾采用火焰光度法测定[24];土壤细菌群落分析由上海派森诺生物科技股份有限公司(上海)完成,采用Illumina MiSeq平台对细菌群落DNA片段进行双端(Paired-end)测序。
1.5 统计分析方法
采用QIIME进行土壤细菌群落相关指标分析;采用Excel 2012软件制图;采用SAS 9.0软件对番茄各农艺性状及土壤基本属性进行显著性分析;采用欧易生物云对土壤菌群结构与环境因子进行冗余分析。
2 结果与分析
2.1 土壤理化性质
从表2可以看出,不同施肥处理后土壤有机质含量存在显著差异,含量由高到低依次是CMR80>CMR90>CMR60>CMR70。CMR80处理组的土壤全氮含量最高,其次是CMR60处理组,均显著高于CMR70、CMR90处理组。CMR80处理组的土壤全磷含量显著低于其他处理组,且其他处理组之间无显著差异;CMR80处理组土壤全钾含量显著低于CMR90处理组,其他处理组之间无显著差异。各处理组土壤pH值无显著差异。

表2 中药渣有机肥配施化肥处理后土壤基本性质
2.2 番茄植株生长指标及产量、品质
从图1可以看出,随着生长时间的延长,番茄的株高和叶绿素含量逐渐增加,茎粗先升高后降低,在5月26日、6月25日测量值相对较高,各处理的株高、茎粗、叶绿素含量无显著差异,仅在5月26日,CMR80处理组番茄叶片的叶绿素含量显著低于CMR70、CMR90处理组,与CMR60处理组无显著差异,在7月25日,CMR70、CMR90处理组番茄株高显著高于CMR60、CMR80处理组,且两者之间无显著差异。
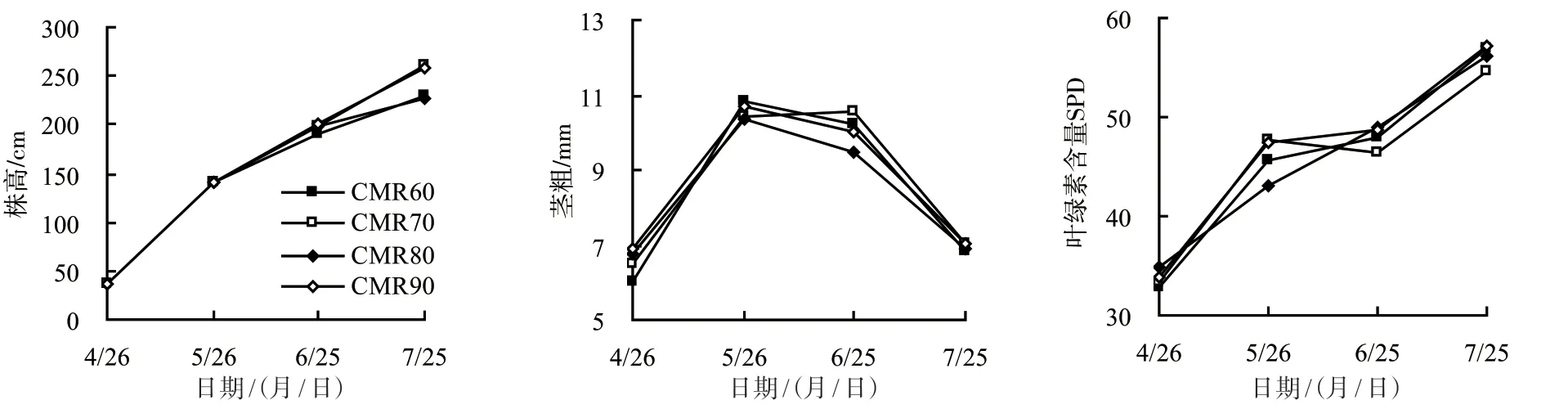
图1 中药渣有机肥配施化肥对番茄株高、茎粗、叶片叶绿素含量的影响
由表3可知,各处理组的产量无显著差异,其中CMR70处理组产量最高。CMR60、CMR80处理组番茄的可溶性固形物含量最高,显著高于其他处理组,但两者之间无显著差异,其中CMR90处理组番茄可溶性固形物最低。CMR70、CMR90处理组番茄可滴定酸含量最低,显著低于CMR60处理组,但两者之间,以及它们与CMR80处理组均无显著差异。

表3 中药渣有机肥配施化肥对番茄产量及果实品质的影响
2.3 土壤测序结果与OTU特性分析
基于16 S rRNA的高通量测序,共获得1892279个有效序列,其中,CMR60、CMR70、CMR80、CMR90处理组样品的平均有效序列数分别为125523±5769、116546±5312、122016±8927、108985±9645。对每组样品随机抽取91276条序列进行抽平,在0.95相似水平下进行聚类,得到每组样本OTU数(图2)。CMR60处理组样品中细菌群落OTU数是13531,CMR60处理组样品中细菌群落OTU数是13190,CMR60处理组样品中细菌群落OTU数是13382,CMR60处理组样品中细菌群落OTU数是11568。各处理共同的OTU数为3932(图2),特有的OTU数相对较少,CMR60、CMR70、CMR80、CMR90分别为4966、4871、3938、4865。

图2 土壤样品中微生物群落OTU维恩图
2.4 土壤微生物多样性分析
土壤样品的Alpha多样性结果见表4。4个土壤样本覆盖率均达到99.3%以上,说明测序深度较高,基本能覆盖样品中所有物种,能够真实地反映土壤微生物的群落组成。
细菌群落结构丰富度和多样性主要是由代表OTUs统计的物种数Observed spieces、表征菌群丰度的Chao 1指数(Chao 1 index),以及反映菌群多样性的香浓指数(Shannon index)和辛普森指数(Simpson index)来表示。从表4可以看出,随着化肥用量的增加,土壤物种数、Chao 1指数、进化多样性指数(Faith’s PD)均逐渐降低,其中CMR90处理组Chao 1指数、土壤物种数显著低于其他各处理组,进化多样性指数仅显著低于CMR60处理组,其他各处理组之间的土壤物种数、Chao 1指数、进化多样性指数均无显著差异。香浓指数随着化肥使用量的增高出现先升高后降低的趋势,并在CMR70处理组达到最高值,但各处理之间不具有显著差异。这说明化肥的施用量能够影响土壤细菌群落的丰富度和多样性。

表4 不同处理土壤细菌菌群的丰度和多样性比较
2.5 土壤微生物群落结构分析
在门水平上,4组土壤样品中优势细菌从高到低依次为变形菌门Proteobactreia、放线菌门Actinobacteria、酸杆菌门Acidobacteria、芽单胞菌门Gemmatimonadetes、绿弯菌门Chloroflexi、拟杆菌门Bacteroidetes(图3)。其中,变形菌门和放线菌门在各处理样品中占比最大,为本研究区土壤优势细菌的菌门。在不同处理下的土壤样品中,变形菌门相对丰度大小依次是CMR60(38.45%)>CMR70(37.48%)>CMR90(36.87%)>CMR80(36.39%);放线菌门相对丰度大小依次是CMR80(18.86%)>CMR60(18.48%)>CMR70(17.51%)>CMR90(16.68%);酸杆菌门相对丰度大小依次是CMR70(11.30%)>CMR80(9.96%)>CMR90(9.57%)>CMR60(8.47%);芽单胞菌门相对丰度大小依次是CMR90(10.47%)>CMR70(8.29%)>CMR60(8.26%)>CMR80(8.05%);绿弯菌门相对丰度大小依次是CMR80(8.94%)>CMR60(8.65%)>CMR90(8.55%)>CMR70(8.14%);拟杆菌门相对丰度大小依次是CMR80(8.39%)>CMR90(8.00%)>CMR60(7.83%)>CMR70(7.32%)。总体来看,CMR60处理组土壤样品中变形菌门相对丰度较其他处理组高,CMR70处理组土壤样品中酸杆菌门相对丰度较其他处理组高,CMR80处理组土壤样品中放线菌门、绿弯菌门、拟杆菌门相对丰度较其他处理组高,CMR90处理组土壤样品中芽单胞菌门相对丰度较其他处理组高。
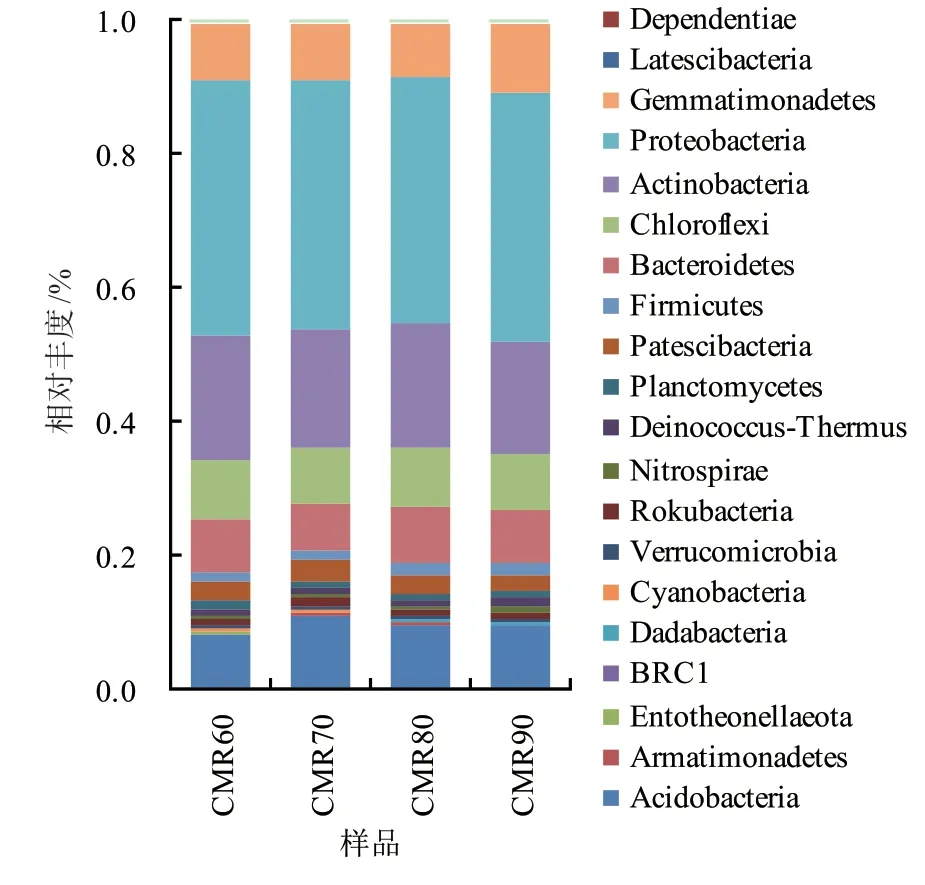
图3 门水平上土壤细菌菌群的组成结构
在属水平上,不同处理的优势菌属基本相似,分别为MND1、Subgoup10、Iamia、特吕珀菌属Truepera、Pelagibius、链霉菌属Streptomyces、苍白杆菌属Ochrobactrum、芽单胞菌属Gemmatimonas、交替赤杆菌属Altererythrobacter、假单胞菌属PseudCMRonas、鞘脂单胞菌属SphingCMRonas、RB41、马杜拉放线菌属Actinomadura、溶杆菌属Lysobacter、硝化螺菌属Nitrospira、Haliangium、类诺卡氏属Nocardioides、藤黄色单胞菌属Luteimonas、芽孢杆菌属Bacillus、Ilumatobacter(图4)。其中,CMR60处理组土壤样品中的优势属(相对丰度>1%)依次是MND1 2.82%、Iamia1.28%、马杜拉放线菌属1.18%、链霉菌属1.15%、Pelagibius1.14%、特吕珀菌属1.09%;CMR70处理组土壤样品中的优势属(相对丰度>1%)依次是MND1 2.87%、Subgroup10 1.51%、Iamia1.26%、假单胞菌属1.20%、RB41 1.06%、鞘脂单胞菌属1.04%;CMR80处理组土壤样品中的优势属(相对丰度>1%)依次是MND1 2.34%、假单胞菌属1.30%、Iamia1.21%、Subgroup10 1.20%、链霉菌属1.00%;CMR90处理组土壤样品中的优势属(相对丰度>1%)依次是MND1 2.08%、特吕珀菌属1.41%、Iamia1.31%、Pelagibius1.25%、Subgroup10 1.24%、苍白杆菌1.19%。另外,MND1、RB41、鞘脂单胞菌属、溶杆菌属、Nitrospira的相对丰度在4个处理组中出现了先升高后逐步减低的趋势,在CMR70处理组中达到最高值。

图4 属水平上土壤细菌菌群的组成结构
2.6 土壤菌群结构与环境因子的冗余分析
采用冗余分析(RDA)方法探讨了土壤理化性质与细菌群落结构的关系(图 5)。图中不同颜色的点表示不同处理的样品,各处理样品分布点并没有显著地分隔开,说明不同施肥处理对土壤细菌群体结构没有产生显著的影响。图5中红色箭头分别代表不同的环境因子,蓝色箭头代表不同的微生物。环境因子之间的夹角为锐角时,表示2个环境因子之间呈正相关,钝角时则呈负相关。物种与环境因子之间的夹角代表物种与环境因子间的正、负相关关系(锐角:正相关;钝角:负相关;直角:无相关性),环境因子的射线越长,说明该影响因子的影响程度越大。
从图5可以看出,pH值与总磷之间呈正相关,两者与总钾呈正相关,与有机质、总氮呈负相关;有机质与总氮之间呈正相关。总钾对各处理细菌群落结构的影响程度最大,其次是总磷和pH值。总钾与苍白杆菌属、Pelagibius、特吕珀菌属呈正相关,与Subgoup10、Iamia、MND1、链霉菌属、马杜拉放线菌属、溶杆菌属呈负相关;总磷、pH值与芽单胞菌属、硝化螺菌属、RB41呈正相关,与溶杆菌属、马杜拉放线菌属、链霉菌属、Iamia呈负相关;总氮、有机质与溶杆菌属、交替赤杆菌属、马杜拉放线菌属、假单胞菌属呈正相关,与硝化螺菌属、RB41、鞘脂单胞菌属、芽单胞菌属呈负相关。
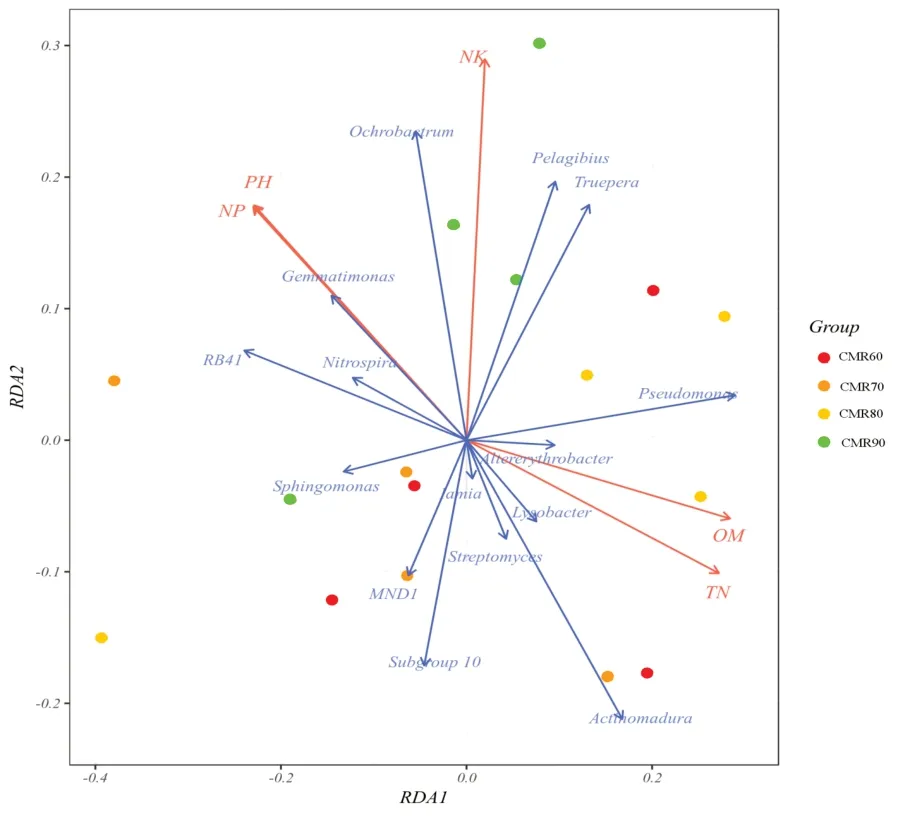
图5 基于属水平细菌群落的组成与土壤理化性质的RDA分析
3 结果与分析
本研究结果显示,不同施肥处理后土壤有机质含量由高到低依次为CMR80>CMR90>CMR60>CMR70。CMR80处理组的土壤全氮含量增加,全磷、全钾含量降低,其他各处理组的土壤氮、磷、钾养分含量与处理前无明显变化。从处理后的土壤养分含量可以看出,中药渣有机肥的施用能够显著增加土壤有机质含量,而不同化肥施用量处理对土壤有机质、氮、磷、钾养分的利用效果也各不相同。从番茄长势来看,CMR70处理组的番茄植株长势相对较好;从产量、品质数据来看,CMR70处理组番茄产量相对较高,且可滴定酸含量相对较低,口感较好。
从土壤样品的Alpha 多样性分析结果可以看出,在中药渣有机肥施用量一定的前提下,随着化肥用量的增加,土壤物种数、土壤Chao 1指数、进化多样性指数均逐渐降低。其中,CMR90处理组化肥施用量最高,其土壤微生物Chao 1指数、物种数最低,且显著低于其他各处理组;进化多样性指数最低,且显著低于CMR60处理组,与其他处理组无显著差异。CMR70、CMR80、CMR90处理组的物种数、Chao 1指数、进化多样性指数均无显著差异。香浓指数随着化肥使用量的增高出现先升高后降低的趋势,并在CMR70处理组达到最高值。这充分说明化肥的施用量能够影响土壤细菌群落的丰富度和多样性,在中药渣有机肥施用量一定的前提下,施用化肥的量越多,土壤微生物的多样性反而越低。
从土壤微生物群落结构分析可以看出,不同处理组土壤中的优势菌门基本相似,分别为变形菌门、放线菌门、酸杆菌门、芽单胞菌门、绿弯菌门、拟杆菌门,这与之前的研究结果相似[25-26],但各处理中优势菌门的相对丰度具有一定差异,CMR60处理组中变形菌门相对丰度较高,CMR70处理组中酸杆菌门相对丰度较高,CMR80处理组中放线菌门、绿弯菌门、拟杆菌门相对丰度较高,CMR90处理组中芽单胞菌门相对丰度较高。这也说明了在中药渣有机肥施用量一定的前提下,土壤微生物群落结构受化肥施用量的影响。
在本研究中,土壤变形菌门占绝对优势,与之前很多土壤细菌群落研究的结果相似,都具有很高的相对丰度[27-28]。变形菌门属于异养型细菌,包含有能与植物共生的固氮细菌,可以增强土壤的固氮能力。有研究表明,土壤变形菌门丰富度的高低在一定程度上反映了土壤有机质等养分含量的高低[29-30]。放线菌是一类具有重要生物活性的功能性微生物,能产生种类繁杂和富含生物活性的次级代谢产物,还能产生各类酶、有机酸等,有助于分解有机物和矿物质[31],同时它具有良好的抗菌活性和耐盐碱作用[32-33]。酸杆菌门细菌也是土壤微生物的重要成员,在土壤物质循环和生态环境构建过程中起到非常重要的作用[34-35]。Fierer 等[36]研究发现,施氮量对细菌多样性没有产生显著的影响,但施氮对细菌群落结构的影响显著,其中富营养细菌,如变形菌门和拟杆菌门相对丰度随施氮量的增加而上升,而寡营养细菌主要是酸杆菌却表现出相反的趋势。Ramirez 等[37]对采自不同生态环境下的 28 个土壤氮素添加试验发现,施氮增加了放线菌和Firmicute细菌的相对丰度,但降低了酸杆菌和Verrucomicrobia细菌的相对丰度。本研究结果显示,随着氮磷钾肥料施用量的增加,酸杆菌门的相对丰度出现了先升高后降低的趋势,与之前的研究不尽相同。绿弯菌门是一类通过光合作用产生能量的细菌,广泛分布在生物圈的各种环境中,参与了 C、N、S 等元素的生物地球化学循环,是所在环境生态学过程的重要参与者[38]。拟杆菌具有溶磷作用,一些菌属能够分泌有机酸和磷酸酶将难溶性磷转化为可以被植物吸收利用的H2PO4-和 HPO42-这2种磷的形态[39],提高了植物对磷的吸收和利用,促进了植物生长[40]。
通过冗余分析可知,有机质和全氮、全磷、全钾对土壤微生物群落结构都有影响,其中全钾的影响程度最大,可能是由于有机质及氮、磷、钾养分为土壤微生物提供了重要的能量来源,促进了土著优势种群的生长繁殖,而不利于一些非优势种群及对环境变化敏感种群微生物的生长与丰度的增加,但随着养分的过量积累反而不利于土壤细菌群落结构组成的变化[41-43]。
