伏立诺他羟丙基-β-环糊精滴眼液对小鼠碱烧伤角膜新生血管的抑制作用
2022-08-10杨晶晶梁珍卢萍张振张俊杰
杨晶晶 梁珍 卢萍 张振 张俊杰
河南省人民医院眼科 郑州大学人民医院眼科 河南省立眼科医院,郑州 450003
角膜需处于透明状态以维持其正常的生理功能,但在感染、外伤、免疫反应等病理情况下,血管会从角膜缘处向角膜中央生长,形成角膜新生血管(corneal neovascularization,CNV),破坏角膜正常微环境,导致角膜透明性下降和眼前节相关免疫赦免消失。CNV引起的视力下降和移植排斥反应成为目前角膜疾病治疗所面临的突出问题。因此,研究治疗CNV的药物对提高CNV患者的生存质量具有重要意义。伏立诺他(vorinostat,SAHA)是一种组蛋白去乙酰化酶抑制剂,通过诱导细胞分化、凋亡和阻断细胞周期发挥作用,并于2006年10月6日被美国食品药品管理局批准用于治疗经2个全身治疗方案后仍进展、耐药或复发的具有明显皮肤侵犯的T细胞淋巴瘤。近年来,研究发现SAHA对CNV具有抑制作用。然而SAHA的水溶解度较低,生物利用度低,严重影响其眼局部治疗CNV的效果。本研究选用羟丙基-β-环糊精作为包合载体,增加SAHA在水中的溶解度,将其制备成不同药物浓度的伏立诺他羟丙基-β-环糊精(SAHA-hydroxypropyl-β-cyclodextrin,SAHA-CD)滴眼液,并研究其对小鼠角膜碱烧伤CNV的抑制作用,以期提高其对CNV的抑制作用。
1 材料与方法
1.1 材料
1
.1
.1
实验动物 75只健康雄性SPF级6~8周龄昆明小鼠购自郑州华兴实验动物养殖场[许可证号:SCXK(豫)2019-0002],体质量18~22 g。实验动物饲养于河南省食品药品检验所动物房,5只/笼,实验期间自由饮水进食。实验动物的使用与饲养均遵循视觉与眼科研究协会制定的科研动物使用规范,本研究方案经河南省眼科研究所实验动物伦理委员会审核批准(批文号:HNEECA-2020-01)。1
.1
.2
主要试剂及仪器 SAHA(北京百灵威科技有限公司);羟丙基-β-环糊精(西安德立生物有限公司);质量分数0.9%氯化钠注射液(四川科伦药业股份有限公司);地塞米松磷酸钠滴眼液(新乡华青药业有限公司);小鼠血管内皮生长因子(vascular endothelial growth factor,VEGF)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒、小鼠碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)ELISA试剂盒、小鼠基质金属蛋白酶9(matrix metalloproteinase,MMP-9)ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司)。CJB-S-10D多点磁力搅拌器(郑州长城仪器有限公司);2695高效液相色谱仪(美国Waters公司);SLM-8E裂隙灯显微镜(重庆康华瑞明科技股份有限公司);TS-100C恒温振荡器[匡贝实业(上海)有限公司];酶标仪(美国PerkinElmer公司);ZOOM-200手术显微镜(上海蔡康光学仪器有限公司);荧光显微镜(日本尼康公司);FRESCO低温高速离心机[赛默飞世尔(上海)仪器有限公司]。1.2 方法
1
.2
.1
SAHA-CD滴眼液的制备 根据药效学研究的一般原则和该药物兔眼刺激性预实验结果,本研究拟制备SAHA质量分数为0.1%、0.2%和0.4%的SAHA-CD滴眼液。取3个清洁干燥烧杯,均加入注射用水20 ml,分别加入羟丙基-β-环糊精0.4、0.8和1.6 g,然后分别加入SAHA 0.02、0.04和0.08 g,均加入甘油0.3 g,搅拌均匀,加热至65 ℃,搅拌至药物完全溶解,冷却至室温,转移至量筒中加注射用水至20 ml,成功制备质量分数为0.1%、0.2%和0.4%的SAHA-CD滴眼液。取滴眼液用针头式无菌过滤器(滤膜孔径为0.22 μm,爱尔兰Merck Millipore公司)过滤后,采用高效液相色谱仪测定药物含量,应为标示量的90%~110%。1
.2
.2
小鼠角膜碱烧伤模型的建立 参照文献[6-7]的方法建立碱烧伤小鼠CNV模型:质量分数1%戊巴比妥钠按照80 mg/kg的剂量给予小鼠腹腔内注射进行全身麻醉,采用质量分数0.4%盐酸奥布卡因滴眼液点右眼进行角膜表面麻醉,充分暴露小鼠右眼角膜;将1 mol/L氢氧化钠溶液2 μl滴于直径2 mm圆形滤纸片上,静置5 s,将滤纸片均匀地贴于小鼠右眼角膜中央并静置20 s,取下滤纸后用20 ml 0.9%氯化钠注射液迅速冲洗结膜囊1 min,建立碱烧伤诱导的小鼠CNV模型。1
.2
.3
实验分组及给药 将造模成功的小鼠按照随机数字表法随机平均分成模型对照组、0.1% SAHA-CD组、0.2%SAHA-CD组、0.4%SAHA-CD组和地塞米松组,每组15只,模型眼分别于模型建立后立即给予0.9%氯化钠注射液、0.1%SAHA-CD、0.2%SAHA-CD、0.4%SAHA-CD和地塞米松磷酸钠滴眼液点眼,4次/d,5 μl/次,共给药6 d;给药后间隔10 min均使用头孢唑林钠滴眼液5 μl点眼以预防感染。1
.2
.4
裂隙灯显微镜观察CNV情况 造模后每日在裂隙灯显微镜下观察各组小鼠角膜和前房情况,分别于给药后3 d和6 d,用裂隙灯显微镜拍照记录CNV生长情况。1
.2
.5
角膜铺片及CNV长度和面积计算 参照文献[8]的方法,于造模后第6天,每组分别任意选取3只小鼠,1%戊巴比妥钠按照80 mg/kg的剂量腹腔内注射进行全身麻醉,固定于泡沫板上,手术剪刀剪开胸腔,充分暴露心脏和肝脏,将注射针头插入小鼠左心室,同时将小鼠右心耳剪开,灌注黑色墨水直至四肢和眼球变黑,颈椎脱臼法处死小鼠。摘除右眼眼球,于质量分数4%多聚甲醛溶液中4 ℃固定过夜,去除晶状体及虹膜组织,保留角膜缘及完整角膜组织,将角膜沿角膜缘向角膜中央方向均匀切成4瓣,置于载玻片上制成角膜整铺片,封片胶封片,光学显微镜下观察并拍照,ImageJ软件测量CNV的长度和面积。每瓣角膜按角膜缘平分选5个点,每个点处测量CNV向角膜中央生长的长度,4瓣角膜共20个点的CNV长度平均值即为该小鼠CNV长度。由ImageJ软件计算出每瓣角膜CNV面积,4瓣角膜CNV面积之和即为该小鼠CNV面积。1
.2
.6
角膜组织病理学检查 于造模第6天,每组任意选取2只小鼠,腹腔内注射过量1%戊巴比妥钠溶液后,颈椎脱臼法处死,立即摘取右眼眼球,同时收集任意2只小鼠左眼眼球作为正常眼角膜组织,观察角膜组织的病理状态。将摘取的眼球置于4%多聚甲醛溶液中4 ℃固定过夜,保留角膜缘及完整的角膜组织并去除角膜边缘虹膜组织,置于10%多聚甲醛溶液中固定24 h,石蜡包埋后平行于眼轴方向3 μm厚连续切片,进行苏木精-伊红染色,光学显微镜下观察并拍照。1
.2
.7
ELISA法检测角膜组织中蛋白质量浓度 分别于造模后第3天和第6天,每组任意选取5只小鼠,腹腔内注射过量1%戊巴比妥钠溶液后,颈椎脱臼法处死小鼠,剪取右眼角膜,精密称质量后,置于-80 ℃冰箱中备用。取出角膜,放至室温,加入100 μl蛋白裂解液,冰浴中浸泡1 h,4 ℃下低温高速离心机(离心半径6 cm)12 000 r/min离心5 min后取上清,取25 μl上清液用样品稀释液稀释10倍后,取100 μl加入各孔,37 ℃孵育90 min;倒去孔内液体,加入100 μl生物素化抗体工作液,37 ℃孵育60 min;洗涤液洗涤3次,加入100 μl酶结合物工作液,37 ℃孵育30 min;洗涤液洗涤5次,加入90 μl底物溶液,37 ℃孵育15 min,加入50 μl终止液,立即在波长450 nm处测定吸光度(A
)值,计算各蛋白质量浓度。1.3 统计学方法
采用SPSS 26.0统计学软件(美国IBM公司)进行统计分析。本研究中各计量资料数据经W检验证实符合正态分布,以表示。各组小鼠角膜CNV长度和面积,VEGF、bFGF和MMP-9蛋白质量浓度总体差异比较采用单因素方差分析,组间两两比较采用LSD-t
检验。P
<0.05为差异有统计学意义。2 结果
2.1 SAHA-CD滴眼液含量
经高效液相色谱方法测定,制备的0.1%、0.2%和0.4%SAHA-CD滴眼液SAHA含量分别为标示量的97.62%、98.33%和98.14%,符合滴眼液的含量要求,可在本实验研究中使用。
2.2 各组模型眼CNV生长情况
各组模型眼造模后均见角膜水肿、混浊,角膜中央有与滤纸片大小相同、边界清晰的灰白色烧灼区。造模后0 d,各组模型眼角膜缘血管扩张充血,均可见少量细小新生血管长入角膜缘;造模后3 d,各组新生血管呈毛刷状包绕角膜缘,其中模型对照组和0.1%SAHA-CD组新生血管较密集;造模后6 d,模型对照组和0.1%SAHA-CD组新生血管较长,角膜缘充血,新生血管有继续生长趋势,0.2%SAHA-CD组新生血管无明显长出,0.4%SAHA-CD组和地塞米松组新生血管短且稀疏,角膜缘充血消退(图1)。各组CNV长度和面积总体比较,差异均有统计学意义(F
=7.655、8.802,均P
<0.01)。0.1%SAHA-CD组、0.2%SAHA-CD组、0.4%SAHA-CD组和地塞米松组CNV长度短于模型对照组,差异均有统计学意义(均P
<0.05);0.2% SAHA-CD组、0.4%SAHA-CD组和地塞米松组CNV面积小于模型对照组,差异均有统计学意义(均P
<0.05)(图2,表1)。
图1 各组造模后不同时间点模型眼CNV生长情况 造模后0 d,各组模型眼角膜缘血管扩张充血;造模后3 d,各组模型眼均有新生血管长出,模型对照组和0.1% SAHA-CD组新生血管较其他组密集;造模后6 d,模型对照组和0.1%SAHA-CD组新生血管较长,角膜缘充血,新生血管有继续生长趋势,0.2%SAHA-CD组新生血管无明显长出,0.4%SAHA-CD组和地塞米松组新生血管短且稀疏,角膜缘充血消退 SAHA-CD:伏立诺他羟丙基-β-环糊精包合物Figure 1 CNV formation at different time points after modeling The day after modeling,the corneal limbus of model eyes were congested.On the third day after modeling,the neovascularization was growing,which was denser in model control group and 0.1%SAHA-CD group than other groups.On the sixth day after modeling,the new blood vessels were long and dense in model control group and 0.1%SAHA-CD group with the corneal limbus congested,showing a tendency to continue growing,while the new blood vessels were short and sparse in 0.4%SAHA-CD group and dexamethasone group with the congestion of corneal limbus subsided,and almost no new blood vessels were found in 0.2%SAHA-CD group SAHA-CD:vorinostat-hydroxypropyl-β-cyclodextrin inclusion complex

图2 各组模型眼角膜平铺片 模型对照组新生血管密集且长;0.1%SAHA-CD组和0.4%SAHA-CD组新生血管长但较稀疏;0.2%SAHA-CD组和地塞米松组新生血管短且稀疏 A:模型对照组 B:0.1%SAHA-CD组 C:0.2%SAHA-CD组 D:0.4%SAHA-CD组 E:地塞米松组 Figure 2 Corneal flat mounts of model eyes New blood vessels were long and dense in model control group,long and sparse in 0.1%SAHA-CD group and 0.4%SAHA-CD group,short and sparse in 0.2%SAHA-CD group and dexamethasone group A:model control group B:0.1%SAHA-CD group C:0.2%SAHA-CD group D:0.4%SAHA-CD group E:dexamethasone group
表1 各组模型眼CNV长度和面积比较(x±s)Table 1 Comparison of CNV length and area among different groups (x±s)组别眼数CNV长度(mm)CNV面积(mm2)模型对照组30.399±0.12113.820±2.744地塞米松组30.097±0.008a4.251±2.336a0.1%SAHA-CD组30.302±0.007ab11.502±0.911b0.2%SAHA-CD组30.178±0.033abc9.024±1.284abc0.4%SAHA-CD组30.388±0.092abd9.676±1.430abF值7.6558.802P值0.0080.003 注:与模型对照组比较,aP<0.05;与地塞米松组比较,bP<0.05;与0.1%SAHA-CD组比较,cP<0.05;与0.2%SAHA-CD组比较,dP<0.05(单因素方差分析,LSD-t检验) CNV:角膜新生血管;SAHA-CD:伏立诺他羟丙基-β-环糊精包合物 Note:Compared with model control group,aP<0.05;compared with dexamethasone group,bP<0.05;compared with 0.1%SAHA-CD group,cP<0.05;compared with 0.2%SAHA-CD group,dP<0.05 (One-way ANOVA,LSD-t test) CNV:corneal neovascular-ization;SAHA-CD:vorinostat-hydroxypropyl-β-cyclodextrin inclusion complex
2.3 各组模型眼角膜组织病理学变化
组织病理学染色结果显示,正常小鼠角膜表面光滑,细胞间紧密连接,上皮层由4~6层细胞构成,厚度均一,基质层排列规则,纤维连接紧密。造模后6 d,各组角膜上皮细胞层数减少,呈大泡状病变,排列不规则,基质层水肿增厚,基质纤维排列紊乱,模型对照组角膜基质层可见新生血管管腔;0.1%SAHA-CD组和0.4%SAHA-CD组角膜胶原纤维排列紊乱;0.2%SAHA-CD组和地塞米松组角膜基质排列较规则,角膜上皮修复基本完整,新生血管管腔数目明显少于模型对照组(图3)。
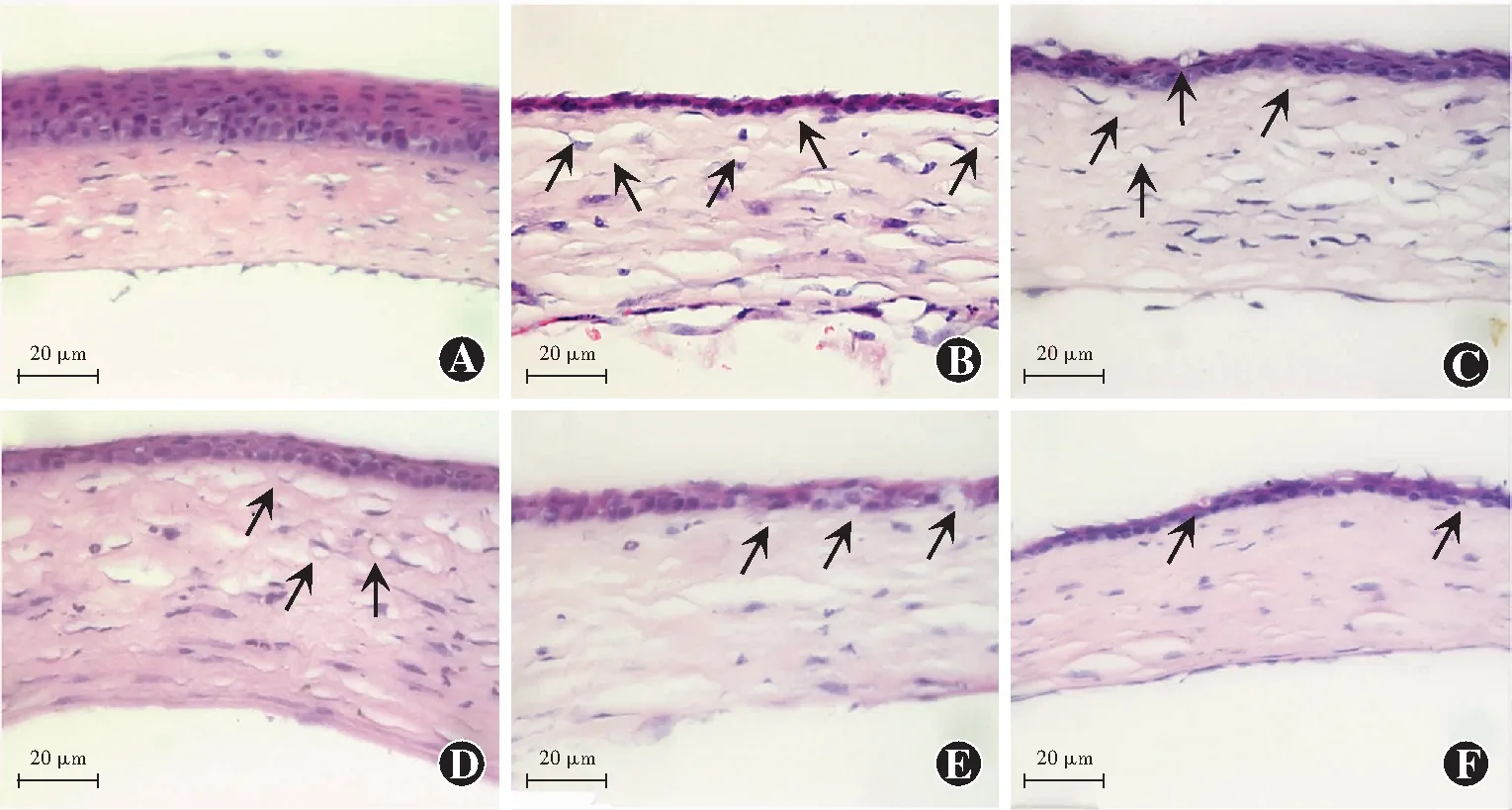
图3 各组角膜组织碱烧伤区组织病理学变化(HE ×400,标尺=20 μm) 正常角膜表面光滑,上皮细胞紧密连接,基质层排列规则;造模后6 d,各组角膜基质层水肿增厚,其中模型对照组和0.1%SAHA-CD组基质纤维皱缩,间隙增大,可见血管管腔(箭头),0.2%SAHA-CD组、0.4%SAHA-CD组和地塞米松组基质水肿减轻,仅可见少量血管管腔(箭头),角膜上皮愈合,基质纤维排列较整齐 A:正常小鼠角膜 B:模型对照组 C:0.1%SAHA-CD组 D:0.2%SAHA-CD组 E:0.4%SAHA-CD组 F:地塞米松组Figure 3 Histopathology of alkali-burned mouse corneas (HE ×400,bar=20 μm) The surface of normal cornea was smooth with tightly connected epithelial cells and regularly arranged stromal layer.On the 6th day after modeling,the corneal stromal layer in each group showed edema and thickened,and the stromal layer of model control group and 0.1%SAHA-CD group were shrunken with increased gap and visible vascular lumens (arrow).The edema of stromal layer was reduced in 0.2%SAHA-CD group,0.4%SAHA-CD group and dexamethasone group with only a few visible vascular lumens (arrow),showing healing corneal epithelium and regular stromal layer A:normal cornea B:model control group C:0.1%SAHA-CD group D:0.2%SAHA-CD group E:0.4%SAHA-CD group F:dexamethasone group
2.4 各组模型眼角膜组织中VEGF、bFGF、MMP-9蛋白质量浓度比较
造模后第3天,各组角膜组织VEGF、bFGF、MMP-9蛋白质量浓度总体比较,差异均有统计学意义(F
=6.345、7.149、18.650,均P
<0.01),其中,0.1%SAHA-CD组、0.2%SAHA-CD组、0.4%SAHA-CD组和地塞米松组角膜组织中VEGF蛋白质量浓度均低于模型对照组,差异均有统计学意义(均P
<0.05);0.1%SAHA-CD组和0.4%SAHA-CD组角膜组织中VEGF蛋白质量浓度均高于0.2%SAHA-CD组和地塞米松组,差异均有统计学意义(均P
<0.05);0.1%SAHA-CD组、0.2%SAHA-CD组、0.4%SAHA-CD组和地塞米松组角膜组织中bFGF蛋白质量浓度均低于模型对照组,0.4%SAHA-CD组角膜组织中bFGF蛋白质量浓度高于0.1%SAHA-CD组和0.2%SAHA-CD组,差异均有统计学意义(均P
<0.05);0.1%SAHA-CD组、0.2%SAHA-CD组和0.4%SAHA-CD组角膜组织中MMP-9蛋白质量浓度均低于模型对照组和地塞米松组,0.1%SAHA-CD组和0.4%SAHA-CD组角膜组织中MMP-9蛋白质量浓度低于0.2%SAHA-CD组,差异均有统计学意义(均P
<0.05)。造模后第6天,各组VEGF、bFGF、MMP-9蛋白质量浓度总体比较,差异均有统计学意义(F
=6.749、5.105、5.023,均P
<0.01);其中,0.2%SAHA-CD组、0.4%SAHA-CD组和地塞米松组角膜组织中VEGF蛋白质量浓度均低于模型对照组和0.1%SAHA-CD组,差异均有统计学意义(均P
<0.05)。0.4%SAHA-CD组角膜组织中bFGF蛋白质量浓度低于0.1%SAHA-CD组和0.2%SAHA-CD组,差异均有统计学意义(均P
<0.01);0.2%SAHA-CD组和0.4%SAHA-CD组角膜组织中MMP-9蛋白质量浓度低于0.1%SAHA-CD组、模型对照组和地塞米松组,差异均有统计学意义(均P
<0.05)(表2)。表2 各组模型眼不同时间点角膜组织中VEGF、bFGF、MMP-9质量浓度比较(x±s,pg/μg)Table 2 Comparison of VEGF,bFGF and MMP-9 concentrations in alkali-burned mouse cornea among different groups at different time points (x±s,pg/μg)组别眼数造模后3 d造模后6 dVEGFbFGFMMP-9VEGFbFGFMMP-9模型对照组52.11±0.431.33±0.240.41±0.042.23±0.351.66±0.280.31±0.09地塞米松组50.71±0.15a0.97±0.08a0.50±0.031.25±0.22a1.32±0.13a0.29±0.030.1%SAHA-CD组51.32±0.44ab0.76±0.20a0.38±0.05ab2.10±0.34b1.47±0.220.36±0.070.2%SAHA-CD组50.95±0.08ac0.75±0.18a0.22±0.07abc1.28±0.24ac1.34±0.18a0.23±0.04abc0.4%SAHA-CD组51.56±0.31abd1.19±0.18acd0.28±0.03abd1.65±0.49ac1.07±0.29acd0.23±0.04abcF值6.3457.14918.6506.7495.1055.023P值0.0030.001<0.0010.0050.0010.008 注:与模型对照组比较,aP<0.05;与地塞米松组比较,bP<0.05;与0.1%SAHA-CD组比较,cP<0.05;与0.2%SAHA-CD组比较,dP<0.05(单因素方差分析,LSD-t检验) VEGF:血管内皮生长因子;bFGF:碱性成纤维细胞生长因子;MMP-9:基质金属蛋白酶-9;SAHA-CD:伏立诺他羟丙基-β-环糊精包合物 Note:Compared with model control group,aP<0.05;compared with dexamethasone group,bP<0.05;compared with 0.1%SAHA-CD group,cP<0.05;com-pared with 0.2%SAHA-CD group,dP<0.05 (One-way ANOVA,LSD-t test) VEGF:vascular endothelial growth factor;bFGF:basic fibroblast growth factor;MMP-9:matrix metalloproteinase-9;SAHA-CD:vorinostat-hydroxypropyl-β-cyclodextrin inclusion complex
3 讨论
据统计,每年约有140万人发生CNV,其中12%的患者因此最终丧失视力。眼部烧伤患者在眼外伤中约占18%,其中超过80%的角膜烧伤是由化学试剂,包括染料、酸、碱等引起的,而碱性物质可导致角膜上皮缺损、溃疡、CNV及角膜瘢痕等严重的眼部损伤。由于角膜碱烧伤比酸损伤更常见,因此,近年来CNV的研究多聚焦于碱烧伤模型。应用碱性试剂氢氧化钠溶液对小鼠角膜中央进行烧灼模拟碱烧伤后CNV的模型,具有操作简单、重复性好、接近临床等特点。故本研究中采用碱烧伤模型来研究SAHA对CNV的抑制效果。
SAHA是一种抑制组蛋白脱乙酰基酶的新型抗癌药物。有研究结果显示,SAHA可通过抑制新生血管、新生淋巴管和炎症反应等抑制CNV。SAHA为难溶性药物,其在25 ℃条件下水溶解度约为71.6 μg/ml。Li等将SAHA用二甲基亚砜溶解后,用缓冲盐稀释成一定浓度后进行点眼给药,证实其对CNV具有抑制作用,但存在有机溶剂的细胞毒性作用。HP-β-CD是一种安全、有效的药物增溶剂和吸收促进剂,具有水溶性强、热稳定性高、安全性高等特性,易与药物形成包合物,进而提高药物溶解度和生物利用度,是近年来广泛应用的药物制剂新型辅料。SAHA可被包合于HP-β-CD分子空腔中形成包合物,具有很高的分散度,同时由于HP-β-CD的亲水性,使包合物具有良好的可润湿性,达到增加溶解度的目的,从而改善SAHA的生物利用度。本研究通过HP-β-CD包合技术将SAHA制备成可用于给药的滴眼液,在未加有机溶剂的条件下大大增加了SAHA在水中的溶解度,可以有效提高SAHA的生物利用度。由于眼部特殊生理结构,滴眼液滴入眼内,药物生物利用度仅为1%~7%。有研究表明,10 μmol/L SAHA有抑制胰腺癌细胞增生作用,25 μmol/L SAHA则对人角膜上皮细胞有轻微毒性。郑靖等研究表明,受试者单次口服SAHA 400 mg后半衰期约为2.0 h,该药物半衰期短,消除快。因此,本研究中采用SAHA质量分数为0.1%、0.2%和0.4%的滴眼液进行实验。
正常角膜是无血管透明组织,角膜的无血管性对于维持视力至关重要。CNV是与角膜化学性烧伤、角膜炎症及角膜移植排斥反应密切相关的常见病理现象,其发生机制复杂。在角膜感染、化学烧伤等情况下,由于血管生成刺激和抗血管生成刺激之间的不平衡,导致多种生长因子,如VEGF、bFGF和MMP-9等促血管生长因子过度表达,诱导角膜出现新生血管,而碱烧伤被认为是导致新生血管的因素之一,并可能对角膜组织和视功能造成严重损害。因此,抑制碱烧伤后血管生长因子,如VEGF、bFGF和MMP-9的表达可能抑制CNV的发生。Chang等研究发现,VEGF、bFGF和MMP-9在病理性及生理性血管形成过程中起重要作用,这些因子在正常角膜上皮、角膜内皮、角膜缘血管内皮细胞中均有表达,在CNV内皮细胞中表达明显增多。
本研究通过比较各组小鼠角膜碱烧伤后角膜上皮缺损面积、CNV长度和面积发现,SAHA-CD滴眼液可有效抑制小鼠碱烧伤后CNV生长、促进碱烧伤后角膜上皮的愈合,以及减少角膜水肿和角膜基质胶原纤维紊乱。本研究结果还显示,小鼠角膜碱烧伤后第3天和第6天,0.2%SAHA-CD组和0.4%SAHA-CD组小鼠角膜中VEGF、bFGF和MMP-9蛋白质量浓度均低于模型对照组,表明SAHA-CD滴眼液可有效抑制小鼠角膜碱烧伤后促血管生长因子VEGF、bFGF和MMP-9的表达,但其抑制作用与药物浓度之间的关系以及具体作用机制仍需进一步研究。
地塞米松通过抑制碱烧伤后的炎症反应发挥抑制新生血管的作用,其对碱烧伤诱导的CNV有明显抑制作用。但地塞米松等皮质类固醇能激活胶原酶,增加胶原酶的组织溶解作用,延缓修复过程,严重者可导致角膜溃疡加剧和穿孔,其长期应用还会带来青光眼、白内障等并发症。孙亚杰等研究发现,妥布霉素地塞米松滴眼液可能抑制角膜上皮生长。本研究选择地塞米松作为阳性对照,观察SAHA对小鼠角膜碱烧伤后CNV的抑制作用。
综上所述,SAHA-CD滴眼液制备方法简单,且可有效抑制小鼠角膜碱烧伤后新生血管的生长,可能与其抑制小鼠角膜碱烧伤后促血管生长因子VEGF、bFGF和MMP-9的表达有关。本研究为SAHA治疗CNV的后续相关研究提供了实验依据。
利益冲突
所有作者均声明不存在利益冲突作者贡献声明
杨晶晶:酝酿和设计实验、实验研究、采集数据、分析和解释数据、撰写文章;梁珍、卢萍:实施研究、采集数据、数据统计分析;张振:实施研究、采集数据;张俊杰:酝酿和设计实验、对文章的知识性内容作批判性审阅及定稿