新型冠状病毒大规模核酸筛检扩增试剂保存方式研究
2022-08-09李俊峰刘才周颉晓玲
周 伟,李俊峰,刘才周,何 强,颉晓玲
(1.兰州大学第一医院传染病研究室,甘肃 兰州 730000;2.兰州大学第一医院中心实验室,甘肃 兰州 730000)
新型冠状病毒肺炎(COVID-19,corona virus disease 2019)是由新型冠状病毒(SARS-CoV-2,severe acute respiratory syndrome coronavirus 2)引起的急性呼吸道传染病,已成为国际流行的公共卫生事件[1-2]。在我国COVID-19已被纳入《中华人民共和国传染病防治法》规定的乙类传染病,按甲类传染病管理[3]。《新型冠状病毒肺炎诊疗方案 (试行第八版)》指出,新型冠状病毒核酸检测灵敏度高,特异性强,是COVID-19确诊和排除的重要依据[4]。众多核酸检测方法中实时荧光RT-PCR技术检测SARS-CoV-2核酸片段在临床应用最多,技术成熟度最好[5],是目前最主要的实验室检查方法。
大规模人群SARS-CoV-2核酸筛检是疫情防控的重要措施,其检测结果的准确性与疫情防控效果密切相关。核酸检测结果受到病程、标本采集过程、实验室检测过程的质量控制、检测试剂等各种因素的影响[6-8]。以往对SARS-CoV-2核酸扩增试剂盒更多注重的是试剂盒冷链运输及开封前冷冻保存[9]。但在大规模SARS-CoV-2核酸检测过程中,由于标本量激增,需要大量配制检测试剂,不可避免地出现一个实验批次没有用完而需要将解冻融化后的试剂进行保存的情况。在实际工作中,SARS-CoV-2检测试剂开启后保存方式有冷冻、冷藏和室温保存等。大部分试剂盒要求冷冻保存,但不可以反复冻融,也有建议指出短时间内需要反复使用的试剂2~8 ℃冷藏保存更好。对于血液样本来说,4 ℃放置不超过72 h,常温放置不超过24 h不会影响实时荧光RT-PCR技术检测血样中的RNA病毒[10]。有相关研究指出,实时定量PCR试剂盒中质粒标准品随着冻融次数的增加稳定性降低,因此质粒标准品要避免反复冻融[11]。新冠疫情下大规模核酸筛检扩增试剂不同保存方式对核酸检测结果的影响目前未见详细报道。
因此,研究中将SARS-CoV-2荧光定量PCR检测试剂盒解冻融化后,采取不同保存方式(室温保存、4 ℃冷藏保存、-20 ℃冷冻保存),在不同时间点进行核酸检测,记录样本SARS-CoV-2检测结果和SARS-CoV-2开放阅读框1ab(ORF1ab,open reading frame 1ab)基因及核壳蛋白(N,nucleocapsid protein)基因的Ct(cycle threshold)值。从而了解扩增试剂室温、4 ℃冷藏保存是否和冷冻保存效果一致而不影响SARS-CoV-2核酸检测结果。
1 材料
1.1 研究样本
样本来自于试剂盒内自带含有SARS-CoV-2假病毒的阳性对照质控品。试剂盒中阳性质控品作为高浓度(1×105copies/mL)阳性样本;2 μL阳性质控品+398 μL阴性质控品以1∶199稀释200倍后作为低浓度弱阳性样本(500 copies/mL)。高浓度和弱阳性样本使用前震荡混匀,瞬时离心。
1.2 试剂与仪器
扩增试剂盒为广州达安基因股份有限公司生产的SARS-CoV-2核酸检测试剂盒(产品批号:2021277);核酸提取试剂盒为广州达安基因股份有限公司生产的SARS-CoV-2核酸提取试剂盒(产品批号:2021154);核酸提取仪为中山大学达安基因股份有限公司生产的Smart 32核酸提取仪;荧光定量PCR扩增仪为ABI 7500(美国Applied Biosystems公司)。
2 方法
2.1 新冠扩增试剂处理
SARS-CoV-2荧光定量PCR检测试剂盒在解冻融化后采取不同的保存方式(室温保存、4 ℃冷藏保存、-20 ℃冷冻保存),在2 h、4 h、6 h、12 h、24 h、72 h后分别与高浓度阳性样本和弱阳性样本进行了核酸扩增。每个样本做3个平行样,与平行样1扩增记为试剂1,与平行样2扩增记为试剂2,与平行样3扩增记为试剂3,每次实验做阴性和阳性对照。
2.2 病毒核酸提取
所有实验均在规范化的核酸基因扩增实验室中进行,使用达安提取试剂(产品批号:2021154)按照说明书的要求操作:从试剂盒中取出预分装96深孔板,颠倒混匀后,轻甩板孔,使试剂及磁珠均集中到孔板底部,使用时小心撕去封膜,防止液体溅出;在96深孔板的第1列、第7列按顺序加入200 μL样本以及20 μL蛋白酶K;使用SMart32核酸提取仪按照预定程序进行核酸提取;第6列和第12列中的液体即为核酸溶液,可以进行实时荧光定量PCR实验。
2.3 实时荧光定量PCR扩增
根据《医疗机构临床基因扩增》要求,严格按照试剂说明书,从试剂盒中取出SARS-CoV-2 PCR反应液A、PCR反应液B,室温融化后震荡混匀,8 000 r/min离心后使用。以每管17 μL反应液A,3 μL反应液B配制PCR混合液,充分混匀瞬时离心后将20 μL扩增体系分装至PCR薄壁管中。将高浓度阳性样本、弱阳性样本及阴阳性对照各5 μL加入薄壁管中,瞬时离心15 s后转移至扩增区检测。ABI 7500扩增仪上FAM通道检测N基因,VIC通道检测ORF1ab基因,Cy5通道为内标基因。扩增条件为50 ℃恒温逆转录2 min,95 ℃预变性及热启动酶激活2 min,95 ℃高温变性5 s、60 ℃退火延伸35 s进行42个循环,在后32次循环延伸时采集荧光信号。
2.4 实时荧光定量PCR扩增结果的判定
PCR扩增结束后保存实验结果,根据分析后图像调节基线和阈值。检查每次实验阴性质控品及阳性质控品是否同时满足说明书中的要求,如果同时满足则本次实验有效,否则实验无效,需要重新进行扩增。若FAM通道Ct值>30或无Ct值;VIC通道Ct值>30或无Ct值且Cy5通道≤30时可判样本SARS-CoV-2 RNA阴性。若FAM通道Ct值≤30;VIC通道Ct值≤30且Cy5通道有或无扩增曲线时可判样本SARS-CoV-2 RNA阳性。其他结果需要复查后确认。
2.5 统计学方法

3 结果
3.1 高浓度阳性样本和弱阳性样本均检出阳性结果
高浓度阳性样本和弱阳性样本在扩增试剂室温保存、4 ℃冷藏保存、-20 ℃冷冻保存3种保存方式下,分别在2 h、4 h、6 h、12 h、24 h、72 h进行实时荧光定量PCR检测,所有样本N基因、ORF1ab基因都出现了典型的S型扩增曲线,Ct值均小于30。所有样本SARS-CoV-2 RNA核酸片段阳性。
3.2 扩增试剂保存72 h扩增曲线分析
扩增试剂3种保存方式72 h与弱阳性样本扩增后N基因、ORF1ab基因扩增曲线分别见图1、图2。从图1、图2中可以看到9例扩增都有明显的扩增曲线,调整基线选取合适的阈值得到弱阳性样本与室温保存试剂1扩增后N基因Ct值为26.11,ORF1ab基因Ct值为25.61;与室温保存试剂2扩增后N基因Ct值为26.08,ORF1ab基因Ct值为25.49;与室温保存试剂3扩增后N基因Ct值为26.87,ORF1ab基因Ct值为25.90。与冷藏保存试剂1扩增后N基因Ct值为26.82,ORF1ab基因Ct值为25.87;与冷藏保存试剂2扩增后N基因Ct值为26.94,ORF1ab基因Ct值为25.96;与冷藏保存试剂3扩增后N基因Ct值为26.08,ORF1ab基因Ct值为25.83。与冷冻保存试剂1扩增后N基因Ct值为26.22,ORF1ab基因Ct值为25.61;与冷冻保存试剂2扩增后N基因Ct值为25.90,ORF1ab基因Ct值为25.34;与冷冻保存试剂3扩增后N基因Ct值为25.94,ORF1ab基因Ct值为25.80。由此可以看到3种保存方式下扩增试剂与弱阳性样本扩增反应后9条扩增曲线基本重合,提示扩增试剂在室温保存、4 ℃冷藏保存72 h与冷冻保存72 h效果相同。
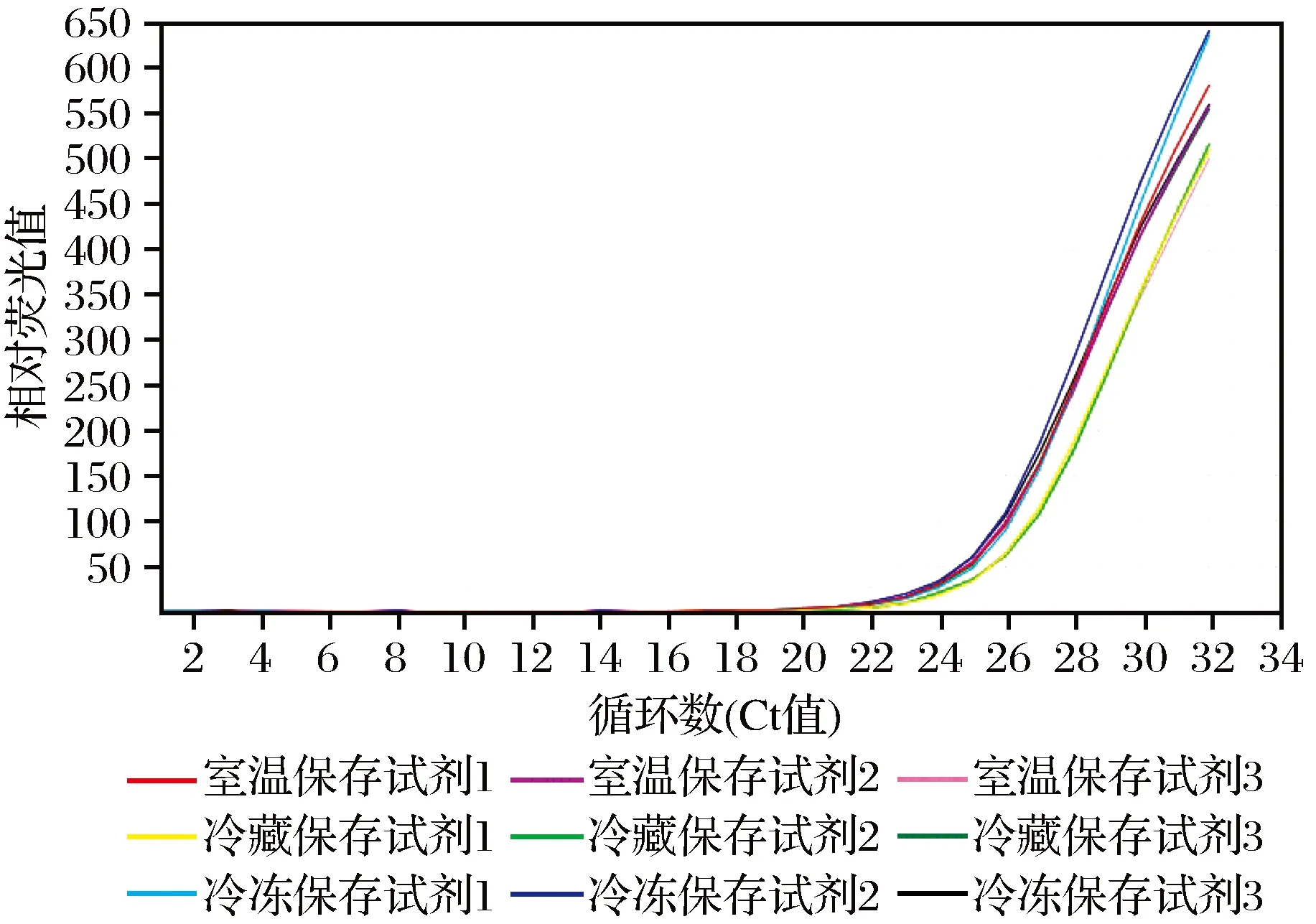
图1 弱阳性样本N基因扩增曲线Fig.1 Amplification curve of N gene of weaklypositive samples

图2 弱阳性样本ORF1ab基因扩增曲线Fig.2 Amplification curve of ORF1ab gene ofweakly positive samples
3.3 弱阳性样本N基因检测结果分析
扩增试剂保存2 h、4 h、6 h、12 h、24 h、72 h后弱阳性样本N基因检测Ct值不同,差异具有统计学意义。扩增试剂室温保存、4 ℃冷藏保存、-20 ℃冷冻保存3种保存方式下,在每个时间节点弱阳性样本N基因检测Ct值不同,差异无统计学意义。提示新冠核酸扩增试剂3种保存方式均不影响弱阳性标本N基因的检出及Ct值,扩增试剂室温保存、4 ℃冷藏保存和冷冻保存效果一致(见表1)。

表1 弱阳性样本N基因检测结果(Ct值)
3.4 弱阳性样本ORF1ab基因检测结果分析
扩增试剂保存2 h、4 h、6 h、12 h、24 h、72 h后弱阳性样本ORF1ab基因检测Ct值不同,差异有统计学意义。扩增试剂室温保存、4 ℃冷藏保存、-20 ℃冷冻保存3种保存方式下,弱阳性样本ORF1ab基因检测Ct值不同,差异无统计学意义。提示新冠核酸扩增试剂3种保存方式均不影响弱阳性标本ORF1ab基因的检出及Ct值,扩增试剂室温保存、4 ℃冷藏保存和冷冻保存效果一致(见表2)。
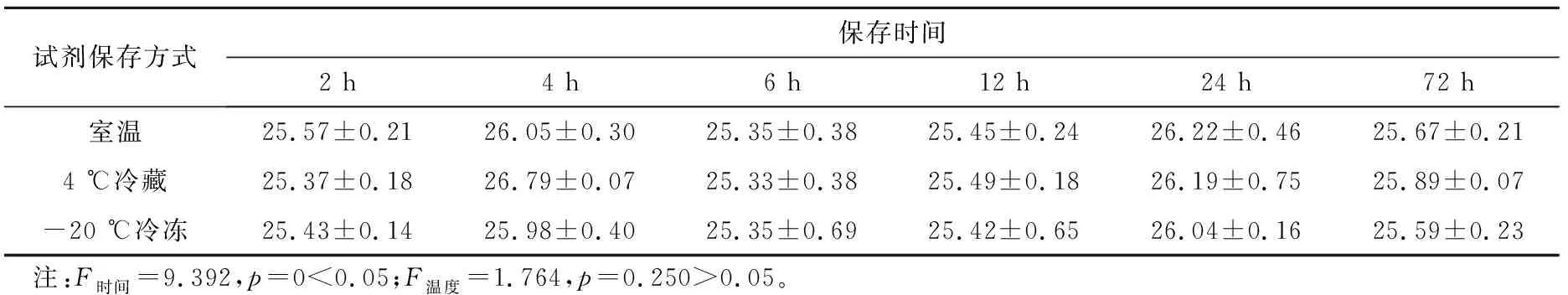
表2 弱阳性样本ORF1ab基因检测结果(Ct值)
4 讨论
研究结果初步证实了SARS-CoV-2核酸扩增试剂解冻后72 h内采用室温保存、冷藏、冷冻3种保存方式都不会影响高浓度阳性样本和弱阳性样本(500 copies/mL)检出。实验结果表明未来可进一步优化实验流程,在核酸扩增实验室2区不必单独放置冷冻冰箱用于保存剩余核酸扩增试剂,减轻了实验室2区放置多个冰箱的压力。同时也避免了实验人员误操作带来的生物安全风险。因此在大规模人群筛检时,未使用完的核酸扩增试剂只要稳妥保存,在不受污染的情形下仍可用于后续实验,避免了试剂浪费,在节约成本的同时提高了效率。
根据《医疗机构新型冠状病毒核酸检测工作手册(试行 第二版)》的要求[12],新冠核酸检测要规范开展室内质控,每批次至少有1份弱阳性质控品(第三方质控品,通常为检出限的1.5~3倍)和3份阴性质控品(生理盐水),只有阴性质控品结果为阴性,弱阳性质控品能够检出阳性才视为本批次检测在控,实验结果可信。本次研究使用的弱阳性样本(500 copies/mL)和试剂盒检测下限相同,对扩增试剂差异更加敏感,检测Ct值变化更加明显。研究中新冠病毒核酸特异性N基因、ORF1ab基因在2 h、4 h、6 h、12 h、24 h、72 h各节点的Ct值均不同,差异具有统计学意义,这可能与每批次基线和阈值的选择及各孔实验条件细微差别的积累有关。而不同保存方式下N基因、ORF1ab基因Ct值无统计学差异,提示3种保存方式在同一次扩增中无差异,说明72 h以内扩增试剂室温保存、4 ℃冷藏保存和冷冻保存效果一致。
COVID-19的诊断依赖于流行病学史询问、临床症状观察及实验室和影像学检查结果共同确认[13]。在众多实验室检查项目中,血常规及生化指标、凝血功能指标、感染相关标志物仅能提供辅助诊断信息。血清学抗原和抗体指标是COVID-19患者确诊方法之一,包括核酸检测和病毒培养的病原学检查是COVID-19患者确诊的金标准[14]。由于技术难度及生物安全防护要求,能够开展SARS-CoV-2培养的实验室不多,因此SARS-CoV-2 RNA检测是临床实验室最常用的检测方法。SARS-CoV-2核酸特异性基因检测(ORF1ab基因、N基因等)方法包括荧光定量PCR法、恒温扩增法、杂交捕获免疫荧光法、RNA捕获探针法等[15]。荧光定量PCR法灵敏度高、特异性好、可选择试剂盒种类多,是目前使用最广泛的SARS-CoV-2核酸检测方法。
实验的不足之处在于:由于实验室生物安全要求,目前很难获得患者临床样本进行实验,而是采用了模拟样本;未对市面上其他试剂盒进行广泛检测,其他试剂盒是否支持本结论还需要更多样本、更多试剂盒进一步研究。
实时荧光PCR仪器昂贵,对操作人员能力要求高,操作者需要经过分子生物学技术专业培训,考核合格后方能上岗。由于疫情防控需要大量人员进行新冠病毒核酸检测工作,因此工作中应该按照医疗机构新型冠状病毒核酸检测工作手册的要求选择国家药品监督管理局授权的提取和扩增试剂盒,使用前要进行性能验证及比对,同时须建立人员培训及考核比对程序,建立健全的生物安全防护管理制度,做好室内质控及室间质评,抓好每一个实验细节建立起全面质量保证,确保为患者发出及时准确的报告单,更好地服务于疫情防控临床诊疗工作。
