慢性阻塞性肺疾病合并呼吸衰竭患者血清Hcy、CysC水平检测及其临床意义
2022-08-09桂珍珍
刘 洁,桂珍珍
(宁夏医科大学总医院,宁夏 银川 750004)
慢性阻塞性肺疾病(COPD,chronic obstructive pulmonary disease)是一种常见慢性进展性肺部疾病,该病以气流受限不完全可逆为主要特征,多呈进行性发展态势,炎症损伤是COPD进展的核心机制,这与气道、肺部对有害气体和(或)颗粒的慢性炎症反应增强密切相关[1]。COPD治疗较棘手,不仅经久难愈,且易反复发作,现已成为波及全球的重要公共卫生问题,给患者、家庭乃至社会带来沉重的负担[2-3]。同型半胱氨酸(Hcy,homocysteine)是一种含硫基氨基酸,其水平上升被称为高Hcy血症,可参与动脉粥样硬化病程,是心脑血管疾病的独立危险因素[4],既往研究证实Hcy与COPD病情严重程度呈正相关[5]。胱抑素C(CysC)是一种肾功能内源性标志物,同时可造成呼吸道黏膜上皮细胞损伤,并诱导柱状上皮细胞凋亡[6]。但有关血清Hcy、CysC水平对COPD合并呼吸衰竭患者病情评估及预后判断中的价值尚有待研究证实。鉴于此,本次研究探讨了血清Hcy、CysC水平与COPD合并呼吸衰竭患者病情进展及预后的相关性。
1 资料与方法
1.1 一般资料
选取宁夏医科大学总医院呼吸内科2016年1月—2019年12月收治的164例COPD患者为研究对象,其中男性102例,女性62例,年龄48~86岁,平均(70.28±6.54)岁,COPD病程6个月~15年,平均(10.98±3.44)年。依据是否伴呼吸衰竭分为A、B两组,其中A组伴呼吸衰竭,共80例,B组不伴呼吸衰竭,共84例。选取同期入院健康体检者80例作为对照组,其中A组男性48例,女性32例,年龄50~86(71.20±6.32)岁,COPD病程(11.05±3.38)年。B组男性50例,女性34例,年龄48~85(70.15±6.60)岁,COPD病程(11.42±3.44)年。对照组有男性45例,女性35例,年龄45~89(69.92±6.52)岁。各组年龄、性别等一般资料无明显差异(P>0.05)。依据入院时血清Hcy、CysC将A组患者分为高Hcy组(>15 μmol/L,52例)、正常Hcy组(28例)和高CysC组(>1.03 mg/L,50例)、正常CysC组(30例)。各组年龄、性别、病程无明显差异(P>0.05)。该研究经宁夏医科大学总医院医学伦理委员会审核批准。
1.2 诊断标准
COPD诊断参照2016年慢性阻塞性肺疾病全球倡议[7]:(1)有进行性呼吸困难症状:劳动时有明显表现,可进行性加重,后于静息状态下也可出现该症状;(2)有慢性咳嗽症状:咳嗽≥2年,每年发作≥3个月,并有间歇性干咳、咳嗽或喘息等表现;(3)有慢性咳痰症状:具有典型慢性咳痰症状,所咳痰含白色泡沫状、黄痰、白痰等类型;(4)存在下列危险因素:长期吸烟或接触粉尘,存在职业危害(如工作中长期接触室内生物燃料、有害气体等)、人类免疫缺陷病毒感染等;(5)下呼吸道感染反复出现,胸部CT显示支气管炎并可见肺气肿征;(6)有家族史:低体重儿或儿童期曾有反复呼吸道感染等;(7)肺功能检查:由专业医生指导完成肺功能检查,判定标准为吸入足量沙丁胺醇后,FEV1/FVC检测值<70%。前6项中出现任意1项并兼具第7项,即可确诊。
1.3 纳入与排除标准
纳入标准:(1)符合COPD诊断标准;(2)入院时意识清楚且配合检查、治疗;(3)临床及随访资料完整;(4)自愿参加研究并签署知情同意书。排除标准:(1)合并肺结核、肺先天性解剖结构异常或有出血性病灶者;(2)近期有重大创伤或手术史;(3)伴有严重精神障碍者;(4)合并大出血、上消化道梗阻或穿孔者;(5)拒绝参加本次研究者。
1.4 检测及治疗方法
于入院当日测各组血清NO、Hcy、CysC与PaO2水平:晨起空腹采集外周静脉血5 mL,离心处理(3 000 r/min,10 min)后获得血清,-80 ℃下储存待检。以硝酸还原酶比色法检测NO水平,以酶联免疫吸附法(ELISA)检测Hcy、CysC水平,以血气分析仪(丹麦ABL505型)检测PaO2水平。所有患者均给予机械通气、祛痰、平喘、抗感染、提供营养支持、维持酸碱与电解质平衡等治疗,并根据患者合并症的情况实施降压、降血糖治疗。
1.5 观察指标
(1) 入院时检测并比较各组血清NO、Hcy、CysC和PaO2水平。(2)比较高Hcy组与正常Hcy组、高CysC组与正常CysC组PaO2水平、机械通气时间、住院时间。(3)预后情况:随访6个月,统计高Hcy组与正常Hcy组、高CysC组与正常CysC组的预后结局,计算存活率与死亡率。
1.6 统计学方法
2 结果
2.1 各组血清NO、Hcy、CysC和PaO2水平比较
A组、B组和对照组的NO、Hcy、CysC与PaO2水平差异均有统计学意义(P<0.01),两两比较经LSD-t检验显示,A组Hcy、CysC显著高于B组和对照组(P<0.05),A组NO、PaO2水平则显著低于B组和对照组(P<0.05)。B组Hcy、CysC水平显著高于对照组(P<0.05),B组NO、PaO2水平则显著低于对照组(P<0.05),其结果见表1。

2.2 Hcy不同水平组临床指标及预后结局比较
正常Hcy组PaO2水平、机械通气时间、住院时间均优于高Hcy组(P<0.05),其结果如表2所列。正常Hcy组存活率高于高Hcy组(P<0.05),死亡率低于高Hcy组(P<0.05),其结果如表3所列。

表2 Hcy不同水平组临床指标比较
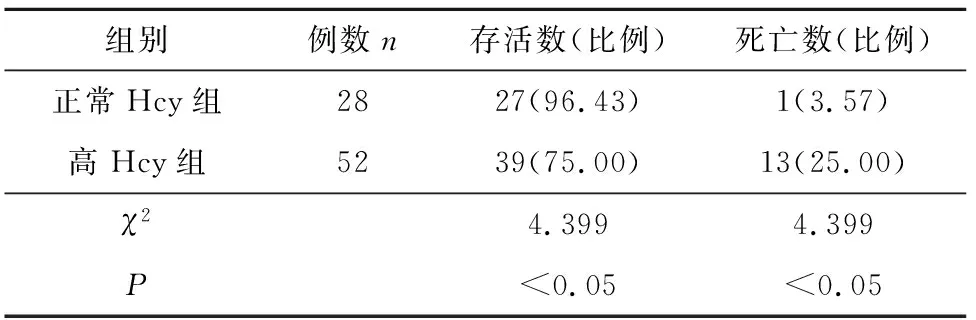
表3 Hcy不同水平组预后结局比较 [n(%)]
2.3 CysC不同水平组临床指标及预后结局比较
正常CysC组PaO2水平、机械通气时间、住院时间均优于高CysC组(P<0.05),其结果如表4所列。正常CysC组存活率高于高CysC组(P<0.05),死亡率低于高CysC组(P<0.05),其结果如表5所列。

表4 CysC不同水平组临床指标比较
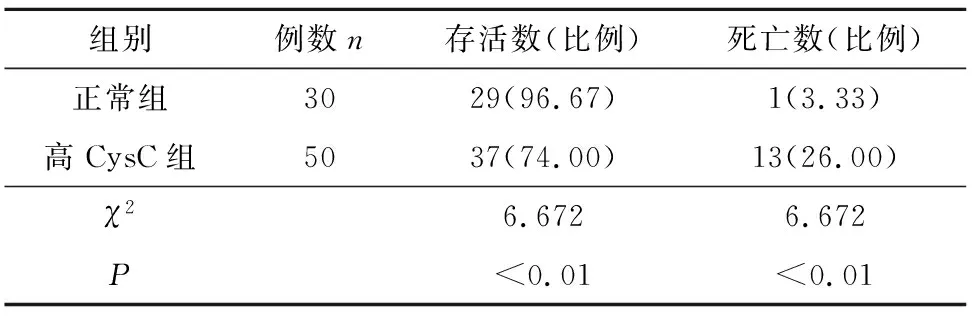
表5 CysC不同水平组预后结局比较[n(%)]
3 讨论
COPD为呼吸内科常见疾病之一,多发于冬春两季,具有病情复杂、病程漫长、预后较差等特点,吸入有害气体或颗粒所引发的炎性反应是诱发该病的主要原因。由钟南山院士牵头的COPD流行病学调查发现,在我国COPD患者以咳嗽为主要表现的占44%,以咳痰为主要表现的占39.5%,二者兼有占比亦高达30.0%[8]。Wang等[9]于2018年开展的流行病学调查结果显示,我国20岁以上人群中患COPD者占8.6%,总数多达9 990万人。COPD患者以通气功能受限为主要表现,易造成缺氧,引发二氧化碳潴留,且随着疾病进展可并发呼吸衰竭,诱发心脑血管病变,导致血栓形成等,进而加重病情,加大病死风险[3]。呼吸衰竭是因多种原因诱发肺部换气及通气功能障碍而形成的病变,可引发代谢功能紊乱,诱发一系列生理异常改变,若未能及时干预则会增加COPD患者的死亡风险[10]。因此,有必要探索可用于评估COPD合并呼吸衰竭患者病情严重程度及预后状况的血清生物学标志物,为临床针对性干预提供依据。
Hcy是一种仅靠蛋氨酸分解代谢产生而无法在体内合成的含有硫基的氨基酸,其生成与代谢通常处于动态平衡状态。既往研究证实Hcy与静脉血栓、糖尿病、慢性肾病、肝硬化、恶性肿瘤等多种疾病的发生发展密切相关[11-12]。本次研究发现A组患者(COPD伴呼吸衰竭患者)血清Hcy水平显著高于未伴呼吸衰竭患者和正常对照组,其可能机制在于:COPD伴呼吸衰竭患者机体氧化应激反应较强,会在一定程度上抑制甲硫氨酸合成酶活性,进而影响Hcy代谢并使其大量积聚于患者体内,损伤血管内皮细胞,促进血小板活化与血管平滑肌增生,并可通过抑制NOS生成影响NO生成,该结论与阿选德研究一致[13],这也是本次研究中A组与B组患者血清NO水平均显著低于对照组的重要原因。血清CysC是一种广泛分布于肺组织、肌肉和心肌组织的非糖化碱性低分子量蛋白质,在评估肾功能和反应心血管病变状况中均有重要价值,其水平异常升高常提示心功能异常[14]。此外,既往研究证实CysC在心脑血管病变、肺气肿、AECOPD、呼吸衰竭患者血清中均可见异常升高[15-16]。本次研究亦发现,合并呼吸衰竭的A组患者血清CysC水平明显高于B组与对照组,其原因在于:多数COPD患者合并低氧血症,造成缺氧性损伤,进而大量释放CysC,严重肺部感染是COPD并发呼吸衰竭的重要原因,而感染所致炎症应激反应可促使CysC异常表达[14]。本次研究结果表明,高Hcy组、高CysC组PaO2水平均低于正常组患者,机械通气时间、住院时间则长于正常组患者,提示COPD合并呼吸衰竭患者血清Hcy、CysC水平超出正常范围时其临床指标也相对更差,不利于预后恢复。本次研究随访发现高Hcy组、高CysC组存活率均低于正常组,死亡率则高于正常组,这表明COPD合并呼吸衰竭患者血清Hcy、CysC水平超出正常范围后会增加患者死亡风险。
综上所述,COPD合并呼吸衰竭患者血清Hcy、CysC水平变化与疾病进展密切相关,血清高水平Hcy、CysC患者病情更重,多提示预后不良,可作为临床评估病情进展和预后的客观指标。但本次研究存在一定的局限性,如样本量较小,未能探讨血清NO、Hcy、CysC与PaO2水平的相关性,仍有待进一步研究佐证。
