组蛋白甲基化酶G9a在弥漫性大B细胞淋巴瘤中的表达及临床意义*
2022-08-09刘静梁蓉高广勋董丽华王健红李玉富
刘静 梁蓉 高广勋 董丽华 王健红 李玉富
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是成人最常见的淋巴系统肿瘤,约占非霍奇金淋巴瘤的30%~40%[1]。由于其高度异质性,分子遗传学特点和生物学行为有着很大的差别,不同亚型DLBCL治疗反应和预后呈现显著性差异。尽管目前小分子靶向药物、单克隆抗体、细胞免疫治疗等一系列新的治疗方法显著提高了其治疗反应率,但仍有部分患者面临复发难治性的问题[2],完善预后分层、制定精准的治疗方案十分重要。
随着分子生物学的发展,表观遗传修饰包括DNA甲基化、组蛋白修饰、染色质重塑和非编码RNA调控在肿瘤发生发展中的作用逐渐受到关注[3]。其中组蛋白甲基转移酶( histone methyltransferases,HMTts )是一类以S-腺苷甲硫(S-adenosyl methionine,SAM)为甲基供体,催化1~3个甲基基团转移到组蛋白赖氨酸或精氨酸上的甲基转移酶,G9a是组蛋白H3第9位赖氨酸(H3K9)的甲基转移酶,能使H3K9发生甲基化,并参与到DNA甲基化、基因转录抑制、异染色质形成等过程[4-5],在肿瘤的发生发展过程中具有重要作用。G9a在多种肿瘤中表达异常增高,如胃癌、膀胱癌、乳腺癌和多发性骨髓瘤等,并与肿瘤的增殖、凋亡、侵袭等生物学功能有关[6-8]。目前,组蛋白甲基化酶G9a在DLBCL临床意义的研究未见报道。本研究旨在探讨G9a在DLBCL中的表达情况,分析其在DLBCL临床诊疗中的价值,为寻找新的预后及治疗靶点提供依据。
1 材料与方法
1.1 临床资料
回顾性分析郑州大学附属肿瘤医院2014年6月至2019年6月经淋巴结活检后确诊的初治DLBCL患者资料,入组的病例需要符合下述条件:1)术后的病理标本及资料保存完整;2)病例基本信息、诊治和随访资料完整;3)患者病理标本获取前未行任何抗肿瘤治疗且不合并其他恶性肿瘤。本研究共收集75例DLBCL组织标本,同时收集25例初诊为淋巴结反应性增生组织标本作为对照组。病理分型按Hans分类法进行;临床分期参照临床分期进行;预后评分参照国际预后指数(IPI)评分。
1.2 方法
1.2.1 采用免疫组织化学法检测G9a在组织中的表达情况 采用免疫组织化学法检测DLBCL组织及淋巴结反应性增生组织中G9a蛋白的表达,兔抗人G9a单克隆抗体(购自英国Abcam公司)。将石蜡切片在二甲苯中脱蜡,梯度乙醇水化;用配制好的修复液(EDTA缓冲液,Ph为9.0)修复抗原;然后用3%过氧化氢处理,阻断内源性过氧化物酶;滴加稀释好的山羊血清封闭抗原。将切片与兔抗人G9a单抗(稀释比1∶100)在4℃以下反应过夜,添加山羊抗兔二抗在37℃以下孵育30 min,滴加DAB显色液于每张切片上染色,Harris苏木精对比染色,最后进行脱水与封固。在显微镜下观察到细胞质或细胞核中有棕黄色或棕褐色颗粒即为阳性细胞,高倍镜下观察染色强度并计数阳性细胞,计算阳性细胞比例。采用半定量[9]积分法判断结果。按染色强度计分:无色为0分,淡棕色为1分,棕黄为2分,棕褐色为3分;按阳性染色细胞百分率计分:阳性细胞数<10%为0 分,10%~30%为1分,30%~50%为2分,50%~70%为3分,>70%为4分。将(染色强度~积分)乘以染色细胞百分率积分的结果分为下述等级:<2分为阴性(-),≥2分为阳性(+)。
1.2.2 治疗及疗效评价 患者接受的化疗方案包括:CHOP、R-CHOP、R-mini CHOP、EPOCH、R-EPOCH和DHAP方案,部分难治患者或复发患者接受放疗及造血干细胞移植治疗。疗效评价标准:根据2016年美国国立综合癌症网络(NCCN)推荐的淋巴瘤疗效标准,每2个周期进行1次疗效评估,疗效评价包括完全缓解(complete response,CR):所有疾病的证据消失;部分缓解(partial response,PR):测量的病变消退并且无新发病灶、疾病进展(progressive disease,PD):任何新发病灶或病灶较最低水平增长≥50%,疾病稳定(stable disease,SD):未能达到CR、PR或PD。采用CR、总生存(overall survival,OS)率、无进展期生存(progression-free survival,PFS)率,探讨其对患者生存及预后的影响。
1.3 统计学分析
采用SPSS 21.0软件进行统计学分析。应用χ2检验分析G9a蛋白在DLBCL组织与淋巴结反应性增生组织之间表达差异,分析G9a蛋白表达情况与DLBCL临床特点之间的关系;预后单因素分析采用Kaplan-Meier法,多因素分析采用Cox回归模型。以P<0.05为差异具有统计学意义。
2 结果
2.1 DLBCL组织和淋巴结反应性增生组织中G9a蛋白的表达
G9a蛋白主要在细胞核和细胞质中表达,在DLBCL组织和淋巴结反应性增生组织中有着不同的表达程度。75例DLBCL中49例(65.3%)呈G9a蛋白阳性表达,25例正常淋巴组织中有5例(20.0%)G9a阳性表达,G9a在DLBCL中表达较正常淋巴组织明显上调,差异具有统计学意义(χ2=14.483,P<0.001,表1,图1)。

表1 G9a蛋白在淋巴结反应性增生组织和DLBCL组织中的表达
2.2 G9a蛋白表达与DLBCL患者临床特征的关系
G9a 蛋白阳性与 G9a 蛋白阴性患者在性别、年龄、B 症状、LDH 水平的差异均无统计学意义(均P>0.05),而 G9a 蛋白表达阳性患者的β2-MG的值,临床分期,Ki-67 值均较 G9a 蛋白表达阴性患者更高,且差异均具有统计学意义(P值分别为0.041、0.019和0.044,表2)。

表2 G9a蛋白表达与DLBCL患者临床特征的关系
2.3 G9a蛋白表达与初治疗效的关系
G9a蛋白阳性组的49例患者中在初始治疗后达CR的患者有29例(59.2%),未达CR有20例(40.8%),G9a蛋白阴性组的26例患者中达CR的患者有18例(69.2%),未达CR有8例(30.8%)。G9a蛋白阳性组与阴性组在初始治疗后CR方面,差异无统计学意义(χ2=1.423,P=0.233,P>0.05,表3),表明G9a蛋白表达与初始治疗后的疗效无关。

表3 G9a蛋白表达与DLBCL初始治疗后疗效的关系
2.4 G9a蛋白表达与病理细胞起源的关系
75例患者中,GCB组46例,其中G9a阳性26例,G9a阴性20例,Non-GCB组29例,G9a阳性患者23例,G9a阴性6例,Non-GCB 的G9a表达率高于GCB组(79.3%vs.56.5%),且差异具有统计学意义(P=0.023,P<0.05)。将不同分子亚型DLBCL纳入OS分析,GCB组3年OS率为87.6%,Non-GCB组3年OS为77.5%,差异具有统计学意义(χ2=3.237,P=0.049,P<0.05,表4,图2)。提示G9a蛋白在Non-GCB型DLBCL中表达较高,且Non-GCB型与GCB型相比预后更差,生存率更低。

表4 G9a蛋白表达与病理类型的关系
2.5 G9a蛋白表达与DLBCL预后的关系
2.5.1 单因素分析 随访截至2020年12月,75例DLBCL患者共获得完整资料74例, 随访率为98.6%。74例DLBCL中至随访结束共生存55例,OS为74.3%,无进展生存共47例,PFS率为63.5%。将74例完整病例纳入生存分析,将年龄、性别、临床分期、B症状、病理类型、LDH水平、β2-MG、IPI评分、是否CR、G9a表达情况、纳入影响患者OS、PFS的单因素分析中,结果显示(表5,图3,4):G9a蛋白阴性组和阳性组的3年OS率分别为89.5%和73.4%,且两组OS率差异具有统计学意义(χ2=3.815,P<0.05),G9a蛋白阴性组和阳性组的3年PFS分别为79.3%和59.4%,两组PFS率差异具有统计学意义(χ2=4.211,P<0.05),表明G9a表达阳性、Ⅲ/Ⅳ分期、Non-GCB、IPI 3~5分、初始治疗未达到CR是DLBCL的不良预后因素。
2.5.2 多因素分析 由表5可见,分期、病理类型、IPI评分、G9a表达阳性是DLBCL患者3年OS的影响因素,将其纳入多因素Cox回归分析,见表6:G9a并非DLBCL患者OS率的独立预后因素(P=0.381,P>0.05)。临床分期、IPI评分、G9a表达阳性、初治是否CR为DLBCL患者3年PFS率的影响因素,将其纳入多因素Cox回归分析,结果见表7:初治CR是影响DLBCL患者3年PFS的独立预后因素(P=0.010,P<0.05),而G9a并非DLBCL患者3年PFS率的独立预后因素(P=0.987,P>0.05)。
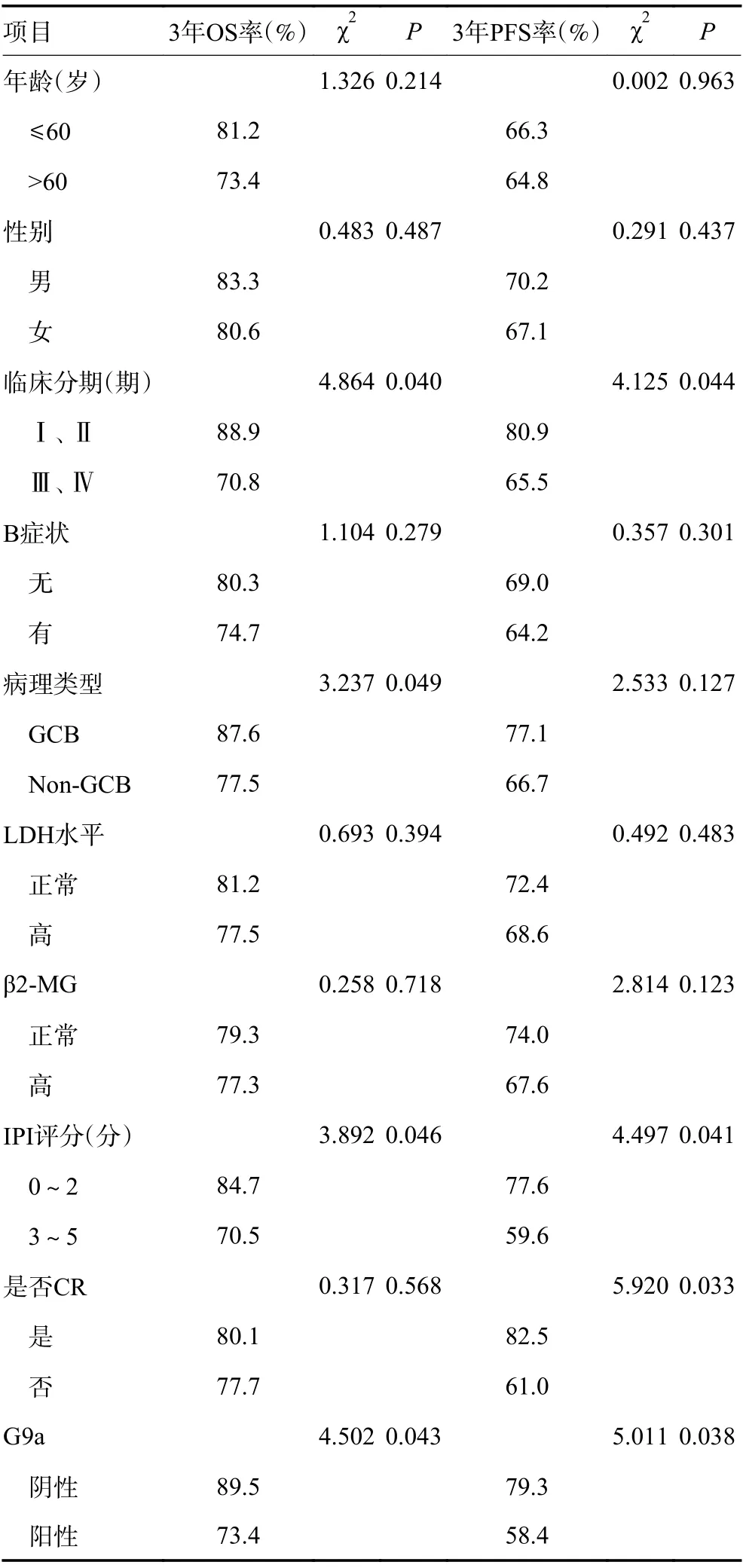
表5 影响DLBCL患者OS和PFS的单因素分析
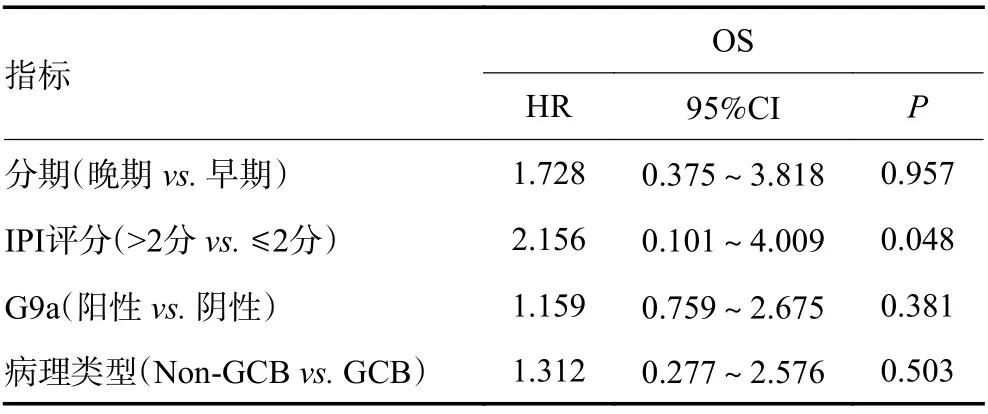
表6 影响DLBCL患者OS的多因素分析
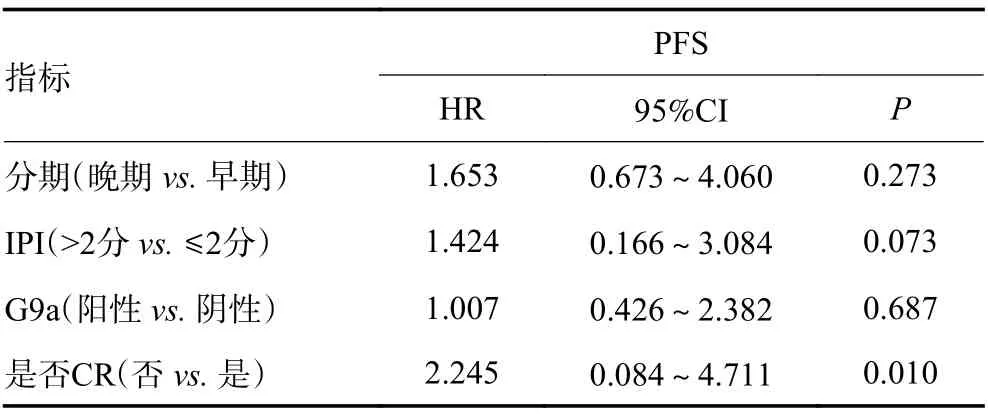
表7 影响DLBCL患者PFS的多因素分析
3 讨论
DLBCL是最常见的非霍奇金淋巴瘤,随着国内人口老龄化的发展,DLBCL作为一种主要发生于中老年人群的血液系统肿瘤,发病率也越来越高[1,10]。随着精准治疗时代的到来,传统的化学疗法及评分体系受到挑战,建立包括临床因素和分子特征的新型预后分层模式和治疗策略已经成为研究热点。在过去的几年中,基因测序和基因组分析已经发现了DLBCL重要的遗传损伤,揭示了一些与疾病相关的的基因与途径的参与,其中一些(如NF-κB、BCR和BCL-6)已被用作临床实践中[2],而一些表观遗传学标志物如EZH2、G9a被认为是很有希望的潜在靶点。EZH2可对组蛋白H3第27位赖氨酸进行三甲基化,参与基因表达的调控[11],已有报道在2l%以上的GCB型DLBCL中发生了EZH2的功能增益突变,EZH2的抑制可使生发中心B细胞停止生长分化,也可导致相关抑癌基因(如PRC2调控的基因)的表达上调。因此,EZH2抑制剂或可成为治疗生发中心来源的DLBCL的新靶点[12-13]。
G9a是组蛋白H3第9位赖氨酸(H3K9)的甲基转移酶,能使H3K9发生甲基化,并参与到DNA甲基化、基因转录抑制、异染色质的形成等过程[3-4],而这些在肿瘤的发生发展过程中都有着重要作用,针对组蛋白甲基转移酶G9a的抑制剂也正在开发中。G9a在许多癌症如乳腺癌,膀胱癌中过表达,G9a的高表达可以激活下游上皮细胞黏附分子(Ep-CAM)从而引起肿瘤细胞的侵袭和转移[14]。据报道G9a在ALL中也存在过表达,该研究发现G9a抑制剂以剂量依赖的方式降低人T淋巴母细胞(Jurkat细胞)的生存能力,并伴有P53,TP73,BAX和MDM4表达的增加,抑制G9a可诱导ALL中促凋亡基因的表达并促进细胞死亡[15]。G9a在肝癌患者中的表达明显高于正常人肝组织,敲除细胞中G9a基因后,瘤细胞生长周期停滞且细胞形态发生明显变化,侵袭性减弱[16];G9a在乳腺癌组织中表达增加,其调控肿瘤转移的途径之一是调控MSK1的激活和表达[17]。另外肿瘤细胞代谢有一个必需通路:丝氨酸-甘氨酸生物合成通路,而G9a是维持这条通路处于活性状态的酶基因, 也是在此通路应答丝氨酸缺乏时转录激活所必需的,这也暗示G9a可能参与原癌基因或抑癌基因在胚胎发育中的调控表达,其通过增加丝氨酸的产出来增强细胞的生长和转化潜能;若G9a失活, 丝氨酸及它的下游代谢产物就相应减少, 引发肿瘤细胞自噬死亡[18]。更重要的是,G9a在细胞分裂过程中与DNA甲基转移酶1进行物理相互作用,以协调DNA和组蛋白的甲基化,从而促进靶基因的转录沉默[19]。从这个意义上讲,抑制G9a的功能,不仅降低组蛋白甲基化水平,也会在一定程度上降低DNA甲基化水平从而导致抑癌基因的重新激活并抑制癌细胞的增殖。上述研究均提示,抑制G9a表达可降低癌细胞增殖,阻断肿瘤转移并延缓疾病进展。
最新的体外细胞实验[20]结果示:G9a 抑制剂 BIX-01294 对人 DLBCL 细胞系的增殖有明显抑制作用,而对正常人外周血单核细胞系抑制效果不明显, 表明G9a 抑制剂对 DLBCL 有相对特异的抑制作用。该研究还揭示了其抑制 DLBCL 增殖的途径:1)G9a抑制剂可以增加P21表达水平和降低细胞周期蛋白E水平导致细胞周期G1期停滞,引起DLBCL细胞发育障碍;2)其通过内源性和外源性凋亡途径诱导DLBCL细胞凋亡;3)其还通过激活内质网应激触发人类DLBCL细胞中的自噬凋亡。这些研究均提示G9a蛋白在DLBCL细胞增殖和凋亡调控中发挥着重要作用。本研究发现G9a蛋白表达阳性DLBCL患者的β2-MG,临床分期,Ki-67水平均较G9a蛋白表达阴性患者更高,提示G9a可能与DLBCL的增殖和进展有关,此外G9a蛋白还是影响初治DLBCL患者3年OS和3年PFS的不良预后因素。
本研究首次发现与淋巴结炎性增生组织相比,组蛋白甲基化酶G9a 蛋白在DLBCL中表达明显增加;并进一步揭示了G9a的表达与DLBCL的临床特征、疗效及预后有一定的关系,但仍需要扩大样本进一步验证。后续应开展G9a在DLBCL作用机制的深入研究,进一步探讨G9a在DLBCL发生发展中的意义。
