双层探测器光谱CT对纯磨玻璃结节肺腺癌侵袭程度的鉴别价值*
2022-08-09李敏韩丽珠马菊香李琪王化叶兆祥
李敏 韩丽珠 马菊香 李琪 王化 叶兆祥
随着高分辨率CT的应用和肺癌CT筛查的广泛开展,肺纯磨玻璃结节(pure ground-glass nodule,pGGN)的检出逐渐增加。pGGN是肺实质内无实性成分、保留支气管和血管边缘的局灶密度增高影[1]。其病理类型多为肺腺癌腺体前驱病变,包括不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)和原位腺癌(adenocarcinomain situ,AIS),也可表现为微浸润腺癌(minimally invasive adenocarcinoma,MIA),甚至浸润性腺癌(invasive adenocarcinoma,IA)[2]。2021年世界卫生组织(WHO)胸部肿瘤分类将AAH和AIS从肺癌目录中调整至前驱病变处,肺腺癌则仅包括MIA和IA[3]。MIA和IA在病理上主要根据肺腺癌浸润灶范围划分,MIA为≤3 cm的孤立性小腺癌,癌细胞以附壁生长为主,浸润灶最大径≤5 mm,而IA在病理上至少有1个浸润灶的最大径>5 mm[4]。研究表明MIA的5年无病生存率(disease-free survival,DFS)为100%,可采用亚肺叶切除,而IA患者5年DFS低于85.2%,建议肺叶切除[5-6]。且另有研究显示,在MIA中,肺叶和亚肺叶切除组的生存率并无显著差别[7-8]。而亚肺叶切除能保留更多功能正常的肺组织,可减少手术相关并发症和死亡率。因此,鉴别MIA和IA对患者手术切除方案选择及预后评估具有重要意义。研究者们试图通过pGGN的CT特征来术前预测肺腺癌的浸润程度,然而,形态学特征易受主观判断的影响,而常规CT定量特征如大小、平均CT值等的鉴别价值有限[9-11]。双能量CT(dual-energy CT,DECT)通过处理高低X线能谱下采集的数据,能实现物质分离和单能量成像,为病变诊断提供更多定量参数[12]。目前,利用DECT分析pGGN的研究较少[13-15]。本研究采用新型双层探测器光谱CT,旨在探讨其对表现为pGGN的MIA和IA的鉴别价值。
1 材料与方法
1.1 临床资料
收集2019年8月至2021年6月在天津医科大学肿瘤医院术前行双层探测器光谱CT胸部增强扫描,CT上表现为pGGN,且术后病理证实为MIA和IA的患者资料。纳入标准:1)术前行双层探测器光谱CT胸部增强扫描,术后病理证实为IA和MIA;2)在肺窗上表现为pGGN,纵隔窗无实性成分(排除血管和气管)[16],且病灶大小≤3 cm。排除标准:光谱CT增强扫描与手术时间间隔>1个月。符合上述纳入标准的共计107例,其中6例光谱CT扫描与手术间隔时间>1个月。最终共纳入101例(103枚pGGN)患者,其中男性31例,女性70例,年龄24~73岁,中位年龄55岁。
1.2 方法
1.2.1 图像采集与重建 采用荷兰Philips IQon spectral CT机,行胸部平扫和增强扫描,范围从肺尖到肺底。扫描参数:管电压120 kVp,管电流为自动调节设置,准直器宽度为64.000 mm×0.625 mm,螺距1.015,FOV 500 mm,球管转速0.5 s/圈。增强扫描采用碘普罗胺(含碘300 mg/mL,拜尔)对比剂,以2.5 mL/s的流率注射,剂量根据患者体质量计算(1.5 mL/kg)。在注射后70 s采集胸部增强图像。完成扫描后,对采集的数据进行迭代重建和光谱重建,分别获得常规120 kVp混合能量图像(polyenergetic image, PI)和光谱图像。图像的重建层厚为1.5 mm,层间距为1 mm。PI平扫肺窗重建算法为Y-detail,PI平扫和增强纵隔窗及单能量图像重建算法为标准算法。肺窗设置:窗宽1 200 HU,窗位-500 HU;纵隔窗设置:窗宽320 HU,窗位35 HU。
1.2.2 图像分析 将重建的PI和所有图像分别传至医学影像存储与传输系统(picture archiving and communicaition systems, PACS)和后处理Philips IntelliSpace Portal工作站。由两名医师在不知道病理结果的情况下对图像进行分析。在PACS中,对平扫PI(肺窗,窗宽1 200 HU;窗位-500 HU)进行分析,完成结节大小测量(最大横断面的最大径)和CT特征评估,包括形状(圆形或类圆形/不规则)、肺瘤界面(清楚/模糊)、毛刺征、分叶征、胸膜牵拉征、空泡征、空气支气管征及血管异常征(内部血管增粗、扭曲或聚集)。在后处理工作站对增强的PI和光谱图像进行定量参数测量。选取结节最大横断面及其上下相邻两个层面放置ROI。ROI勾画应避开血管、支气管和空泡等,并使面积尽量最大。对3个连续层面所测参数取平均值。通过复制粘贴功能,保持ROI的大小及位置在PI和各光谱图像相同。所测参数包括:1)增强PI的CT值;2)病灶和同层面主动脉或锁骨下动脉碘浓度(iodine concentration,IC);3)标准化碘浓度(normalized iodine concentration,NIC),NIC=IC病灶/IC主动脉(锁骨下动脉);4)40~200 keV增强单能量图像的CT值(CT40~200keV);5)能谱曲线斜率λHU(λHU=|CT40keV-CT100keV|/60);6)有效原子序数(effective atomic number, Eff-Z)。CT征象由两名医师分别评估,意见不一致时,经协商达成一致,定量参数取两名医师所测的平均值。
1.3 统计学分析
采用SPSS 25.0和MedCalc v20.0.3软件进行统计学分析。以ICC和Kappa值分别评估定量参数和CT征象在两名医师间的一致性。计量资料通过Shapiro-Wilk检验进行正态检验。服从正态分布的计量资料表示为±s,采用独立样本t检验比较组间差异。用中位数(四分位数间距)表示非正态分布的计量资料,组间差异比较采用Mann-WhitneyU检验。计数资料用χ²检验比较组间差异。将单因素分析有意义的变量纳入二元Logistic回归,采用有条件向前法筛选出独立预测因子,建立相应的预测模型。以ROC曲线评估预测模型及独立预测因子的诊断效能,比较诊断效能采用DeLong检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般情况
本研究纳入101例患者,共103枚pGGN,2例为2枚,99例为1枚。其中47枚pGGN为MIA,56枚pGGN为IA。两名阅片者间CT征象的一致性达到中等和较高水平(Kappa值=0.596-0.731),而定量参数的一致性较好(ICC=0.875~0.981)。
2.2 CT征象与定量参数
与MIA组比,IA组形状多表现为不规则(P=0.034),且更易出现胸膜牵拉征(P=0.005)、空气支气管征(P=0.001)及血管异常征(P<0.001);而肺瘤界面、分叶征、毛刺征和空泡征的组间差异无统计学意义(P>0.05)(表1)。IA组结节大小(P<0.001)、常规为120 kVp图像的CT值(CT120kVp,P=0.001)、40~200 keV单能量的CT值(CT40keV,P=0.003; CT50keV,P=0.002; CT60~100keV,P=0.001;CT110~200keV,P<0.001)均高于MIA组,而Eff-Z低于MIA组(P=0.018);两组间IC、NIC和λHU的差异无统计学意义(P>0.05)(表2,图1,2)。
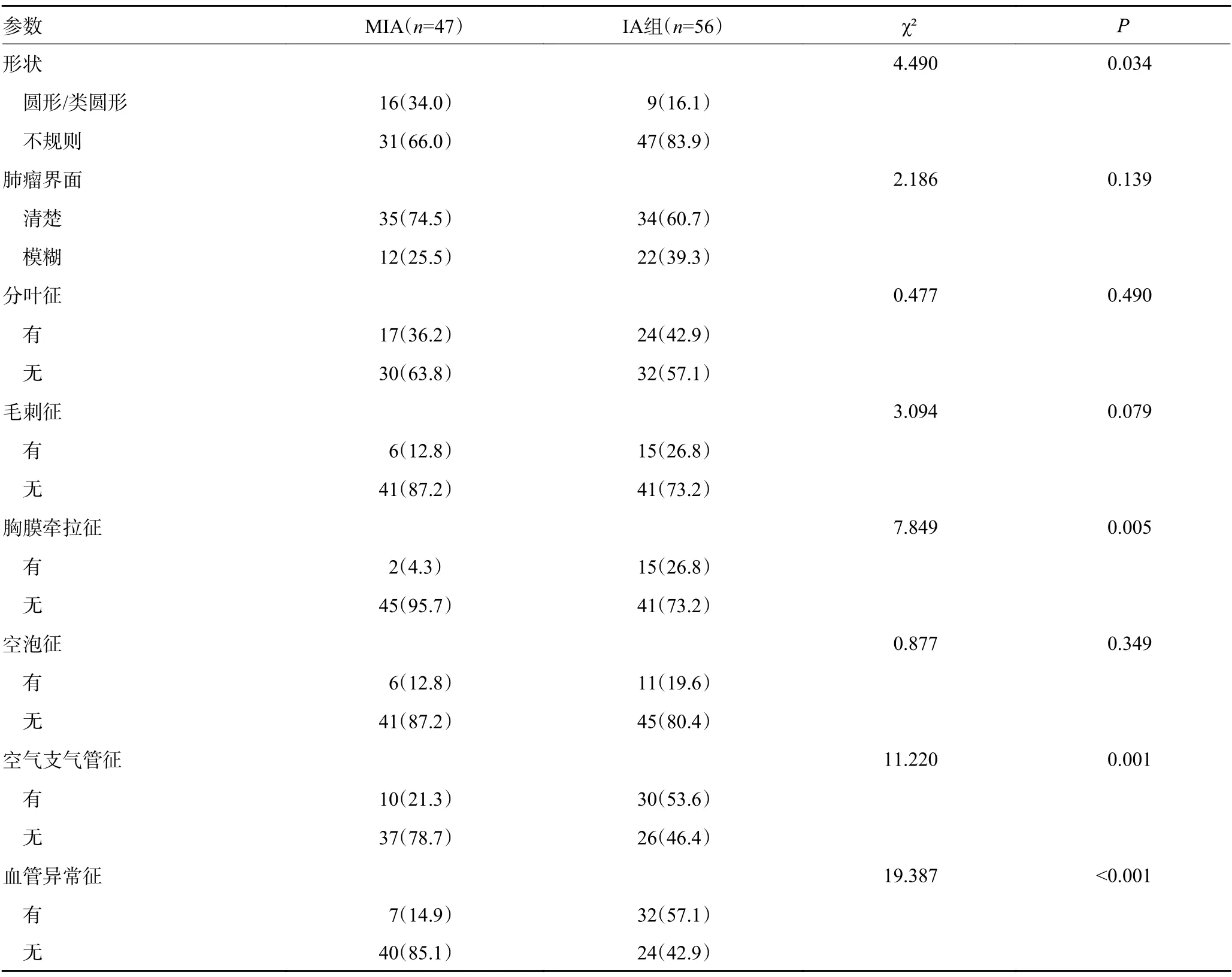
表1 pGGN CT征象在MIA组和IA组间的差异比较 例(%)

表2 pGGN定量参数在MIA组和IA组间的差异比较
2.3 Logistic回归及ROC曲线分析
将单因素分析有意义的参数纳入Logistic回归模型,结果显示pGGN大小(OR=1.435,95%CI:1.204~1.709,P<0.001),CT200keV(OR=1.011,95%CI:1.005~1.016,P<0.001)是预测IA的独立影响因子。ROC曲线分析结果显示pGGN大小的AUC为0.774(95%CI:0.681~0.866),最大约登指数对应的最佳诊断阈值为10.48 mm;CT200keV的AUC为0.700(95%CI:0.598~0.802),鉴别MIA和IA的最佳截断值为-574.78 HU。联合上述两个独立影响因子建立Logistic回归模型,预测模型AUC最高达到0.855(95%CI:0.780~0.930),灵敏度为0.661,特异度为0.957,且AUC显著高于结节大小(P=0.046)和CT200keV(P=0.002)(表3,图3)。
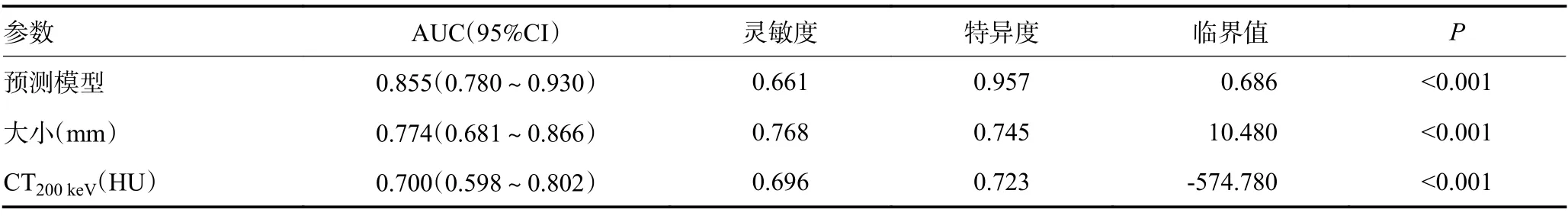
表3 预测模型及独立预测因子的ROC曲线分析
3 讨论
手术切除的pGGN多为早期肺腺癌及其前体。而按侵袭程度划分的MIA和IA在手术治疗方案和预后方面的差异较大。pGGN侵袭程度的有效评估对临床干预和治疗具有重要参考意义,术前准确诊断有助于提高治疗精准性。双层探测器光谱CT通过双层探测器结构来获得高低X线能谱数据,可同时获得常规图像和光谱图像,不仅能定性还能定量分析病变[17]。本研究采用双层探测器光谱CT,探究其对表现为pGGN的MIA和IA的鉴别价值,结果显示结节形状、胸膜牵拉征、空气支气管征、血管异常征、结节大小、Eff-Z、CT120kVp以及CT40~200keV在两组间差异具有统计学意义,多因素Logistic回归分析结果显示结节大小及CT200keV是预测IA的独立影响因子。
在本研究中,IA组血管异常征和空气支气管征的发生率均高于MIA组,且两组间差异有统计学意义,与既往研究一致[18-19]。上述两种征象在IA中比例较高的原因可能是随着pGGN侵袭程度增加,肿瘤细胞增多、代谢增强,血供需求相应增加,进而促进肿瘤细胞促血管生成因子的分泌,使血管增粗、增多,同时,结节内纤维化反应增加,纤维收缩牵拉邻近支气管和血管,导致支气管扩张、血管扭曲、聚集等改变[20]。本研究还发现,与MIA相比,IA形状多为不规则,可能跟肿瘤细胞生长方式密切相关,MIA的肿瘤细胞以沿肺泡壁生长为主,形状多表现为类圆形或圆形;而IA的侵袭程度更高,肿瘤细胞不断向周围基质浸润,不同方向肿瘤细胞的分化程度不同加上受到周围阻力的大小也不同,所以形状多表现为不规则[21]。而胸膜牵拉征在IA中更为常见可能与肿瘤内部收缩,纤维组织牵拉临近脏层胸膜有关[22]。从MIA发展到IA,上述征象的发生率逐渐增高,在一定程度上反映了侵袭性增加的特征。
pGGN的大小被认为是反映pGGN肺腺癌侵袭程度的重要指标[9-10]。潘小环等[22]对pGGN进行分析,发现结节最大直径是鉴别MIA和IA的重要征象,最佳诊断阈值为11.75 mm。本研究结果显示IA组结节大小显著高于MIA组,结节大小是预测IA的独立因素,鉴别IA和MIA的最佳临界值为10.48 mm,与上述临界值存在一定的差异,可能是样本构成和样本量不同所致。
双层探测器光谱CT的优势是能够重建出碘密度图像、单能量图像和有效原子序数图,进而用于定量分析[12]。碘密度图像可定量评估病灶碘含量,以反映血管分布状态,对鉴别肺肿瘤良恶性具有重要价值[23]。通过碘密度图像测量的IC可反映磨玻璃结节(groundglass nodule,GGN)的血供状况[24]。本研究结果显示IC或NIC对MIA和IA无明显鉴别价值,可能是因为不同病理类型的肺腺癌血管分布相似,pGGN的血供差别不足以通过IC或NIC区分开来[15],但也可能与样本量较小有关。Eff-Z为与某化合物或混合物有相同衰减效果的元素的原子序数,可鉴别成像组织的不同组成成分[25]。既往研究显示Eff-Z的定量分析能反映不同组织的特征[26]。本研究中,MIA和IA组Eff-Z的差异具有统计学意义,可能是pGGN从MIA发展到IA的过程中,其细胞数量、细胞的侵袭程度以及纤维成分等逐渐增加,进而导致两者物质组成存在差异[27]。Yu等[14]和Zhang等[15]将AIS和MIA合并为侵袭前病变,研究能谱CT对其与IA的鉴别价值,结果显示单能量CT值有助于两者的鉴别,高单能量图像的CT值是预测IA的独立影响因素。而本研究采用具有更宽单能量范围(40~200 keV)的双层探测器光谱CT(Yu等[14]和Zhang等[15]的研究均为40~140 keV),根据2021版WHO肺腺癌最新分类,研究DECT定量参数鉴别MIA和IA的能力,取得相似的结果,结果显示常规120 kVp图像及单能量图像的CT值在MIA组和IA组间的差异具有统计学意义,Logistic回归分析显示CT200keV是与IA相关的独立影响因素。pGGN在肺腺癌微浸润到浸润过程中密度逐渐增高,密度差别在图像上则表现为CT值的差异[22]。与常规图像的CT值相比,单能量图像能克服线束硬化,提供的CT值更加准确[28]。同时,由于碘在低单能量下的衰减会增加,低单能量图像的CT值在增强中受碘的影响较大,图像噪声也会增加,而高单能量图像CT值受碘的影响较小[28],其CT值能更加准确反映pGGN的密度差异。
本研究存在一定的局限性:1)本研究纳入的都是手术切除的pGGN,侵袭程度可能较高,因此有一定的选择偏倚;2)本研究为单中心研究,且样本量较小,未来可通过扩大样本量进一步研究;3)本研究中仅对pGGN 3个连续层面进行量化分析,未来可借助专门软件对整个结节进行量化或影像组学研究;4)本研究扫描方案仅采集静脉期增强图像,今后可采用动脉期和静脉期双期扫描行定量分析。
综上所述,双层探测器光谱CT对鉴别表现为pGGN的MIA和IA具有重要价值,结节大小和CT200keV是与IA相关的独立影响因素,且Logistic回归模型的诊断效能显著高于单个独立影响因素,能为临床pGGN诊疗提供一定的参考价值。
