注射用帕瑞昔布钠与3种临床常用输液的配伍稳定性研究Δ
2022-08-09周素琴马旭阳张圣苗高建丽
谢 姣,周素琴,贾 晨,马旭阳,张圣苗,杨 洁,高建丽,王 睿,赵 慧#
(1.西安交通大学第二附属医院药学部,西安 710004; 2.兰州大学第二医院药学部,兰州 730030; 3.杭州市富阳区第一人民医院药剂科,杭州 311400)
帕瑞昔布钠是可注射的环氧合酶-2抑制剂,可用于外科手术后疼痛的短期治疗[1-2]。该药已在多种外科手术术后镇痛方案中得到广泛应用[3-5]。近年来,国内关于注射用帕瑞昔布钠在联合用药中的配伍禁忌已有多篇文献报道,该药与维生素B6[6]、注射用埃索美拉唑[7]及乳酸环丙沙星[8]等均存在配伍禁忌。而关于其在常用输液中的配伍稳定性尚未见文献报道。本研究通过建立注射用帕瑞昔布钠含量测定的高效液相色谱法,进行方法学验证后测定48 h内注射用帕瑞昔布钠与3种临床常用输液(0.9%氯化钠注射液、5%葡萄糖注射液和葡萄糖氯化钠注射液)配伍后的含量,考察配伍后的含量、pH及外观变化,为临床合理使用帕瑞昔布钠提供参考。
1 材料
1.1 仪器
Agilent 1100型高效液相色谱仪(美国Agilent公司);XSE205DU型分析天平(瑞士Mettler Toledo集团);MX-S型可调式混匀仪(上海洪纪仪器设备有限公司);TG18-WS型台式高速离心机(湖南长沙维尔康湘鹰离心机有限公司);UV-2450型紫外分光光度计(日本Shimadzu公司)。
1.2 药品与试剂
注射用帕瑞昔布钠(美国Pfizer公司,批准文号为国药准字J20180034,规格为40 mg,批号为EK8636);0.9%氯化钠注射液(四川科伦药业股份有限公司,批准文号为国药准字H51021158,规格为100 mL,批号为C20072109);5%葡萄糖注射液(甘肃扶正药业科技股份有限公司,批准文号为国药准字H62020428,规格为100 mL,批号为Y202104250);帕瑞昔布钠对照品(上海源叶生物科技有限公司,货号为S80515,纯度为99%);葡萄糖氯化钠注射液(四川科伦药业股份有限公司,批准文号为国药准字H20044573,规格为500 mL,批号为B19101612);乙腈为色谱纯试剂。
2 方法与结果
2.1 吸收波长的确定
精密称取帕瑞昔布钠对照品适量,用乙腈溶解并稀释为质量浓度为1 μg/mL的帕瑞昔布钠对照品溶液,以乙腈作为空白对照,用紫外分光光度计在200~400 nm波长下进行紫外光谱扫描,逐级稀释,使最大吸收在0.3~0.7,得出质量浓度为1 μg/mL的帕瑞昔布钠溶液在244 nm有最大吸收,吸光度为0.311,见图1。
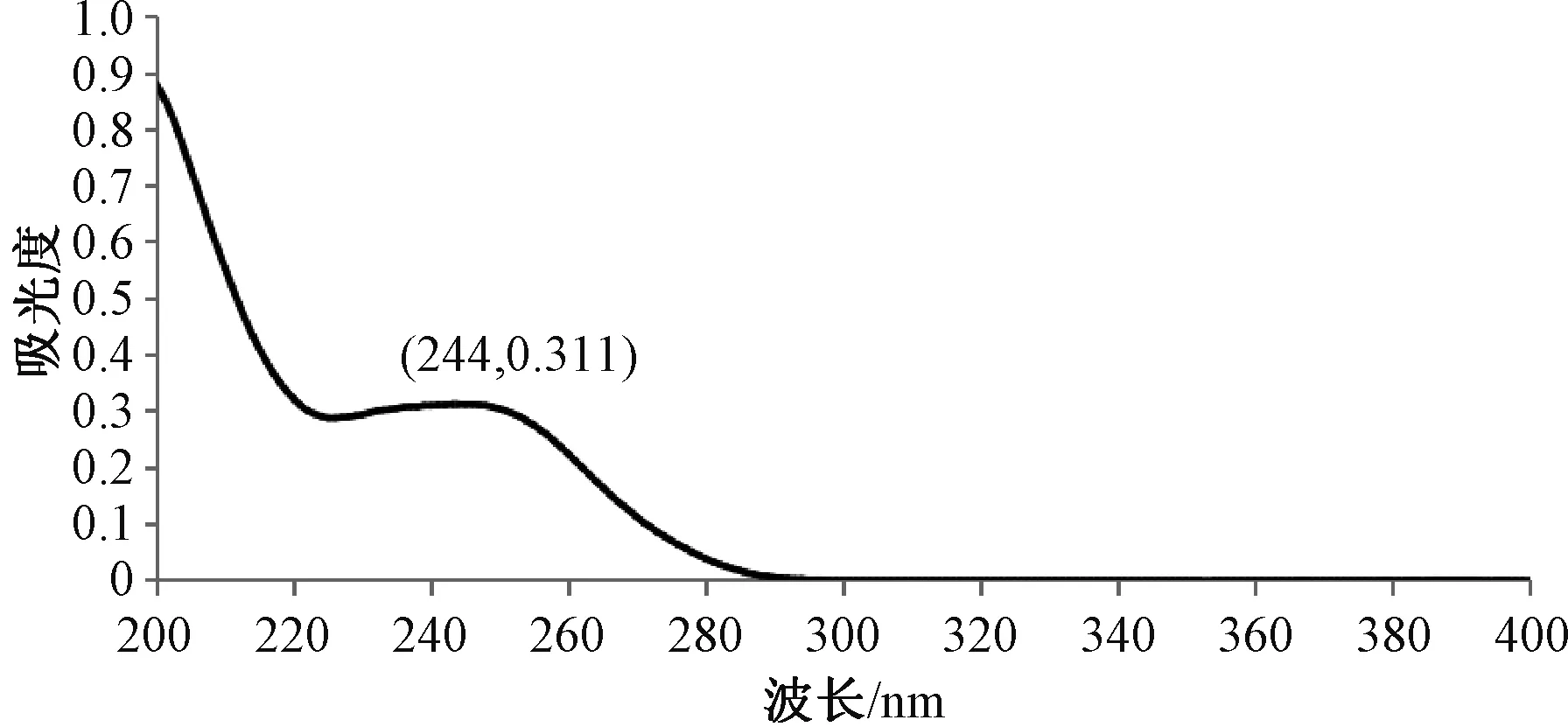
图1 帕瑞昔布钠紫外吸收光谱图Fig 1 Ultraviolet absorption spectrum of parecoxib sodium
2.2 色谱条件
色谱柱:Luna C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-磷酸盐缓冲液(0.02 mol/L磷酸二氢钾,用0.1 mol/L氢氧化钠调节pH至6.0)(V∶V=40∶ 60);流速:1.0 mL/min;检测波长:244 nm;柱温:24 ℃;进样体积:10 μL。
2.3 专属性试验
在上述色谱条件下,取流动相(按“2.2”项下流动相配制)10 μL进样,记录色谱图;精密称取帕瑞昔布钠对照品适量,加入流动相溶液溶解、稀释,将对照品溶液质量浓度配至100 μg/mL。取10 μL进样,记录色谱图。取适量注射用帕瑞昔布钠,分别溶于0.9%氯化钠注射液、5%葡萄糖注射液、葡萄糖氯化钠注射液中。取上述溶液适量,经微孔滤膜过滤后,取续滤液10 μL进样后记录液相色谱图(结果见图2)。帕瑞昔布钠对照品出峰时间为7.593 min,峰形良好且在保留时间处均无杂质峰干扰,具有很好的专属性。因此,本方法专属性符合测定要求。
2.4 标准曲线的制备
精密称取适量帕瑞昔布钠对照品,加入流动相溶液溶解、稀释,将对照品溶液配制为100 μg/mL的帕瑞昔布钠储备液。分别吸取帕瑞昔布钠储备液适量,加流动相配制得到质量浓度为400、200、100、50、25和12.5 μg/mL的帕瑞昔布钠溶液。取上述溶液适量,经微孔滤膜过滤后,取10 μL滤液进样,记录色谱图。以帕瑞昔布钠系列溶液的峰面积为纵坐标(Y),以帕瑞昔布钠浓度(X)为横坐标进行线性回归,得回归方程:Y=25.548X-159.82(r=0.999 90,n=6)。结果表明,帕瑞昔布钠质量浓度在12.5~400 μg/mL内线性关系良好。
2.5 精密度试验
分别配制高、中及低浓度(200、100及20 μg/mL)的帕瑞昔布钠对照品溶液,经微孔滤膜过滤后,取10 μL滤液进样,记录色谱图。以1 d内连续5次测得的帕瑞昔布钠峰面积计算日内精密度值,以连续5 d内分别测定的帕瑞昔布钠峰面积计算日间精密度值。结果显示,帕瑞昔布钠低、中及高浓度的日内精密度分别为5.11%、2.83%及0.84%;日间精密度分别为4.76%、3.35%及3.01%。表明该方法精密度良好,符合测定要求。
2.6 回收率试验
精密量取已知含量、不同体积的帕瑞昔布钠样品溶液(500、1 000和1 500 μL),分别加入至100 μg/mL帕瑞昔布钠对照品溶液1 000 μL中,混匀后取10 μL进样测定并计算峰面积,采用回归方程计算药物浓度并计算各浓度水平的平均回收率。结果显示,500、1 000和1 500 μL帕瑞昔布钠样品溶液的回收率分别为98.02%、102.19%和104.52%,RSD分别为5.91%、2.61%和3.55%(n=3)。
2.7 配伍稳定性试验
按照临床用药浓度,模拟临床配置方法,取2 mL溶剂溶解40 mg注射用帕瑞昔布钠,分别加入至100 mL的0.9%氯化钠注射液、5%葡萄糖注射液、葡萄糖氯化钠注射液中,混匀并使之完全溶解。在室温(20~25 ℃)下,分别于配制后的0、0.5、1、2、4、6、8、12、24和48 h取上述溶液适量,加入流动相(按“2.2”项下流动相配制)稀释为质量浓度100 μg/mL的溶液,经微孔滤膜过滤后取续滤液10 μL进样,记录高效液相色谱图,以0 h溶液中帕瑞昔布钠含量为100%,分别计算不同时间点帕瑞昔布钠的百分含量,并测定相应时间点帕瑞昔布钠溶液的pH,观察溶液外观及性状改变。结果显示,注射用帕瑞昔布钠与3种临床常用输液配伍,其外观48 h内均为无色澄明液体,pH随着配伍时间延长均略有降低,3种配伍溶液的pH为6.8~7.4,接近人体血液pH值;3种配伍溶液含量随配伍时间的延长均有降低,与配伍后0 h相比,与0.9%氯化钠注射液配伍48 h降低2.3%,与5%葡萄糖注射液配伍48 h降低7.8%,与葡萄糖氯化钠注射液配伍48 h降低4.7%,在配伍48 h内含量降低幅度均未超过10%,说明帕瑞昔布钠与0.9%氯化钠注射液、5%葡萄糖注射液、葡萄糖氯化钠注射液配伍后在室温下48 h内稳定,见表1。
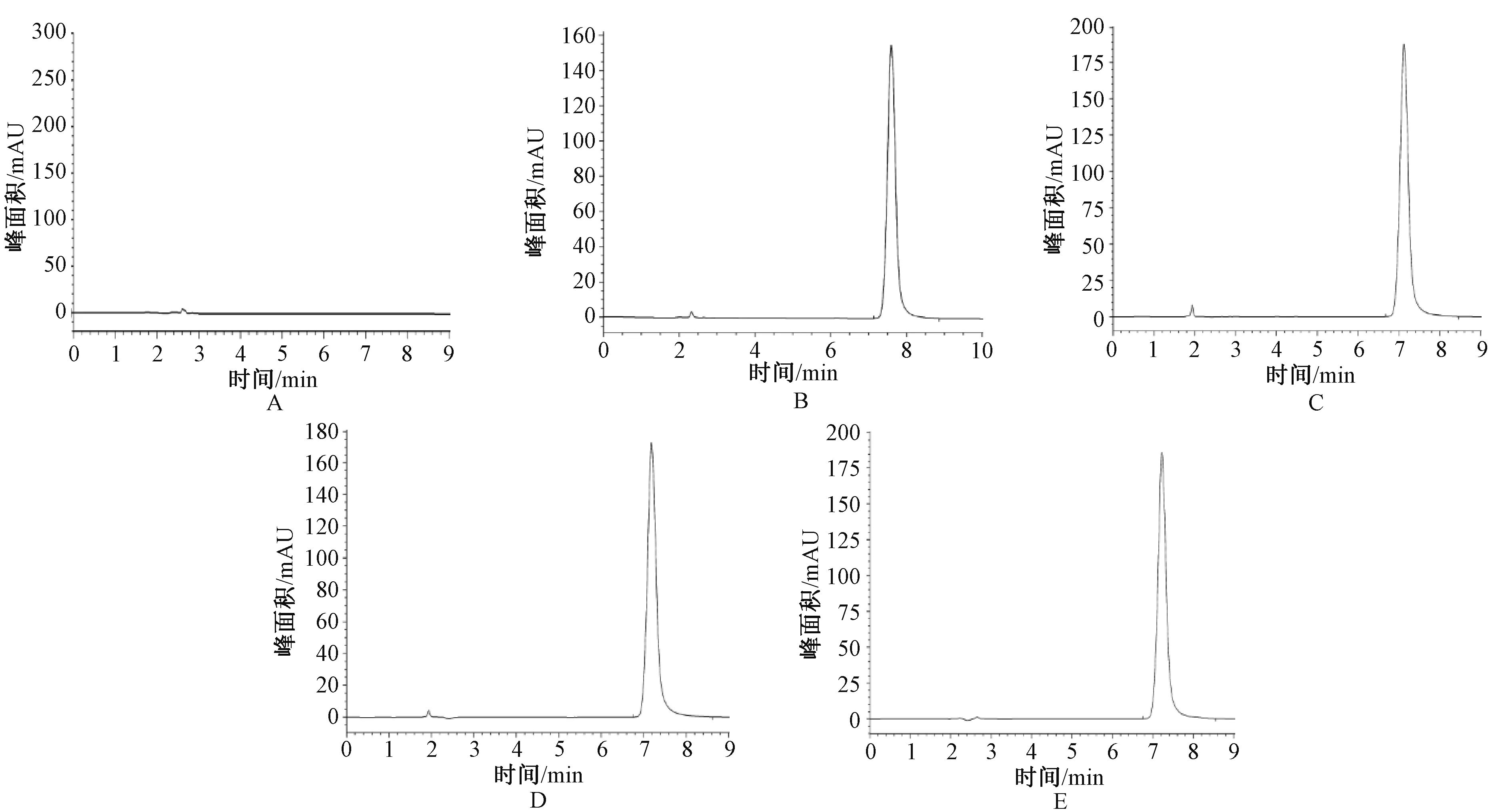
A.空白溶液;B.帕瑞昔布钠对照品溶液;C.帕瑞昔布钠+0.9%氯化钠注射液;D.帕瑞昔布钠+5%葡萄糖注射液;E.帕瑞昔布钠+葡萄糖氯化钠注射液A. blank solution; B. control solution of parecoxib sodium; C. parecoxib sodium + 0.9% sodium chloride injection; D. parecoxib Sodium + 5% glucose injection; E. parecoxib sodium + glucose sodium chloride injection图2 高效液相色谱图Fig 2 High performance liquid chromatography
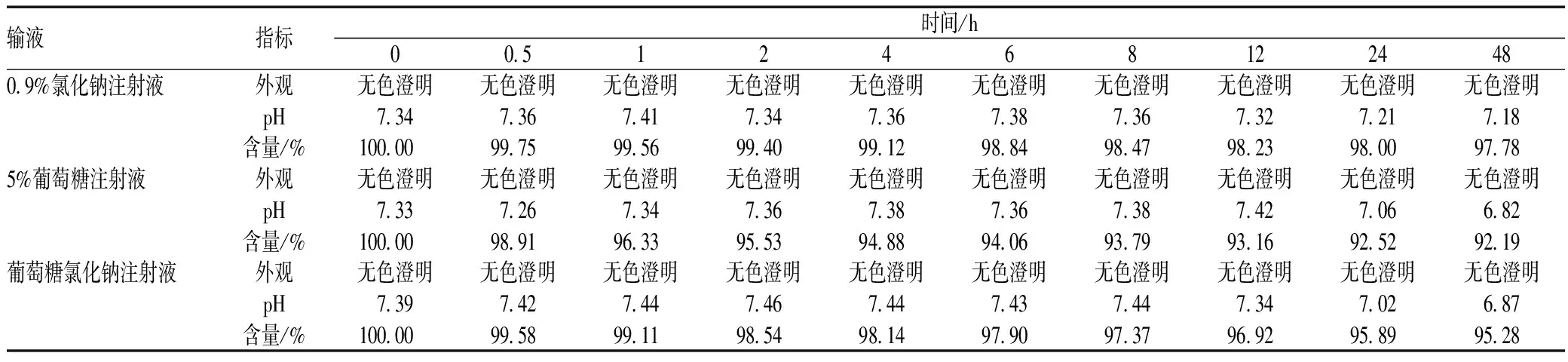
表1 注射用帕瑞昔布钠与3种不同输液配伍后48 h内的外观、pH及含量变化Tab 1 Changes of appearance, pH and content of parecoxib sodium within 48 h after compatibility with three kinds of infusion
3 讨论
帕瑞昔布钠在临床上被广泛用于关节置换术、妇科手术、眼科手术和结肠直肠手术等术前和术后镇痛治疗[9-11]。临床回顾性研究结果发现,帕瑞昔布钠在溶剂选择、药物配伍和用药疗程等方面存在不合理现象。宋佳伟等[12]的研究结果显示,在某院抽取的63份病历中,帕瑞昔布钠用药不合理率较高,问题多见于配伍禁忌、用法用量不当和适应证不适宜等方面。王芳等[13]的研究结果显示,帕瑞昔布钠在该院应用中存在联合用药不合理、超剂量用药和配伍禁忌等不合理现象。于雯等[14]报道了帕瑞昔布钠与12种药物存在配伍禁忌;张义春等[15]报道了帕瑞昔布钠与左氧氟沙星氯化钠注射液存在配伍禁忌;李世浩等[16]考察了帕瑞昔布钠在不同器具中的稳定性。但帕瑞昔布钠在不同输液中的稳定性未见相关研究。
静脉药物的稳定性主要受到药液pH、溶剂、辅料、包材和化学反应(如水解反应、氧化反应)等影响[17]。本研究考察了注射用帕瑞昔布钠与3种不同输液配伍后48 h内的稳定性,采用高效液相色谱法进行含量测定,该方法专属性强、灵敏度高。本研究结果表明,注射用帕瑞昔布钠与0.9%氯化钠注射液、5%葡萄糖注射液、葡萄糖氯化钠注射液在配伍后48 h内具有良好的配伍稳定性,其中在0.9%氯化钠注射中含量变化(2.3%)及pH变化(0.16)最小,可能是因为0.9%氯化钠溶液为中性(pH=7),而5%葡萄糖注射液的pH为3.5~6.5、葡萄糖氯化钠注射液的pH为3.5~5.5,均偏酸性,帕瑞昔布钠在中性条件下更加稳定。
静脉制剂中,因添加剂和辅料本身具有不同的pH,可进一步影响静脉药物与不同溶剂配制后的溶解度和稳定性[18]。此外,人体血液在正常情况下的pH为7.35~7.45,有研究结果表明,上述pH范围外的注射液会损伤血管内皮细胞,诱发血小板聚集,从而引发静脉炎[19-20]。本研究所用3种配伍溶液的pH为6.82~7.46,与人体血液pH接近,可降低输液反应的发生风险。3种配伍溶液在48 h内含量降低幅度均未超过10%。因此,帕瑞昔布钠与0.9%氯化钠注射液、5%葡萄糖注射液、葡萄糖氯化钠注射液配伍后在室温下48 h内稳定。
本实验研究结果可为合理使用帕瑞昔布钠提供临床用药依据。临床配制静脉输液时,建议充分考虑药物自身的理化性质,配伍时需综合考虑可能的影响因素,如溶剂的选择、输液配置后放置时间及药物的相互作用等,规避药品不良事件的发生,促进静脉药物的临床合理使用。
