GPX4水平与急性冠状动脉综合征病人临床特征、危险分层及其预后相关性研究
2022-08-09包炳蔚丁丝雨季春斐姚卓亚钱少环高大胜史晓俊王洪巨李妙男
包炳蔚,丁丝雨,季春斐,姚卓亚,钱少环,路 桥,李 正,高大胜,史晓俊,王洪巨,李妙男
急性冠状动脉综合征(ACS)是一组严重的心脏急性缺血综合征[1-2],其病情变化迅速,且对心肌产生不可逆转的缺血损伤。虽然随着现代医学水平的进步,ACS的发病机制已逐渐明确[3-4],治疗方案也日趋完善,但仍有部分病人在接受了系统的药物及介入治疗后会出现不良心血管事件[1-2,5-6]。因此,积极探索心肌细胞死亡调控通路,保护心脏免受缺血相关损伤,将对临床靶向防治ACS并改善其远期预后有重要的指导价值。
有研究[7]表明,抑制谷胱甘肽过氧化物酶4(GPX4)的功能将导致细胞膜发生脂质过氧化,并可诱导铁死亡。FENG等[8]研究发现,铁死亡抑制剂利普罗斯他汀-1通过增加GPX4活性,减少线粒体脂质活性氧的生成,保护小鼠心肌细胞免受缺血再灌注损伤。我们推测ACS病人可能会因为高水平的GPX4抑制心肌细胞铁死亡而获益。但目前GPX4与ACS之间的相关性仍不明确,血浆GPX4水平与心肌缺血损伤之间的研究大多处于基础研究阶段。本研究采用酶联免疫吸附法(ELISA)对404例病人的血浆GPX4水平进行检测,观测血浆GPX4水平变化与ACS病人临床特征、危险分层及其预后之间的相关性,从而为更精确有效地防治ACS并改善其预后提供新的治疗思路。
1 资料与方法
1.1 一般资料 纳入2018年11月至2019年6月因胸痛于我科住院治疗并拟行冠状动脉造影检查的病人404例。ACS组纳入标准:依据中华医学会相关指南[9-12],根据病史、生化指标、影像学检查及冠脉造影结果分为不稳定型心绞痛组(UAP组)261例和急性心肌梗死组(AMI组)55例。同时选取同期行冠状动脉造影并排除冠心病诊断的病人为对照组。排除标准:肝肾功能不全,急性脑血管疾病,感染性疾病,肿瘤等消耗性疾病,血液系统疾病,碘及造影剂过敏和病史资料收集不全的病人。
1.2 样品收集 所有病人均于入院后次日清晨在空腹状态下接受肘静脉血的采集,分别抽取5 mL置于肝素钠抗凝试管中,送往我院检验科进行各项常规生化指标检测;5 mL置于EDTA抗凝试管中,送往我院心肺实验室,经过离心留存血清,置于-80 ℃环境下保存,待样本集齐后,采用ELASA检测每个样本中血浆GPX4的水平[13]。
1.3 冠状动脉造影 采用Judkins[14-15]法行冠状动脉造影,判断造影结果的标准为美国ACC/AHA心血管疾病诊治报告[16],由经验丰富的专业心内科医师操作完成。应用Gensini评分[17]评估病人冠状动脉病变严重程度。
1.4 TIMIT危险分层 采用心肌梗死溶栓治疗临床试验危险评分(TIMI危险评分)[18-19]对ACS组病人进行危险分层,UAP/NSTEMI和STEMI病人按不同评分标准计算。
1.5 随访 采用门诊及电话随访等形式,追踪随访ACS组病人院外主要心血管不良事件(MACEs)[20]的发生情况,平均为期21个月。本研究包含的MACEs为:再发胸痛、心力衰竭、脑卒中、再发心梗、出血、再次血运重建、支架内血栓、支架内再狭窄、死亡。
1.6 统计学方法 采用t检验、χ2检验、非参数秩和检验、Kaplan-Meier法、ROC分析和Cox风险比例回归分析。
2 结果
2.1 ACS组与对照组基线资料比较 ACS组在年龄、男性病人比例、合并高血压、合并糖尿病、血肌酐、TG、低密度脂蛋白水平上高于对照组,而高密度脂蛋白水平低于对照组(P<0.05~P<0.01)(见表1)。
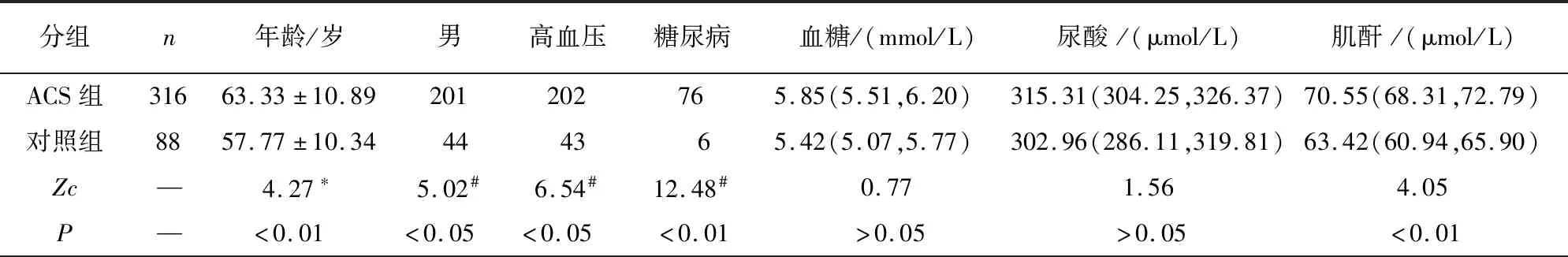
表1 AC组与对照组病人基线资料比较[M(P25,P75)]
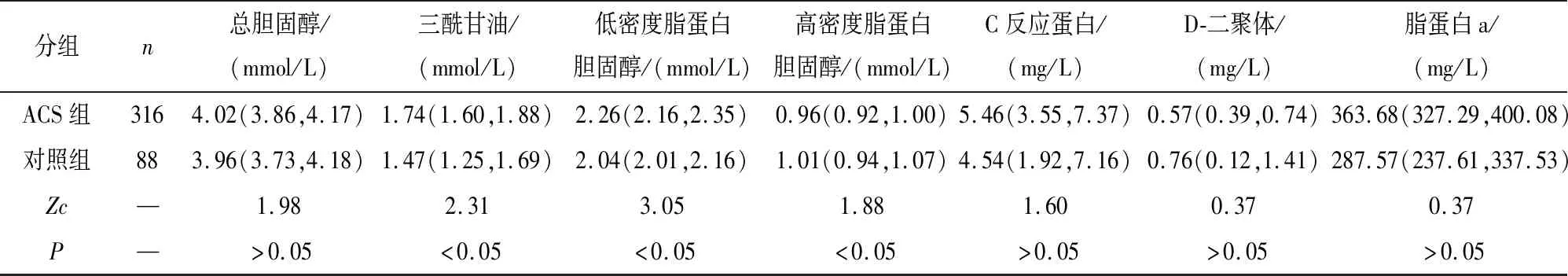
分组n总胆固醇/(mmol/L)三酰甘油/(mmol/L)低密度脂蛋白胆固醇/(mmol/L)高密度脂蛋白胆固醇/(mmol/L)C反应蛋白/(mg/L)D-二聚体/(mg/L)脂蛋白a/(mg/L)ACS组3164.02(3.86,4.17)1.74(1.60,1.88)2.26(2.16,2.35)0.96(0.92,1.00)5.46(3.55,7.37)0.57(0.39,0.74)363.68(327.29,400.08)对照组883.96(3.73,4.18)1.47(1.25,1.69)2.04(2.01,2.16)1.01(0.94,1.07)4.54(1.92,7.16)0.76(0.12,1.41)287.57(237.61,337.53)Zc—1.982.313.051.881.600.370.37P—>0.05<0.05<0.05<0.05>0.05>0.05>0.05
2.2 研究对象血浆GPX4水平比较 ACS组血浆GPX4水平低于对照组(P<0.05)。UAP组与AMI组血浆GPX4水平差异无统计学意义(P>0.05)(见表2)。
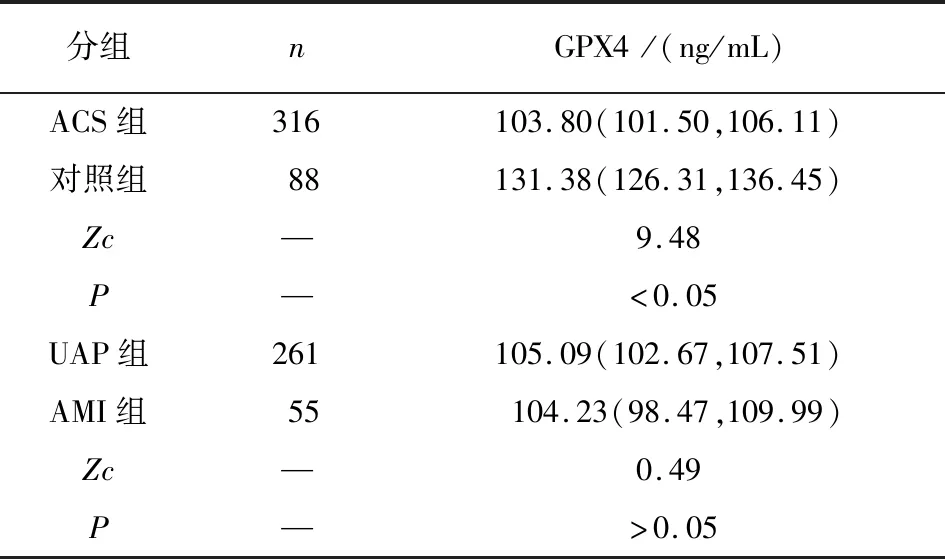
表2 不同病人血浆GPX4水平比较
2.3 血浆GPX4水平对ACS的诊断价值 ROC曲线显示血浆CTPX4水平可以辅助ACS的诊断。ROC曲线下面积(AUC)为0.828(0.778~0.878),其最佳截断点为128.78 ng/mL,特异性为64.8%,敏感性为90.0%(P<0.05)(见图1)。
2.4 不同TIMI危险分级ACS病人基线资料的比较 根据病人TIMI危险评分将ACS组病人分为低危组、中危组和高危组,结果发现,低危组在年龄、合并高血压、C反应蛋白、D-二聚体水平均低于中危组及高危组,在合并糖尿病、Gensini评分水平低于高危组,在男性病人占比上高于高危组(P<0.05~P<0.01)。低危组血浆GPX4水平高于中危组和高危组(P<0.05),高危组病人血浆GPX4水平与中危组差异无统计学意义(P>0.05)(见表3)。

表3 TIMI危险分层低危组、中危组和高危组病人基线资料比较[M(P25,P75)]

分组n低密度脂蛋白胆固醇/(mmol/L)高密度脂蛋白胆固醇/(mmol/L)C反应蛋白/(mg/L)D-二聚体/(mg/L)脂蛋白a/(mg/L)Gensini评分GPX4/(ng/mL)低危组532.30(2.03,2.57)0.96(0.90,1.03)1.59(1.01,2.18) 0.26(0.16,0.37)363.68(327.29,400.08)23.75(16.70,30.80) 114.63(107.46,121.79) 中危组2272.14(2.02,2.27)0.95(0.92,0.98)5.91(3.42,8.41)∗ 0.57(0.34,0.79)∗332.72(291.79,373.65)33.18(28.54,37.81) 101.61(99.01,104.20)∗高危组362.41(2.07,2.74)1.06(0.69,1.43)8.38(1.23,15.54)∗0.79(0.35,1.24)∗378.36(248.47,508.25)52.44(37.23,67.65)∗102.75(96.85,108.66)∗Zc—3.683.539.9916.493.6713.7814.50P—>0.05>0.05<0.01<0.01>0.05<0.01<0.05
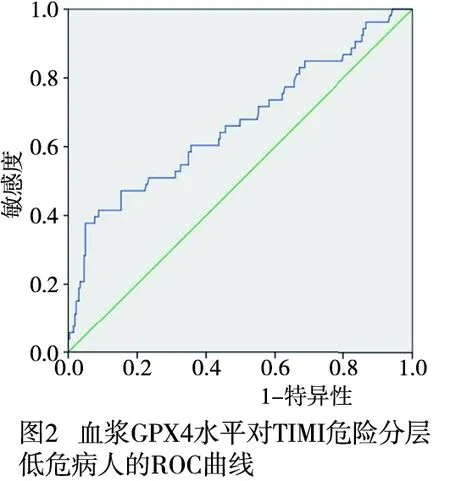
2.5 血浆GPX4水平对TIMI危险分层中低危病人的诊断价值 ROC曲线显示血浆GPX4水平可以辅助TIMI危险分层中低危病人的诊断。AUC为0.665(0.577~0.754),敏感度为37.7%,特异性为95.0%,最佳截断值为127.06 ng/mL(P<0.05)(见图2)。

2.6 MACEs组与非MACEs组血浆GPX4水平比较 本研究对ACS组病人进行了平均21个月的门诊或电话随访,其中4例(1.3%)失访,共30例(9.5%)发生MACEs事件。根据随访结果中病人是否发生MACEs事件,将ACS组病人分为MACEs组30例和非MACEs组282例,结果发现,MACEs组病人GPX4水平为95.16(90.05,100.26)ng/mL,低于非MACEs组104.53(102.01,107.06)ng/mL(Zc=2.86,P<0.05)。
2.7 Kaplan-Meier生存分析 依据所有ACS病人测得GPX4数值的中位数将研究对象分为GPX4≥101.90 ng/mL组和GPX4<101.90 ng/mL组,绘制Kaplan-Meier曲线。在所有ACS病人中,4例失访。GPX4≥101.90 ng/mL 158例,失访2例,共10例发生MACEs事件,平均生存时间为620.06 d;GPX4<101.90 ng/mL的病人人数为158例,失访2例,共20例发生MACEs事件,平均生存时间为607.23 d。K-M曲线显示,血浆GPX4<101.90 ng/mL的ACS病人预期生存时间与GPX4≥101.90 ng/mL组差异无统计学意义(χ2=3.70,P>0.05)(见图3)。
2.8 Cox风险比例回归分析 将血浆GPX4水平纳入Cox风险比例回归分析,结果显示,B′为-0.03,SE为0.01,Waldχ2为6.99,OR(95%CI)为0.97(0.95~0.99)。随着ACS病人血浆GPX4水平的升高,ACS病人发生MACEs事件的风险降低,表明血浆GPX4水平升高是MACEs事件发生的保护因素(P<0.05)。

3 讨论
ACS在我国发病率持续升高,给社会带来严重的医疗负担[21]。并且由于心肌细胞是终末分化细胞,当心脏受到缺血损伤时,心肌细胞受到的打击将不可逆转,导致心肌细胞数量上永久减少,从而引起ACS严重的临床症状及不良的预后。因此,探索心肌细胞死亡的调控通路,抑制心肌细胞死亡,保护心脏免受缺血相关损伤,将对临床靶向防治ACS并改善其远期预后起到重要的指导价值。
铁死亡是来自哥伦比亚大学的研究人员DIXON等[22]于2012年正式提出的一种由小分子Erastin诱导的铁依赖性的新型细胞死亡形式。这一过程的特点是大量的、依赖于铁元素的脂质活性氧(ROS)的积累[23-24]。形态学上,铁死亡的主要变化在于线粒体的损伤,表现为线粒体外膜的破裂、线粒体膜的固缩以及线粒体嵴的减少或消失[25]。当细胞内铁代谢的稳定被打破时,细胞产生过量的铁离子(Fe2+),Fe2+在微酸环境下发生芬顿反应(Fenton)生成大量ROS,随着ROS在细胞内的不断堆积,逐步诱发细胞的铁死亡[26-27],这是目前已知的铁死亡基础启动机制。
GPX4是一种特殊的硒蛋白[28],它可以将脂质ROS还原为无毒的脂质醇,限制了脂质过氧化物在膜质中的传播,有效预防了细胞的氧化应激,从而抑制细胞的铁死亡进程[29]。因为其在铁死亡发生发展中的关键作用机制,GPX4这一铁死亡调控因子已成为研究热门。来自武汉大学的李文远等[30]的研究证明,靶向抑制铁死亡在保护心肌细胞对抗过量铁及缺血再灌注损伤时发挥了重要的作用。因此,铁死亡中的关键因子GPX4可能与心肌缺血性疾病ACS之间具有相关性。本研究发现,ACS病人的血浆GPX4水平比正常对照组病人明显降低(P<0.05),并且GPX4的ROC AUC为0.83(0.78~0.88),其最佳截断点为128.78 ng/mL,特异性为64.8%,敏感性为90.0%,提示GPX4对于ACS的诊断具有一定的参考价值。但在比较UAP组与AMI组病人血浆GPX4水平时,两者的差异无统计学意义,可能说明GPX4对反映ACS的诊断比较敏感,但对ACS中各种亚型的鉴别价值不大。TIMI危险评分是临床上针对于ACS病人预后的危险评分[31],用于ACS病人的危险分层与预后预测时,操作方便,实用,有效。本研究发现,TIMI危险分层低危组病人的血浆GPX4水平高于中危组和高危组(P<0.05),并且ROC曲线显示,血浆GPX4对TIMI危险分层中病人是否处于低危状态具有判别价值,其中AUC为0.665(0.578,0.754),敏感度为37.7%,特异性为95.0%,最佳截断值为127.06 ng/mL(P<0.05),这表明GPX4对于临床对ACS病人进行TIMIT危险分层具有辅助参考价值。然而,高危组和中危组病人血浆GPX4水平差异无统计学意义,可能与本研究纳入高危组病人数量较少有关,有待进一步研究探讨与完善。
本研究对总计316例ACS病人进行了平均21个月的电话或门诊随访,其中4例(1.3%)失访,30例(9.6%)发生MACEs事件。我们发现MACEs组病人的血浆GPX4水平低于非MACEs组病人(P<0.05);Cox回归分析显示,GPX4是避免ACS病人发生MACEs事件的保护因素,提示高水平的血浆GPX4水平降低了ACS病人发生MACEs事件的风险。通过检测ACS病人的GPX4水平,可以有效地帮助临床医生判断病人的远期预后,对改善病人院外生存率可能起到积极作用[32]。Kaplan-Meier曲线分析显示血浆GPX4<101.90 ng/mL的病人发生MACEs事件的平均时间有比GPX4≥101.90 ng/mL的病人更早的趋势,但Logrank检验P>0.05,差异无统计学意义,可能与本研究纳入病人人数较少、随访时间较短导致发生终点事件的人数过少有关,有待进一步研究。
综上所述,血浆GPX4水平对于ACS的诊断、TIMI危险分层、远期预后的判断均有参考价值。为在阐明GPX4在冠心病中的作用机制,并通过靶向干预铁死亡在临床上进行ACS的防治,提供新的思路与参考依据。本研究为单中心回顾性研究,纳入的样本量较少,排除了严重的肝肾功能及心肺功能不全的病人,且随访时间较短,MACEs的发生率偏低,只是初步的经验总结,有待后续研究深入探讨。
