肾癌免疫治疗疗效评估突变预测模型的建立
2022-08-09秦彩朋宋宇轩丁梦婷林佳兴杨文博杜依青刘士军
秦彩朋,宋宇轩,丁梦婷,王 飞,林佳兴,杨文博,杜依青,李 清,刘士军,徐 涛
(北京大学人民医院泌尿外科,北京 100044)
肾癌发病率位居恶性肿瘤的第16位[1],其病理类型主要分为肾透明细胞癌和非透明细胞癌[2]。超过20%的肾癌患者存在同期远处转移,并且近30%行手术切除的患者术后出现复发转移[3-4]。既往研究结果显示肾癌存在自发消退可能[5-6],并且IL-2治疗有效[7],提示肾癌具有免疫原性。基于以上特征,使得近年来免疫检查点抑制剂(immune checkpoint inhibitors, ICI)革新了转移性肾癌的治疗。其他癌种免疫组化评估肿瘤PD-L1的表达水平可作为ICI疗效预测的生物标志物。然而,肾癌PD-L1表达情况对用药疗效的预测效果存在争议,如ChecKMate025研究数据接受ICI治疗的肾癌患者,PD-L1表达阳性与死亡与否风险并无差异[8],KEYNOTE 426和ChecKMate214研究中患者PD-L1的表达水平同OS不相关[9-10]。肿瘤突变负荷(tumor mutational burden, TMB)可反映肿瘤新抗原的水平,可预测包括膀胱癌、黑色素瘤和肺癌的ICI用药效果[11]。在肾癌中,TMB低,因此单独依靠TMB并不能有效预测肾癌患者ICI的疗效[12-13]。
基于目前肾癌缺乏有效评估ICI的手段,本研究拟对公共数据库中MSKCC泛癌免疫治疗队列肾癌患者的基因组数据进行深入分析,构建疗效评估突变预测模型,为肾癌患者接受ICI治疗提供用药参考。
1 资料与方法
1.1 数据来源
121例接受ICI治疗的肾透明细胞癌患者全外显子数据来源于MSKCC免疫治疗队列[11],从cBioPortal网站获取(http://www.cbioportal.org/), 详见表1。538例肾癌患者转录组数据来自于TCGA(the Cancer Genome Atlas Program)网站(https://portal.gdc.cancer.gov/)。
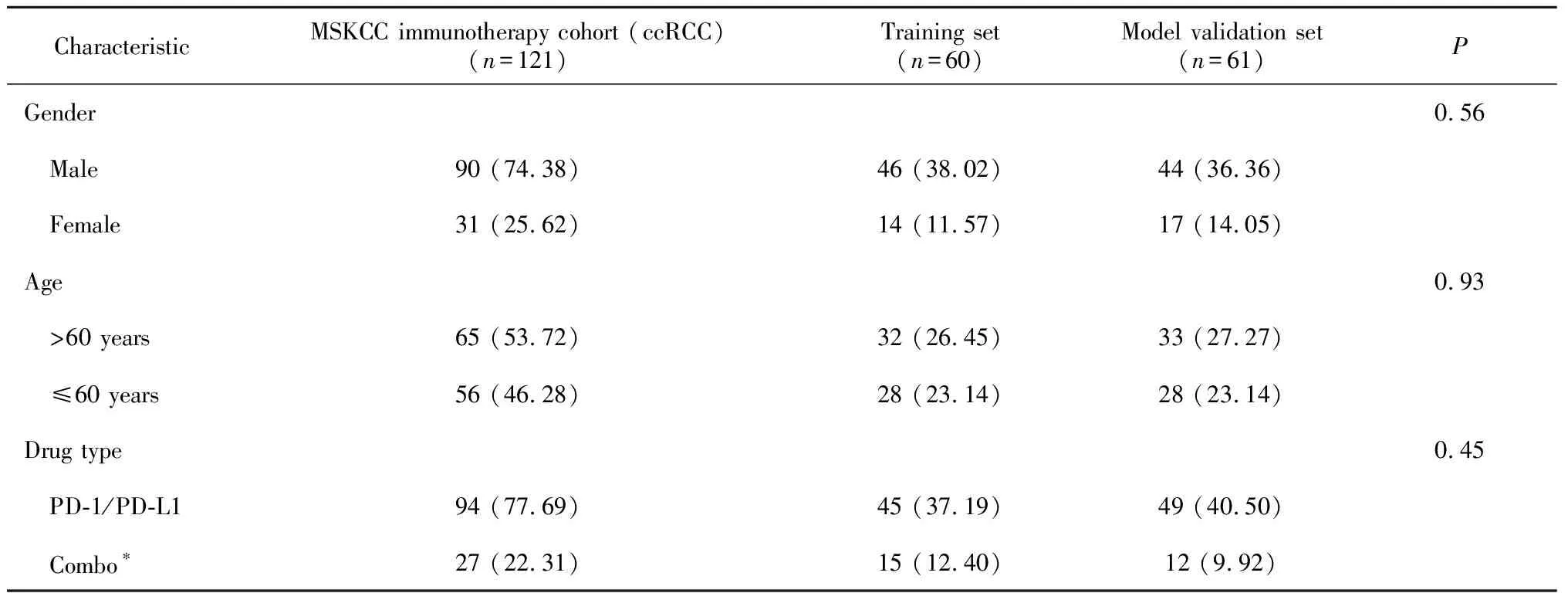
表1 纳入分析队列患者的一般特征Table 1 Clinical characteristics of the included cohorts n(%)
1.2 Cox比例风险模型分析筛选候选突变基因
选取MSKCC免疫治疗队列121例肾癌患者的基因组测序数据进行分析(随机将患者分为模型训练组n=60例和验证组n=61例), 高频突变基因(突变率> 5%)纳入Cox回归进行分析。选择多变量 Cox 回归分析中P< 0.05的基因与年龄、性别和TMB一并纳入训练组(n=60)构建疗效预测模型,构建列线图校准曲线用于内部验证,根据回归系数计算风险评分,将患者分为低风险和高风险两组。并应用验证组作为外部验证队列来验证模型,最后将两队列进行整合分析。
1.3 TCGA肾癌队列mRNA表达功能富集分析
应用于R 软件包“cluster Profiler”进行基因富集分析 (gene set enrichent analysis, GSEA), 以分析PBRM1和ARID1A野生型和突变型之间的差异表达基因富集通路(FDR<0.25认为具有统计学意义)。应用TIMER2.0对TCGA 队列538例患者的转录组数据进行细胞类型富集分析。
1.4 统计学分析
使用R(版本4.0.4)软件,包括ggplot2、rms、foreign、survival receiver operating characteristic(ROC)、survival分别用于统计和图形分析,并使用了Package Survival和Survminer用于生存分析。计量资料采用均数±标准差表示,计数资料采用频数和百分比表示。计量资料组间比较采用t检验,计数资料组间比较采用χ2检验,采用单因素和多因素Cox回归模型分析高频突变基因和肾透明细胞癌预后的关联,采用Kaplan-Meier生存分析和ROC来评估模型的预后价值,P<0.05认为差异具有统计学意义。
2. 结果
2.1 队列的临床特征
研究共纳入2个公共数据库队列,MSKCC泛癌免疫治疗队列肾癌患者基线特征见表1,接受抗PD-1/PD-L1治疗的患者94例,接受抗PD-1/PD-L1和抗CTLA4联合治疗的患者27例。TCGA数据库肾癌队列共计538例患者的转录组数据纳入功能富集分析。
2.2 筛选免疫治疗效果相关基因
应用MSKCC泛癌免疫治疗队列肾透明细胞癌患者(n=121)对ICI治疗的效果进行评估。高频突变基因(突变率>5%)纳入Cox回归进行分析。结果显示PBRM1(突变率45%)和ARID1A(突变率7%)突变与接受ICI治疗的肾癌患者的不良预后相关(图1), 提示二者可能是ICI治疗的不良疗效标志物。

图1 Cox 比例风险分析PBRM1和ARID1A突变与接受ICI治疗患者预后的相关性Figure 1 Cox proportional hazard analysis to model association of mutations in PBRM1 and ARID1A with prognosis in patients who are treated with immune checkpoint inhibitors (ICI)
2.3 肾癌免疫表型与PBRM1和ARID1A突变的相关性
为了研究PBRM1和ARID1A突变与免疫调节mRNA表达特征的相关性,本研究对TCGA 538例肾癌患者的转录组数据进行基因富集分析,发现PBRM1突变伴随着免疫相关通路的下调,包括T细胞分化(NES=-1.63,P=0.007)和免疫反应调节(NES=-1.48,P=0.009, 图2A)。同样,ARID1A突变伴随T细胞激活(NES=-1.35,P=0.008)、T细胞介导的细胞毒作用(NES=-1.69,P=0.009)和免疫效应调节通路(NES=-1.27,P=0.041)的下调(图2B)。细胞类型富集分析结果显示PBRM1突变组肿瘤微环境免疫浸润细胞较野生组未见明显变化(图3A),而ARID1A突变组CD8+T细胞水平降低(图3B)。
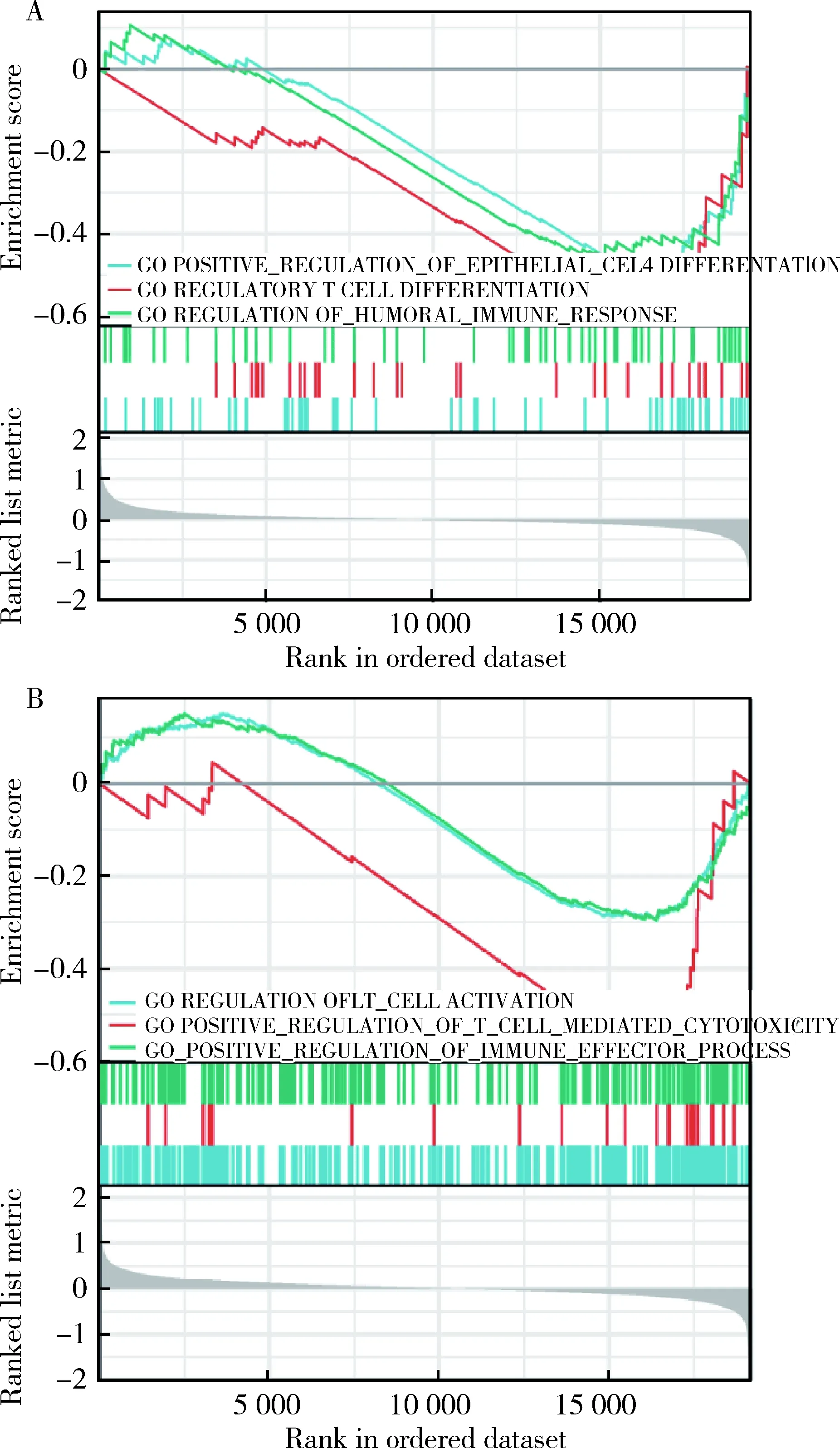
A, GSEA between the wild-type and PBRM1 mutation groups; B, GSEA between the wild-type and ARID1A mutation groups.图2 基因富集分析Figure 2 Gene set enrichment analysis (GSEA)
2.4 整合PBRM1、ARID1A突变和临床指标预测接受ICI治疗肾癌患者的预后
选择年龄、性别、治疗类型、TMB、PBRM1及ARID1A突变状态6个指标构建疗效预测模型(图4A), 列线图线性预测分数=-1.582 9+年龄分数(>60岁=1.973 98或≤60岁=0.986 99)+ 治疗类型分数(PD-1/PD-L1=0或Combo=-0.989 6)+性别分数(男性=0或女性=0.174 51)+ TMB分数(TMB×0.014 22)+PBRM1分数(突变=0.657 16或野生=0)+ARID1A分数(突变=1.598 77或野生=0)。ROC分析提示该模型具有良好的准确性(1年AUC=0.700,2年AUC=0.825,3年AUC=0.776,图4B), 生存分析结果显示低风险患者具有更好的OS(P=0.01,HR=4.33,95%CI:1.42~13.23,图4C)。应用验证组对预测模型的准确性进行外部验证,结果显示模型具有良好的外部有效性(1年AUC=0.604,2年AUC=0.709,3年AUC=0.609,图4D),生存分析结果显示低危组具有更好的OS(P=0.027,HR=2.72,95%CI:1.12~6.64,图4E)。进一步将模型训练组与模型验证组病例整合分析,ROC分析(1年AUC=0.613,2年AUC=0.687,3年AUC=0.526,图4F)发现低危组具有更好的OS(中位生存时间44个月vs.68个月,P=0.019,HR=2.20,95%CI:1.14~4.26,图4G)。
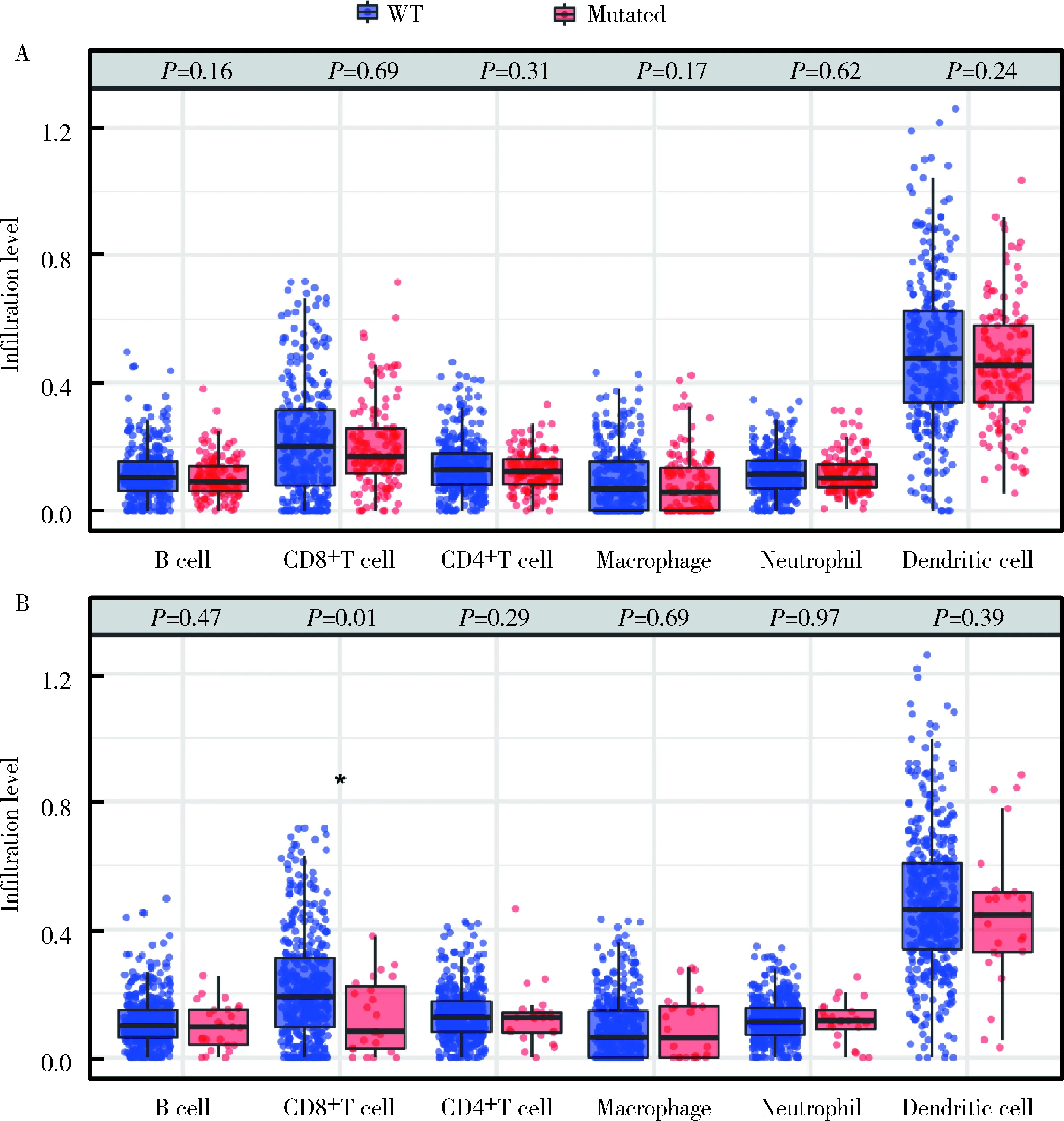
图3 肿瘤微环境免疫细胞浸润状态PPBRM1(A)和ARID1A (B)突变诱导的肿瘤免疫微环境浸润细胞的变化Figure 3 Status of immune cell infiltration induced by mutation in PPBRM1(A) and ARID1A (B)
3 讨论
本研究应用MSKCC泛癌免疫治疗队列肾透明细胞癌患者的基因组测序数据进行分析,结果显示作为SWI/SNF复合体编码基因的PBRM1和ARID1A基因突变可作为接受ICI治疗的肾癌患者用药疗效的预测因子。既往有研究结果显示存在PBRM1突变的患者对ICI用药反应良好[12,14],但是亦有报道的结论与之不同[13,15],本研究结果提示PBRM1突变患者对药物反应性较差。相关研究报道ARID1A基因突变与肾癌患者的肿瘤大小、是否转移以及预后相关[16-17],并且泛肿瘤研究结果显示ARID1A突变与ICI疗效不佳相关[18],本研究在肾透明细胞癌的免疫治疗队列中获得与前人研究一致性的结论。
在肾癌中探究基因突变与肿瘤免疫微环境之间的相关性对揭示ICI治疗的机制及其疗效评估具有重要价值。本研究应用TCGA中538例肾癌的转录组数据进行基因富集分析,结果显示存在PBRM1和ARID1A基因突变的病例免疫相关信号通路表达下调及CD8+T细胞低浸润状态,以上结果可能是PBRM1和ARID1A基因突变导致ICI疗效不佳的潜在机制。

A nomogram based on age, gender, treatment type, tumor mutation burden (TMB), PBRM1 and ARID1A mutation status in the patients with renal cell carcinoma in MSKCC immune cohort (training set, n=60) (A), receiver operating characteristic (ROC) curves for predicting overall survival (OS) using the nomogram for the cohort(B), The OS curve with the nomogram for the cohort. The risk score is calculated according to the regression coefficient. According to the risk score, the cohort is divided into low-risk and high-risk score groups for Kaplan-Meier survival analysis(C), ROC curve and OS curve (D-E) of model validation set, ROC curve and OS curve entire set (F-G). FPR, false positive rate; TPR, true positive rate.图4 构建肾癌免疫治疗疗效预后模型Figure 4 Construction of an integrated prognostic classifier model
目前肾癌患者仍缺乏有效的ICI疗效预测工具。肾癌TMB处于中低水平,中位突变负荷为 1.42 mut/mb[19],诸多研究结果显示肾癌TMB并不能单独作为ICI药物疗效的预测指标[12-13]。此外,有研究结果提出CD8+T细胞浸润状态(浸润型、豁免型和沙漠型)与ICI药物反应性的关系尚不明确[12, 20-21],提示肿瘤的内在特征可能与CD8+T细胞浸润状态存在交互影响,随后有一项研究中证实了这一假设[12],该研究结果提示PBRM1突变与低水平CD8+T细胞浸润相关,CD8+T细胞浸润状态并不能预测患者对ICI治疗的反应性,而PBRM1突变则与疗效及预后相关,结合本研究的基因富集分析结果提示肿瘤的突变特征可能是免疫浸润状态的主导因素,提示本研究在后续的疗效预测模型构建中应重点纳入突变因素。
综上所述,本研究整合了年龄、性别、TMB、治疗类型、PBRM1和ARID1A突变状态建立ICI治疗的临床预后模型。基于此构建了列线图多元 Cox 回归模型,预测模型显示3年 ROC曲线AUC=0.776,表明模型的预测精度良好。应用风险系数计算风险评分,以中位数将人群分为低危组和高危组,低危组患者的OS显著长于高危组。使用该方法在验证队列及整合队列进行验证,结果显示模型对预测肾癌患者ICI用药疗效的预测价值良好,可以帮助临床医生预测ICI的疗效,为筛选适宜ICI的肾癌患者提供新的参考。同时本模型有一定局限性,如病例数相对较少,模型稳定性尚需要大样本病例及临床实际应用过程中加以验证。
