代谢综合征与肾透明细胞癌患者预后的相关性
2022-08-09左美妮杜依青于路平
左美妮,杜依青,于路平,戴 翔,徐 涛
(北京大学人民医院泌尿外科, 北京 10044)
全球每年超过40万人罹患肾细胞癌(renal cell carcinoma,RCC), 确诊患者的平均年龄约为60岁,确诊的男性人数是女性的两倍[1]。透明细胞RCC(clear cell renal cell carcinoma,ccRCC)是RCC最常见组织学亚型,约占RCC的80%[2-3]。ccRCC预后差,尽管早期可行手术和消融治疗,仍有1/3的患者发生转移[4]。代谢综合征(metabolic syndrome,MetS)是一组代谢紊乱症候群,包括血脂异常、高血压、胰岛素抵抗以及肥胖等,是心血管疾病(cardiovascular diseases,CVD)的危险因素[5]。随着经济水平的增长,MetS的全球发病率越来越高[5]。近年,我国一项纳入31个省份130 018例患者的流行病学研究发现,20岁以上的中国居民MetS的标准患病率为31.1%;女性患病率(32.3%)较男性(30.0%)更高;75岁以上MetS的患病率最高,为44.2%;北部地区患病率(35.9%)高于南部地区(27.4%)[6-7]。MetS还与肿瘤的发生和发展有着密切关系,包括乳腺癌[8]、结直肠癌[9]、子宫内膜癌[10],以及RCC[11]等。在合并MetS的人群中,肿瘤复发率以及患者的病死率更高[12]。Bulut等[11]发现RCC患者普遍存在MetS [优势比(odds ratio,OR)=4.35,95%CI:2.62~7.21][11]。尽管RCC的病因尚未完全明确,吸烟、饮酒、肥胖以及高血压被认为是其危险因素[11]。MetS组分中的肥胖和高血压被认为是肾癌的确定病因之一[5]。然而,既往关于MetS对RCC预后的影响存在争议,研究认为MetS与RCC的不良预后相关[13-15]。Kriegmair等[15]发现,MetS是RCC患者预后的不利因素,局限性RCC合并MetS无进展生存期(progression-free survival,PFS)更短。Luzzago等[13]发现,MetS与RCC肾部分切除围手术期不良反应相关,如心血管事件、输血反应以及呼吸道并发症等。Zhang等[14]发现,MetS可导致合并慢性肾病的RCC患者术后肾功能进一步下降。然而,另有研究却认为MetS是RCC患者预后的保护因素,即合并MetS的RCC患者预后更佳[16-17]。Eskelinen等[17]发现由于患MetS的患者会更频繁的接触医生,早期发现肾癌的概率会较高,因此,合并MetS(尤其是患有高血压)的RCC患者预后较未合并MetS的患者会更好。Liu 等[16]发现,MetS与局限性ccRCC患者的CSS相关,合并MetS较未合并MetS的患者预后更好,经多因素分析认为MetS是局限性ccRCC预后的独立预测因素。本研究旨在在ccRCC手术后患者中,探讨MetS及其各组分对ccRCC预后的影响。
1 资料与方法
1.1 病例选择
选择2009年1月—2014年11月于北京大学人民医院行根治性肾切除术或部分肾切除术患者的病例资料进行回顾性分析。纳入标准:(1)经组织病理学确诊为ccRCC;(2)病史资料完整,包括术前的身高、体质量、腰围等;(3)具备术前2周内的腹部CT报告;(4)术前无明显体质量减轻(术前3个月内体质量减轻小于2.5 kg);(5)既往无肾手术史、无消融治疗史、无靶向治疗或免疫治疗史;(6)随访1年以上。
本研究开始前已经北京大学人民医院伦理委员会审查批准(批件号:2018PHB212-01)。
1.2 纳入变量
从病例资料中提取患者信息,包括年龄、性别、吸烟状况、是否有临床症状、肿瘤直径、T分期、病理分级、MetS病史、肥胖、高血压病史、糖尿病病史、甘油三酯(triglyceride,TG), 以及高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)水平。
肿瘤病理分级根据国际泌尿病理学会(International Society of Urological Pathology,ISUP)分级标准,肿瘤分期依据第7版美国癌症联合委员会TNM分期标准[18]。最初3年,所有患者每6个月随访一次,此后每年随访一次。本研究的终点为总生存期(overall survival,OS)、肿瘤特异性生存期(cancer-specific survival,CSS)以及PFS。随访时间的计算从手术日期开始,到死亡日期或末次随访就诊日期。
MetS的诊断依据国际糖尿病联合会(International Diabetes Federation,IDF)的诊断标准[19]。
1.3 统计学分析
2 结果
2.1 患者一般情况
共有342例肾癌患者纳入本研究,年龄58(49~68)岁, 其中男性227例(66.37%)、女性115例(33.63%)。吸烟者占33.04%(113/342), 29.82%的患者术前存在临床症状。肿瘤直径≤4 cm的患者占62.57%。92.98%的患者为T1~T2期肾癌,7.02%患者为T3~T4期肿瘤。低级别肿瘤占89.77%,高级别肿瘤占10.23%。患者中位随访时间为82(63~101)个月。随访期间58例(16.96%)患者出现死亡,其中40例(11.70%)患者死于肾癌。随访期间出现复发或转移的患者为59例(17.25%)。
2.2 合并与未合并MetS的肾透明细胞癌术后患者比较
在342例ccRCC术后患者中,未合并MetS组有184例(53.80%), 合并MetS者有158例(46.20%)。患者中存在腹型肥胖者为198例,高血糖患者为160例,高血压患者为219例,高甘油三酯血症患者为67例,低高密度脂蛋白血症患者为246例。两组临床基线数据对比显示,MetS组≥60岁的患者比例(53.80%)要高于non-MetS组(39.67%),两组间的差异具有统计学意义(P=0.009)。non-MetS组男性比例(79.35%)和MetS组男性比例(51.27%)均高于女性患者占比,此比例在non-MetS组要更高(P<0.001)。MetS组与non-MetS组的吸烟史、是否有临床症状、肿瘤直径、T分期以及病理分级差异均无统计学意义(P>0.05,表1)。
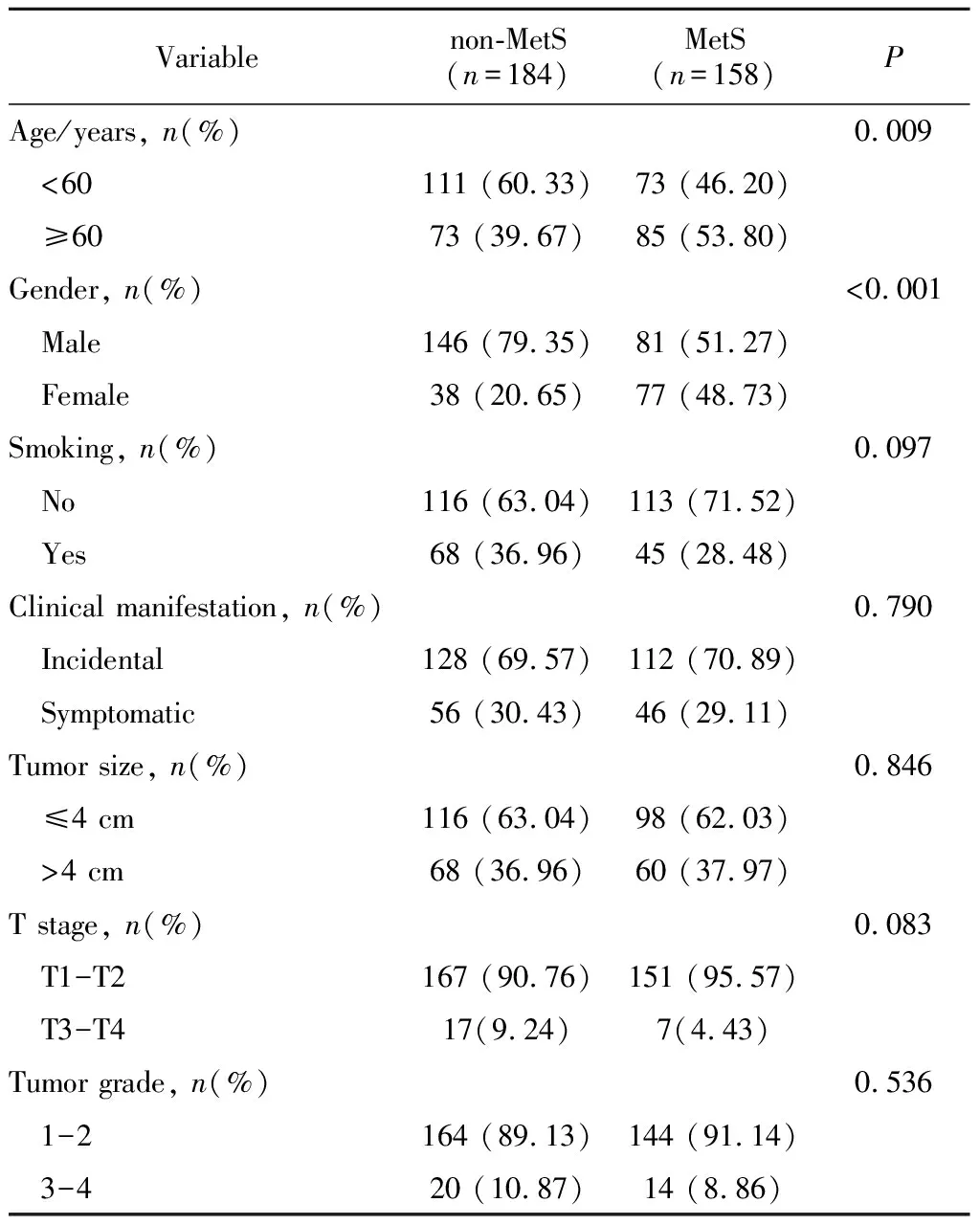
表1 肾透明细胞癌患者基础数据Table 1 Basic data for patients with clear cell renal cell carcinoma
2.3 单因素分析各临床以及病理指标与肾透明细胞癌患者术后预后的相关性
单因素Cox回归分析发现,对OS有影响的指标包括年龄(HR=1.709,95%CI:1.013~2.885,P=0.045)、性别(HR=2.075,95%CI:1.099~3.918,P=0.024)、是否有临床症状(HR=2.127,95%CI:1.267~3.571,P=0.004)、肿瘤大小(HR=2.354,95%CI:1.399~3.961,P=0.001)、病理分级(HR=2.166,95%CI1.122~4.182,P=0.021)、合并MetS(HR=0.551,95%CI:0.321~0.949,P=0.031)以及肥胖(HR=0.511,95%CI:0.304~0.859,P=0.011);对CSS有影响的指标包括是否有临床症状(HR=2.142,95%CI:1.149~3.996,P=0.017)、肿瘤大小(HR=4.055,95%CI:2.062~7.975,P<0.001)、病理分级(HR=2.780,95%CI:1.323~5.840,P=0.007)、合并MetS(HR=0.460,95%CI:0.234~0.905,P=0.025)以及肥胖(HR=0.532,95%CI:0.285~0.993,P=0.048);对PFS有影响的指标包括是否有临床症状(HR=2.307,95%CI:1.381~3.853,P=0.001)、肿瘤大小(HR=3.895,95%CI:2.255~6.730,P<0.001)、病理分级(HR=2.246,95%CI:1.166~4.326,P=0.016)以及MetS(HR=0.585,95%CI:0.343~0.998;P=0.049,表2)。
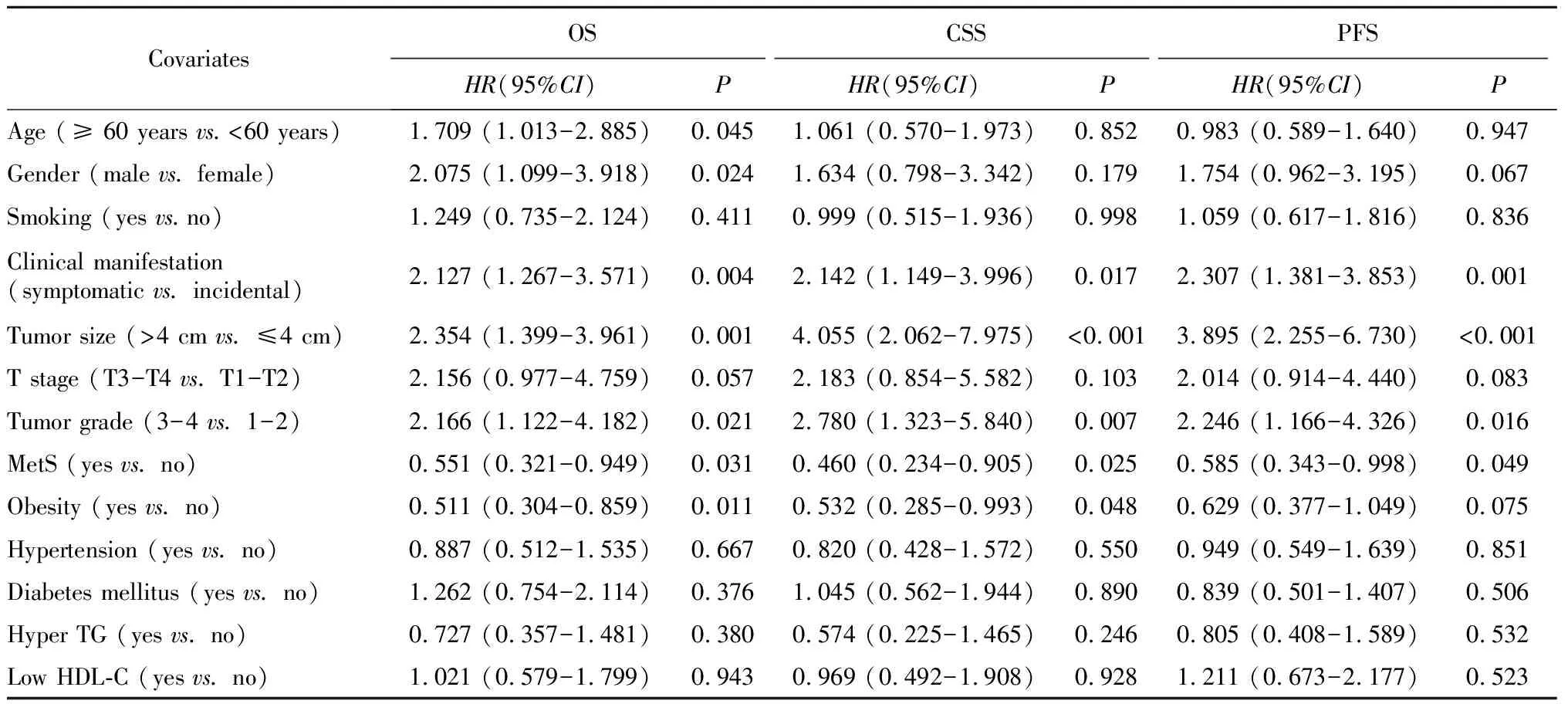
表2 预测总生存期的单因素Cox回归分析Table 2 Univariate Cox regression analyses for prediction of overall survival
Kaplan-Meier生存分析发现,合并MetS较未合并MetS的ccRCC患者术后的预后要更佳,两组OS(P=0.029)、CSS(P=0.021)以及PFS(P=0.046)均具有统计学差异(图1)。
2.4 肿瘤直径的亚组分析
进一步分析MetS和ccRCC患者术后的远期生存之间的关系发现,在肿瘤直径≤4 cm的亚组中,对OS有影响的因素包括年龄(HR=3.129,95%CI:1.306~7.494,P=0.010)和性别(HR=2.943,95%CI:1.010~8.575,P=0.048);在肿瘤直径>4 cm的亚组中,对OS有影响的因素包括MetS(HR=0.377,95%CI:0.175~0.812,P=0.013,表3)。在肿瘤直径≤4 cm的亚组中,所有纳入因素均对CSS无明显影响(P>0.05);在肿瘤直径>4 cm的亚组中,对CSS有影响的因素包括MetS(HR= 0.280,95%CI:0.113~0.690,P=0.006)和肥胖(HR=0.464,95%CI:0.219~0.981,P=0.044,表4)。
在肿瘤直径≤4 cm的亚组中,所有纳入因素均对PFS无明显相关(P>0.05);在肿瘤直径 >4 cm的亚组中,对PFS有影响的因素包括肿瘤病理分级(HR=2.115,95%CI:1.033~4.330,P=0.041)、MetS(HR=0.332,95%CI:0.157~0.659,P=0.002)和肥胖(HR=0.445,95%CI:0.238~0.833,P=0.011,表5)。
对肿瘤直径≤4 cm的亚组,合并MetS与未合并MetS的ccRCC患者术后OS(P=0.702)、CSS(P=0.833)以及PFS(P=0.339)差异均无统计学意义。而对肿瘤直径>4 cm的亚组,合并MetS组的 OS(P=0.010)、CSS(P=0.003)以及PFS(P=0.001)均显著高于未合并MetS组。上述结果表明对肿瘤直径>4 cm的亚组,合并MetS组术后远期生存要优于未合并MetS组(P>0.05,图2)。
3 讨论
基线特征:我国60岁以上MetS患者所占比例为58.1%[20],本研究该比例为53.8%,说明本研究纳入的MetS年龄层与我国人群流行病学数据基本相符。肾癌流行病学数据显示,男性发病率为女性的1.5倍[21]。本研究性别基线特征与上述流行病学数据基本相符。有研究发现,MetS与肿瘤细胞的分化相关[16]。在结肠癌和前列腺癌中,MetS与更具侵袭性的肿瘤病理类型相关,而此结论在乳腺癌中尚存在争议[16]。另有报道MetS与胃癌细胞的分化有关[16]。一项针对土耳其人群肾癌的研究显示,合并MetS与肾癌细胞的分化以及肿瘤大小显著相关[2]。本研究合并MetS组与未合并MetS组的病理级别以及肿瘤直径差异均无统计学意义,其他基线特征包括吸烟状况、是否有临床症状、肿瘤T分期,在合并MetS组与未合并MetS组间差异均无统计学意义。
MetS和肾细胞癌的相关分子机制:MetS和RCC的发生和发展密切相关,其分子机制主要包括胰岛素抵抗(insulin resistance,IR)、肥胖和炎症、脂肪因子、氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)、缺氧诱导因子(hypoxia-inducible factors,HIFs)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路[5,22]。
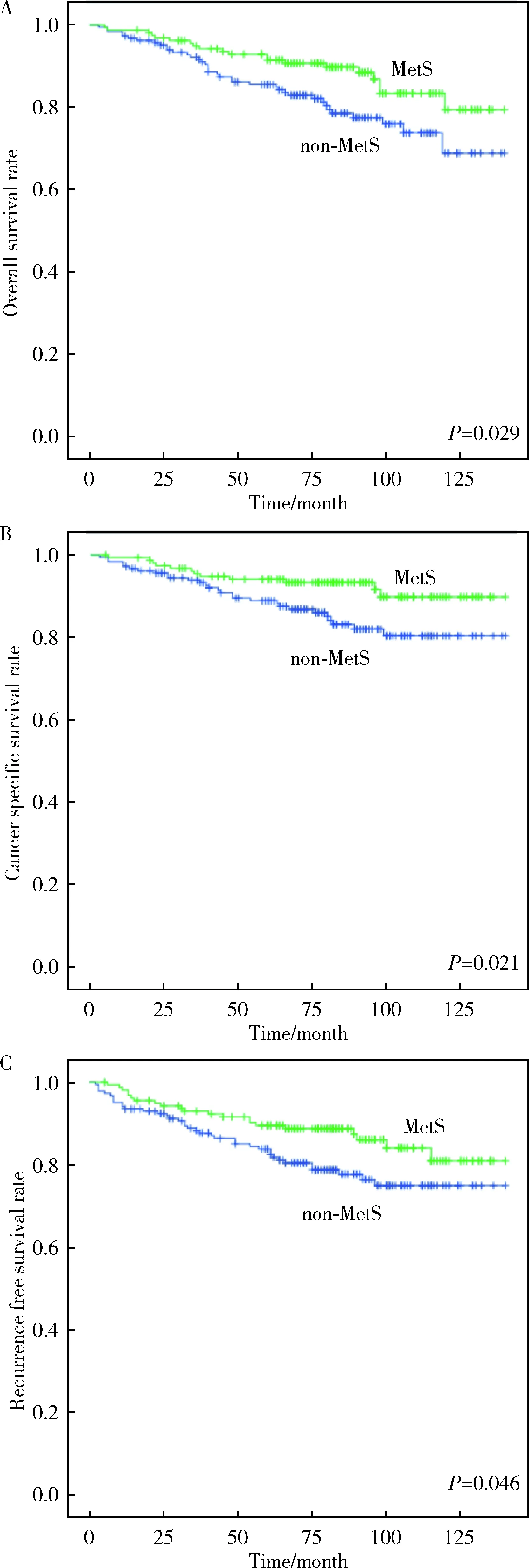
A, overall survival; B, cancer-specific survival; C, precurrence-free survival.图1 代谢综合征与RCC患者预后的相关性分析Figure 1 Correlation analysis between metabolic syndrome and prognosis of RCC patients
MetS与ccRCC术后生存:尽管MetS被公认具有促进肿瘤发生发展的作用,然而在临床实际工作中,MetS与肿瘤预后的关系较为复杂。一项对53 816名早期乳腺癌患者的回顾性研究发现,在乳腺癌确诊的10年内,肥胖对乳腺癌的局部复发无显著影响,但与远处转移相关[8]。对506例子宫内膜癌的研究发现,MetS和子宫内膜癌的预后不良相关[10]。而另一项对300例结肠癌患者的回顾性研究发现,尽管MetS是结肠癌的危险因素,但是MetS和结肠癌患者的预后无明显相关性,认为可能与患者服用的降压和降脂药物相关[23]。MetS和RCC的预后也存在争议[13-17]。本研究单变量分析发现,MetS与ccRCC术后的OS、CSS和PFS的相关性差异具有统计学意义;生存分析发现合并MetS较未合并MetS的ccRCC患者术后远期预后要更好,其原因可能和患有MetS的患者就诊的概率更高,以及可能服用具有保护性的药物(如降糖、降压以及降脂药物)相关。有研究报道,二甲双胍、血管紧张素受体阻滞剂以及他汀类降脂药物具有一定的抗肿瘤作用[9,24]。
MetS各组分与ccRCC术后生存:MetS的各组分是否和RCC预后相关一直存在争议。Eskelinen等[17]分析了13 873例芬兰RCC患者的预后和MetS组分之间的风险关联,发现高血压与RCC的生存率下降独立相关。Parker等[25]发现,肥胖患者较体重指数正常的患者更不容易患具有侵袭性特征的肿瘤类型。然而,Kriegmair等[15]报道MetS各组分均不是RCC的独立预后因素。本研究中高血压、糖尿病以及血脂异常均和ccRCC术后OS、CSS以及PFS无明显相关性。肥胖仅与ccRCC术后OS和CSS显著相关,与PFS无明显相关性。
肿瘤大小对MetS和ccRCC术后生存相关性的影响:RCC肿瘤的大小和患者预后相关,肿瘤直径≤4 cm的T3a期RCC患者的OS以及CSS可能更佳[26]。在ccRCC中,肿瘤直径被报道和转移性RCC减瘤切除术后的OS显著相关,肿瘤直径≤4 cm的患者预后更佳[27]。因此,本研究选择4 cm作为肿瘤大小的截断值,对纳入病例进一步行亚组分析。本研究对肿瘤直径≤4 cm的患者,合并MetS与未合并MetS在肿瘤直径≤4 cm亚组术后生存无明显差异;而在肿瘤直径 >4 cm的亚组,合并MetS的ccRCC患者术后OS、CSS,以及PFS均显著高于未合并MetS的患者。本研究性别和年龄在肿瘤直径≤4 cm 的亚组与OS相关;在肿瘤直径>4 cm的亚组,肥胖与术后CSS以及PFS相关,病理分级与PFS相关。
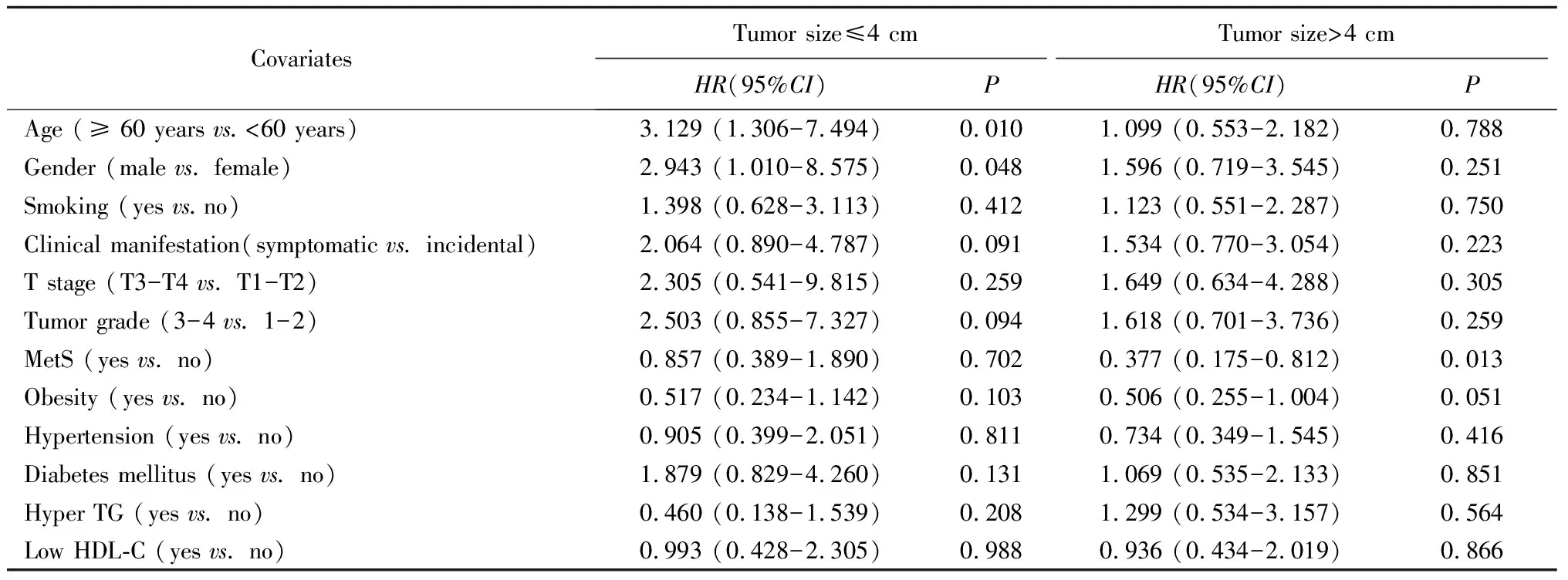
表3 不同肿瘤直径亚组分析与OSTable 3 Subgroup analysis of different tumor diameters and OS
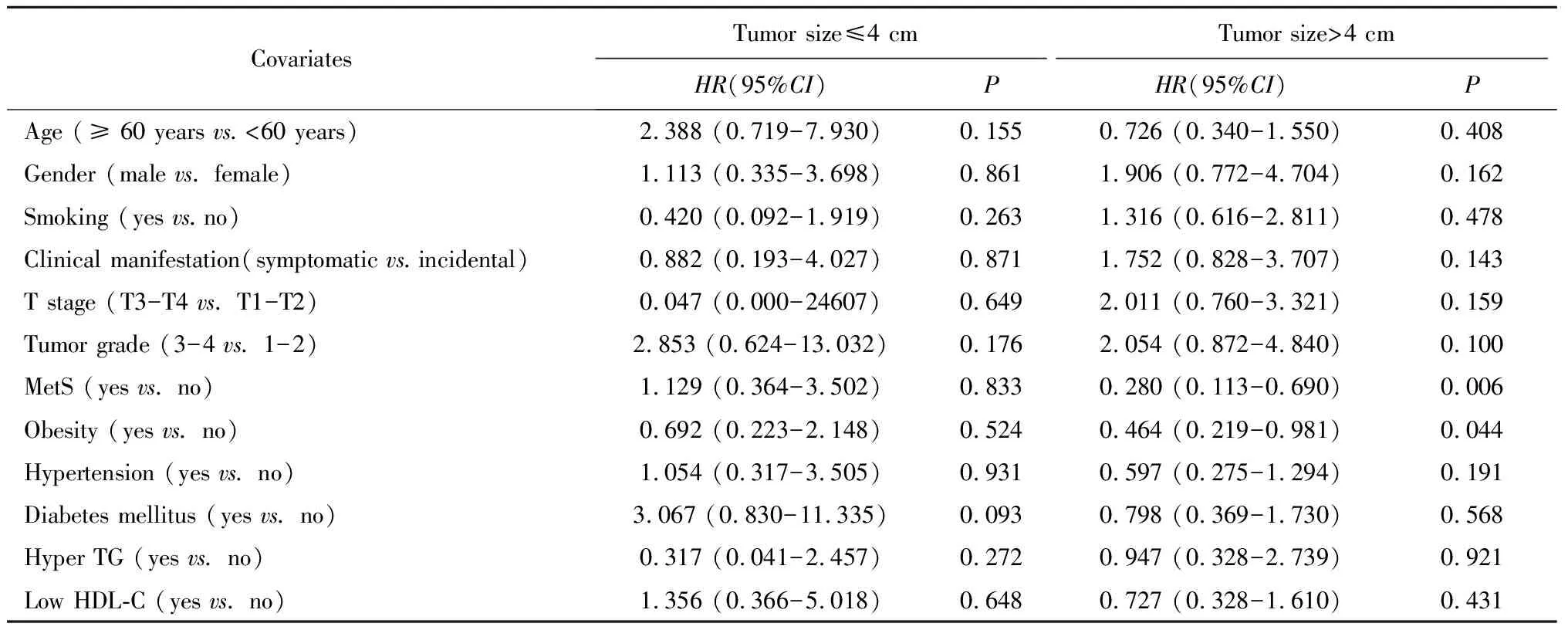
表4 不同肿瘤直径亚组分析与CSSTable 4 Subgroup analysis of different tumor diameters and CSS
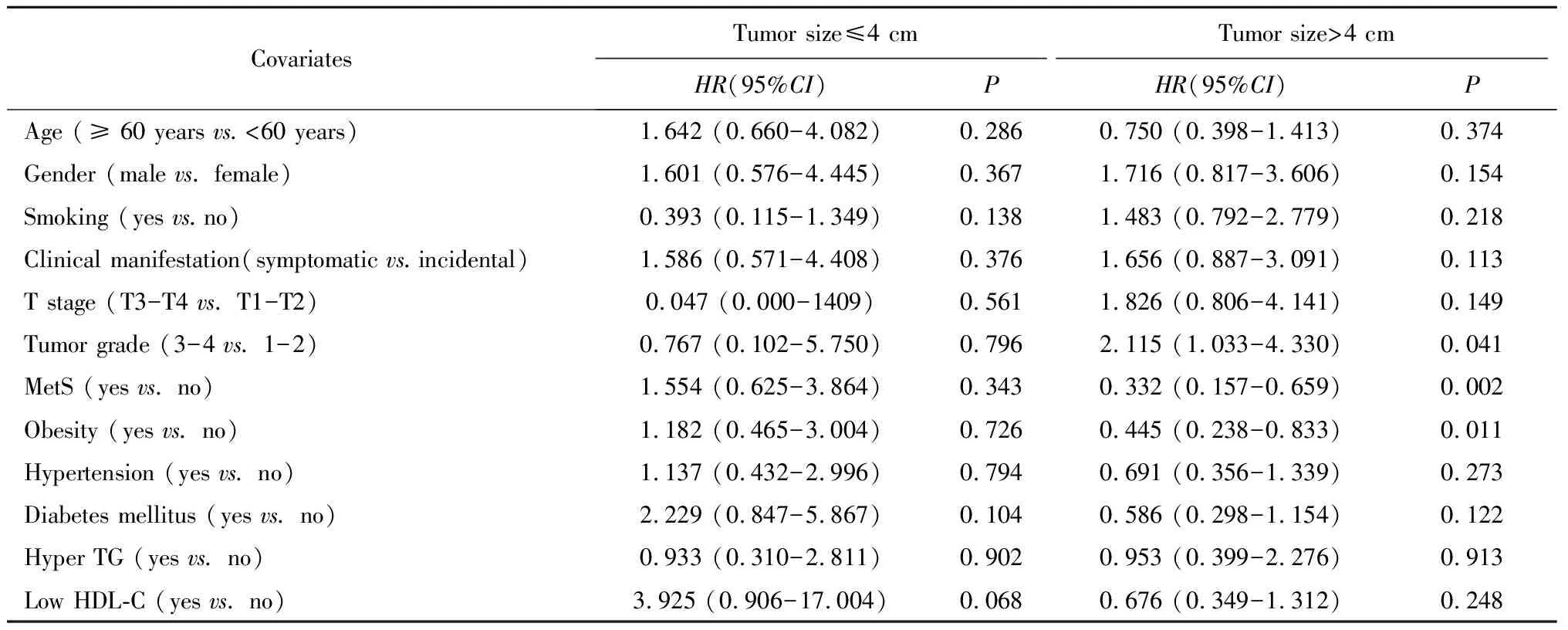
表5 不同肿瘤直径亚组分析与PFSTable 5 Subgroup analysis of different tumor diameters and PFS
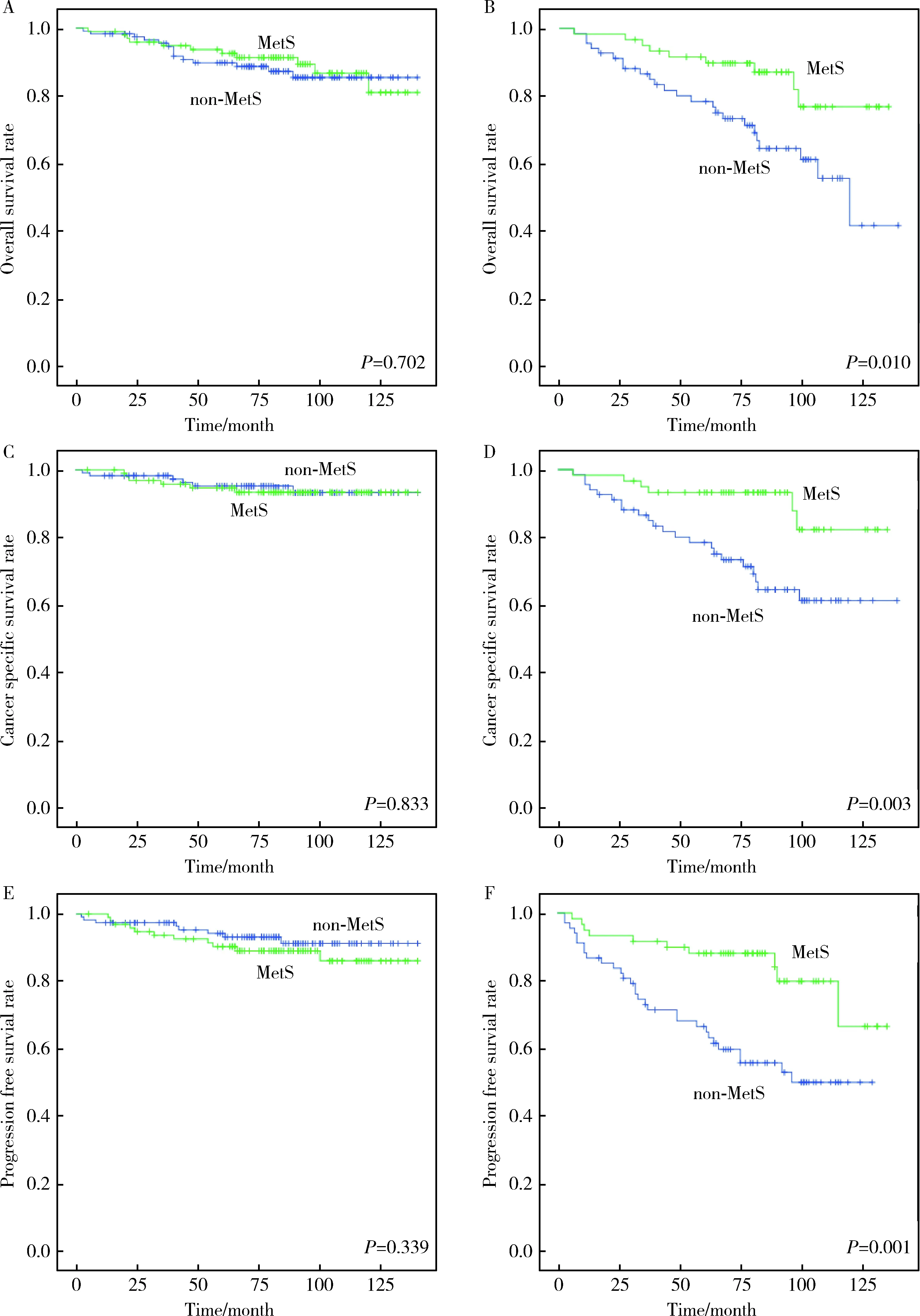
A, overall survival for tumor diameter≤4 cm; B, overall survival for tumor diameter>4 cm; C, cancer-specific survival for tumor diameter≤4 cm; D, cancer-specific survival for tumor diameter>4 cm; E, recurrence free survival for tumor diameter≤4 cm; F, precurrence-free survival for tumor diameter>4 cm.图2 不同肿瘤直径亚组中代谢综合征与RCC患者预后的相关性分析Figure 2 Correlation analysis of metabolic syndrome and prognosis of patients with RCC in different tumor diameter subgroups
本研究存在一定的局限性:首先,由于部分患者缺少详细的用药史等信息,本研究未能分析服用药物对ccRCC术后生存的影响。而MetS患者的用药可能包括具有一定抗肿瘤作用的降糖、降压以及降脂药物,因此,有待进一步的研究对患者的用药情况进行分层分析;其次,由于本研究是回顾性分析,无法完全确认因果关系,尚待进一步的研究进行验证;最后,由于数据限制,本研究未进行多因素分析,所得出的结果仍需进一步研究验证。
综上所述,MetS是ccRCC患者术后预后的保护因素,合并MetS较未合并MetS的ccRCC患者术后的远期生存更佳,二者的OS,CSS以及PFS均具有统计学差异,其原因可能与合并MetS的患者较未合并MetS患者就诊概率更高以及服用可能具有保护作用的降糖、降压、降脂等药物相关。对肿瘤直径>4 cm的亚组,合并MetS的ccRCC术后患者OS、CSS以及PFS均要高于未合并MetS者;而对肿瘤直径≤4 cm的亚组,未见上述差异;肿瘤直径>4 cm的亚组,肥胖是术后CSS以及PFS的保护因素,更高级别的病理分级是术后PFS的不利因素。
