灰飞虱VAP-B蛋白的抗体制备及体内外应用
2022-08-08秦发亮刘文文王锡锋
赵 霞, 秦发亮, 刘文文, 王锡锋
(中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193)
灰飞虱Laodelphaxstriatellus(small brown planthopper, SBPH)属于半翅目Hemiptera飞虱科Delphacidae,是一种刺吸式口器害虫,其寄主范围广泛,主要为害水稻、麦类、稗草等禾本科植物[1]。灰飞虱除了刺吸植物韧皮部汁液对作物造成直接伤害外,其作为一种重要的介体昆虫还能传播多种植物病毒,如水稻条纹病毒rice stripe tenuivirus(RSV)和黑条矮缩病毒rice black-streaked dwarf virus(RBSDV)等。在冬季,灰飞虱的若虫可取食小麦、大麦等作物及部分禾本科杂草。春季,灰飞虱将病毒传播到水稻或玉米上,导致水稻和玉米等的病毒病害大面积暴发流行,所造成的损失远大于直接刺吸为害[2]。灰飞虱以持久增殖的方式传播RSV,并且病毒还可以经卵传播给下一代。为了深入解析灰飞虱的传毒机制,本实验室前期利用RSV的核衣壳蛋白为诱饵筛选灰飞虱cDNA文库后获得了灰飞虱的囊泡相关膜蛋白相关蛋白B(vesicle-associated membrane protein-associated protein, VAP-B),抑制该蛋白的表达可显著影响灰飞虱的传毒率,可见VAP-B在灰飞虱传播RSV中起了非常关键的作用。
VAP-B是囊泡相关膜蛋白相关蛋白家族成员,这类蛋白是高度保守的内质网膜蛋白[3-6]。第一个VAP蛋白(VAP-33)是以SNARE(soluble N-ethylmaleimide-sensitive factor attachment protein receptor)家族的囊泡相关膜蛋白(vesicle-associated membrane protein,VAMP)为诱饵,通过酵母双杂交试验在加州海兔Aplysiacalifornica中筛选到的,注射对VAP-33有特异性的抗体会抑制加州海兔的突触传递,这表明VAP-33是神经递质胞吐作用所必需的[7]。随后又在哺乳动物体内发现了VAP-A、VAP-B和VAP-C。VAP-A与VAP-B有较高的序列同源性(63%),且由3个保守的结构域组成:N端的精子主蛋白(major sperm protein, MSP),中间的卷曲螺旋结构域(coiled-coil domain, CCD)和C端的跨膜结构域(transmembrane domain, TMD)[8]。VAP类蛋白除主要在内质网上分布外,在高尔基体和细胞膜等细胞器上也有发现,并可以通过与其他蛋白互作来参与膜转运[9]、脂质的转运和代谢[10-12],以及未折叠蛋白的反应等[13-14]。目前与VAP互作的蛋白主要分为3大类:一类是SNARE家族蛋白,相关研究发现SNARE家族蛋白Rbet1和Rsec22可以与VAP-A互作,参与膜融合过程[15-16]。第二类是含有FFAT(double phenylalanine in an acidic tract)基序的蛋白,这类蛋白包含一段EFFDAxE蛋白序列。最早发现具有这一结构的磷脂生物合成转录调节因子Opi1p蛋白可以与酵母体内的VAP同源物Scs2p互作[17],随后又发现脂质结合蛋白、脂质转运蛋白等通过FFAT基序与VAP互作后参与到内质网的运输[18-20]。第三类是病毒蛋白,相关研究表明丙型肝炎病毒的非结构蛋白NS5A和NS5B通过与VAP的互作,参与了该病毒的复制过程[21-22]。番茄黄化曲叶病毒tomato yellow leaf curl virus(TYLCV)的衣壳蛋白通过与介体烟粉虱肠道内的VAP-B互作,参与了烟粉虱对TYLCV的传播[23]。可见,VAP在生物体内具有非常重要的作用。
鉴于VAP-B在真核生物体内的保守性和重要作用,本研究克隆了灰飞虱编码VAP-B的基因,优化条件利用原核系统成功表达了可溶蛋白,并将蛋白纯化后免疫新西兰雄兔制备了多克隆抗体,该抗体可以成功应用到灰飞虱VAP-B的Western blot和免疫荧光检测,为研究VAP-B在灰飞虱体内的功能奠定了基础。
1 材料与方法
1.1 材料
1.1.1灰飞虱
灰飞虱为本实验室长期保存种群,饲养于光照培养箱中(L∥D=14 h∥10 h,25~27℃),水稻品种为‘黄金晴’,7 d更换1次水稻苗。
1.1.2载体和菌株
pEASY-T5载体及大肠杆菌EscherichiacoliTrans1-T1、Rosetta(DE3)购自全式金生物公司;蛋白提取试剂盒购自生工生物工程(上海)股份有限公司;表达载体pCOLD-SUMO购自北京庄盟国际生物基因科技有限公司。
1.1.3试剂
TRIzol购自南京诺唯赞公司;反转录试剂购自美国Promega公司;rTaq酶购自TaKaRa公司;胶回收试剂盒和质粒小提试剂盒购自天漠生物公司;限制酶和T4连接酶购自NEB公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1引物设计
本实验室前期获得的VAP-B蛋白基因全长750 bp,根据该序列设计一对含酶切位点的引物,上游引物酶切位点选择SacI,上游引物SacI-VAP-B-F: 5′-CGACCTCGATGGCGAATAAACAAGAACA-3′;下游引物酶切位点选择XbaI,下游引物XbaI-VAP-B: 5′-GCTCTAGAGCTCAGAGCATGTACTTGCCC-3′。
1.2.2目的基因克隆
TRIzol法提取灰飞虱总RNA,然后将RNA反转录成cDNA。以该cDNA为模板,利用含酶切位点的引物通过rTaq酶扩增VAP-B基因,1%琼脂糖凝胶电泳检测,并将扩增的片段进行胶回收纯化。将纯化的VAP-B基因片段连接到pEASY-T5载体上,转化大肠杆菌感受态细胞Trans1-T1,挑取单克隆,送华大公司进行测序验证。
1.2.3原核表达载体的构建
以测序正确的pEASY-T5-VAP-B载体为模板,利用含酶切位点的引物进行片段扩增后再通过胶回收进行纯化,纯化后的PCR产物和pCOLD-SUMO质粒利用SacI和XbaI进行双酶切,条件为37℃,4 h,然后再利用T4 DNA连接酶4℃连接过夜,转化大肠杆菌感受态细胞Trans1-T1,挑取单克隆后提取质粒,将质粒直接转入表达菌株Rosetta (DE3)感受态中,同时转化pCOLD-SUMO空质粒作为对照。
1.2.4蛋白VAP-B的原核诱导表达
突出监管和服务“两个重点”。昆明市局制定 60多项规范执法制度,获证企业年度监督检查覆盖面达100%,2013年以来查处“四品一械”违法案件8396宗,罚没3441万元。此外,还开展了一系列专项整治行动,在全国较早出台《餐厨废弃物处置办法》,禁止餐饮服务单位使用散装油,实施米线“禁裸令”,形成“昆明经验”。2013年以来办理行政许可近万件,审批时限压缩50%~70%,实现零超时、零投诉、零复议。全力服务产业发展,辖区内两家连锁药店成为全国十强。
挑取含有pCOLD-SUMO-VAP-B的Rosetta (DE3)单克隆,置于1 mL含有50 μg/mL氨苄青霉素的LB液体培养基中,37℃,200 r/min培养过夜。取200 μL菌液于50 mL LB培养基中,37℃,200 r/min振荡培养使其OD600达到0.6~0.9,然后加终浓度为0.1 mmol/L的IPTG,16℃,180 r/min培养过夜。另取200 μL的菌液完成上述操作,但不利用IPTG进行诱导,16℃,180 r/min培养过夜。同理,取一个含有pCOLD-SUMO空质粒的Rosetta (DE3)单克隆进行上述处理。然后,分别取1 mL上述菌液,12 000 r/min离心弃上清, 400 μL PBS重悬菌液后加5×loading buffer煮沸10 min,12 000 r/min离心后取上清经SDS-PAGE凝胶电泳和考马斯亮蓝染色分析蛋白的表达情况。剩余的经IPTG处理的含有pCOLD-SUMO-VAP-B的Rosetta (DE3)菌液收集菌体后重悬于20 mL PBS缓冲液中,超声破碎(破碎5 s,暂停5 s,破碎10 min)后12 000 r/min离心20 min将上清与沉淀分离。
1.2.5VAP-B的纯化和标签的去除
利用Ni2+-NTA亲和层析柱进行蛋白纯化,先将1.2.4获得的上清液过柱,然后依次利用20 mL PBS、20 mL含40 mmol/L咪唑的PBS、20 mL含80 mmol/L咪唑的PBS洗去杂蛋白,最后利用10 mL含600 mmol/L咪唑的PBS洗脱蛋白。洗脱后的蛋白利用rTEV酶处理去除SUMO标签,得到纯化的无标签的VAP-B蛋白。
1.2.6抗血清的制备及检测
选择月龄3个月的新西兰雄兔进行多克隆抗体的制备。初次免疫采用皮下多点注射法,为更好地刺激其免疫反应,利用弗氏完全佐剂将纯化的VAP-B蛋白乳化。第11天采用大腿肌肉注射法再次进行免疫,采用弗氏不完全佐剂乳化纯化的VAP-B蛋白。以后每周再免疫1次。每次免疫后的第5天取少量血分离血清,利用间接ELISA测定抗体的效价,当效价达到1∶100 000时,利用股动脉采血法采血并收集血清。最后采用protein A-Sepharose affinity column从血清中纯化抗VAP-B的IgG。
1.2.7Western blot进行抗体特异性分析
提取灰飞虱总蛋白和纯化的VAP-B蛋白,利用4%~20%的SDS-PAGE胶进行凝胶电泳,然后将蛋白转移到硝酸纤维素膜上,利用含5%奶粉的TBST缓冲液常温封闭2 h后洗膜3次,每次10 min;然后按照1∶500的比例将VAP-B抗体溶于5%奶粉中,将封闭后的硝酸纤维素膜置于其中,37℃孵育2 h,然后用TBST洗膜3次,每次10 min;再按照1∶2 000的比例孵育二抗(二抗为山羊抗兔IgG),1 h后洗膜,洗3次,每次10 min。最后将其置于发光成像分析仪(LAS-4000mini)中进行显色。
显微镜下解剖出灰飞虱的唾液腺,用4%的多聚甲醛固定2 h后用0.01 mol/L PBS缓冲液清洗3次,每次10 min;于2% Triton-100中室温渗透30 min,PBS中清洗3次,每次10 min;用抗体稀释液(含有3%牛血清白蛋白的PBS)按照1∶50的比例稀释一抗anti-VAP-B-IgG。用稀释后的一抗37℃孵育2 h,PBS中清洗3次,每次10 min;然后再用稀释后的二抗 anti-rabbit IgG-Cy3(1∶200)孵育 2 h,PBS 中清洗 3 次;最后将唾液腺固定在载玻片上,利用激光共聚焦扫描显微镜进行观察。
2 结果与分析
2.1 SBPH VAP-B蛋白的诱导表达
PCR获得VAP-B基因片段,长度为750 bp,胶回收纯化后连接到pEASY-T5载体上。
以测序正确的pEASY-T5-VAP-B载体为模板,构建原核表达载体pCOLD-SUMO-VAP-B。并转入大肠杆菌表达菌株Rosetta (DE3)感受态中,同时转化pCOLD-SUMO空载体作为对照。IPTG诱导表达后,经SDS-PAGE凝胶电泳和考马斯亮蓝染色发现,与对照相比,经过IPTG诱导表达的含有pCOLD-SUMO-VAP-B载体的菌液能够表达出VAP-B的可溶性蛋白,该融合蛋白大小约51 kDa(图1)。

图1 VAP-B原核表达产物的SDS-PAGE分析Fig.1 SDS-PAGE analysis of expressed VAP-B in Escherichia coli Rosetta (DE3) after induced by IPTG
2.2 可溶性VAP-B蛋白的纯化
将含pCOLD-SVMD-VAP-B的Rosetta (DE3)接种到含有氨苄青霉素的LB液体培养基中大量表达VAP-B蛋白,超声破碎后的上清过Ni2+-NTA亲和层析柱进行蛋白纯化,先利用PBS和低浓度咪唑洗去杂蛋白,然后利用600 mmol/L的高浓度咪唑将目的蛋白洗脱下来(图2)。再将连接在目的蛋白上的SUMO 标签去除,最后得到VAP-B无标签蛋白,该蛋白大小为30 kDa左右(图3)。

图2 VAP-B原核表达产物的纯化分析Fig.2 Purification analysis of products of VAP-B in Escherichia coli

图3 切割SUMO标签后的VAP-B蛋白Fig.3 VAP-B protein after cleaving SUMO tag
2.3 抗血清制备及特异性检验
将纯化的VAP-B蛋白作为抗原,皮下多点免疫新西兰雄兔,进行抗体的制备,再利用Western blot分析抗血清的特异性。提取灰飞虱的总蛋白和纯化的VAP-B蛋白进行Western blot 检测。结果显示,多克隆抗血清与灰飞虱总蛋白和纯化的VAP-B蛋白有特异反应(图4)。
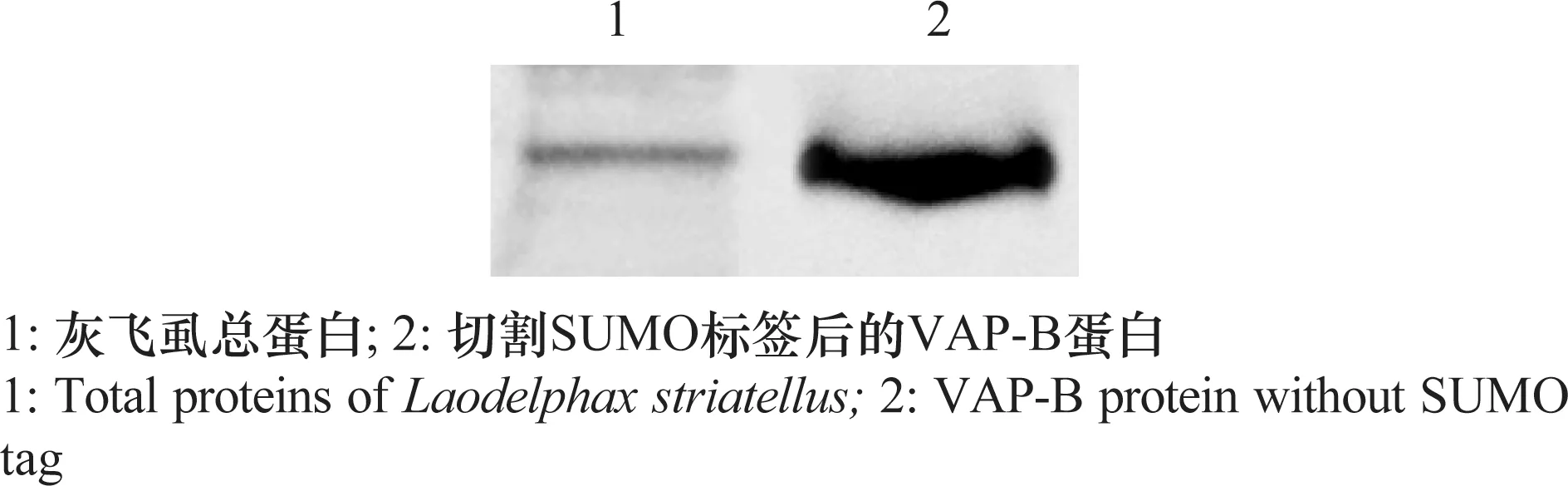
图4 VAP-B多克隆抗体的Western blot分析Fig.4 Western blot analysis of VAP-B polyclonal antibody
2.4 VAP-B抗体在灰飞虱体内标记检测
解剖灰飞虱的唾液腺,利用免疫荧光法对其进行VAP-B的标记,红色为利用Cy3标记的唾液腺中的VAP-B,蓝色为利用DAPI标记的细胞核。在本研究中,通过激光共聚焦显微镜检测,发现利用红色荧光标记的VAP-B抗体可以在灰飞虱唾液腺的不同腺泡内定位到该蛋白,对唾液腺进行细胞核染色后发现VAP-B蛋白主要分布在各个细胞的细胞质内(图5)。因此制备的抗体能够特异性的标记灰飞虱VAP-B,说明该抗体能够用于免疫荧光分析,可对灰飞虱组织内表达的VAP-B进行定位。
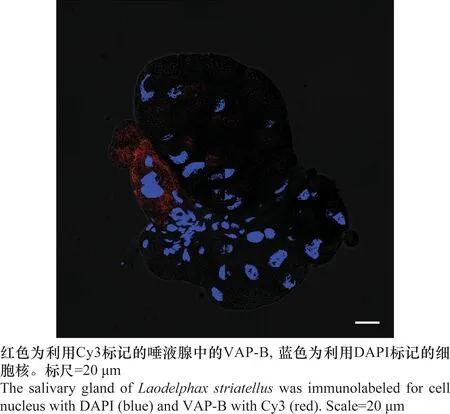
图5 灰飞虱唾液腺VAP-B蛋白定位检测Fig.5 Distribution of VAP-B in the salivary gland of Laodelphax striatellus by immunofluorescence
3 结论与讨论
抗体制备需要获得纯度较高的可溶性蛋白。原核表达系统尤其是大肠杆菌表达系统具有遗传背景清楚、生长繁殖快速、成本低廉、外源基因产物水平高等特点[24],因此是最经典的、应用最广泛的蛋白表达系统[25]。尽管大肠杆菌在表达膜蛋白的过程中可能会存在丰度低、对细胞有毒性的问题[26],但是经过添加融合标签(如:GST、MBP、SUMO等)、密码子优化、筛选表达宿主等手段,依然有约50%的膜蛋白能在大肠杆菌中成功表达[27-28]。VAP-B是一个膜蛋白,含有一个跨膜区[29],在本研究中,我们利用大肠杆菌表达系统,通过添加融合标签的方法克服膜蛋白的疏水性,以降低对细胞的伤害。SUMO作为N端载体蛋白可以促进折叠和结构稳定性,与其余融合标签相比,提高了蛋白质的可溶性[30]。在纯化蛋白的过程中,虽然SUMO标签不像GST和MBP标签一样有自己的纯化方式,但是其可以通过与6×His标签连接,经过Ni2+-NTA进行纯化,获得高纯度的可溶性蛋白。本研究构建了原核表达载体pCold-SUMO-VAP-B,使用该载体表达的VAP-B蛋白上融合了SUMO标签和His标签,His标签使得该蛋白可直接通过Ni2+-NTA纯化出来,从而获得重组的VAP-B可溶性蛋白。此外,融合蛋白由于含有SUMO标签,可能会存在一定的免疫原性,因此需要将SUMO标签去除。本研究中SUMO标签与目的蛋白之间含有Glu-Asn-Leu-Tyr-Phe-Gln-Gly 7个氨基酸的序列,该序列可以被rTEV酶特异性地识别,从而特异性切割SUMO标签,使得制备的VAP-B抗体完全不受标签的影响,增强了抗体的特异性。
本研究获得的VAP-B抗体不仅能够用于体外表达纯化的VAP-B和灰飞虱VAP-B的Western blot检测,也可以用于灰飞虱体内组织VAP-B的免疫标记。免疫标记技术的基础是抗原与抗体之间的特异性反应,同时结合标记技术用以检测抗原或者抗体,该技术可以在细胞、亚细胞、超微结构及分子水平上对被检测蛋白进行定性和定量检测。研究表明,囊泡相关膜蛋白相关蛋白在所有真核细胞中都有表达,且在细胞内参与了许多细胞过程的调节。灰飞虱是RSV的传毒介体昆虫,RSV需要跨越灰飞虱中肠屏障、中肠释放屏障与唾液腺侵入屏障、唾液腺释放屏障才能完成水平传播[31]。在这一过程中,RSV需要通过与介体灰飞虱蛋白的互作完成自身的侵入,运动,复制和扩散等。实验室前期研究发现,RSV的核衣壳蛋白能够与介体灰飞虱的VAP-B互作,且VAP-B的mRNA水平在灰飞虱唾液腺中含量最高,本研究制备的抗体可以特异性的在唾液腺内标记到VAP-B,这为后期阐明VAP-B在传毒过程中的关键作用奠定了重要的基础。
