淡紫褐链霉菌NBF715防控黄瓜猝倒病及其机制的初步研究
2022-08-08黄大野姚经武郑娇莉王蓓蓓曹春霞
黄大野, 姚经武, 郑娇莉, 王蓓蓓, 李 飞, 杨 丹, 曹春霞
(湖北省生物农药工程研究中心, 国家生物农药工程技术研究中心, 武汉 430064)
黄瓜CucumissativusL.是我国主要的蔬菜品种,种植面积居世界第一位[1-2]。由卵菌中瓜果腐霉Pythiumaphanidermatum引起的黄瓜猝倒病是黄瓜苗期的主要病害,该病害在苗床育苗和移栽期间均能发生,可侵染种子、根或下胚轴引起种子或者幼苗死亡[3-4]。目前生产上缺少抗性品种,化学防治仍然是防控黄瓜猝倒病的主要手段,然而,连续使用同一种杀菌剂容易引起病原菌的抗药性[5]。同时,化学杀菌剂的使用也会造成环境污染和农药残留,所以生产上需要更为安全有效的防治方法。
生物防治由于无农药残留和对环境友好,近年来在土传病害防控上得到了广泛的应用[6-7]。Al-Hussini等[8]从番茄根际分离的蜡样芽胞杆菌Bacilluscereus和菊微小杆菌Exiguobacteriumindicum联合使用使番茄猝倒病发病率降低了27%。Halo等[9]从沙漠植物上分离的内生菌Talaromycesvariabilis在盆栽试验条件下能使接种瓜果腐霉的番茄和黄瓜存活率分别增加33.92%和44.64%。Zouari等[10]报道解淀粉芽胞杆菌B.amyloliquefaciens能有效防控番茄猝倒病的发生。淡紫褐链霉菌StreptomycesenissocaesilisNBF715是由湖北省生物农药工程研究中心从湖北省恩施州鹤峰县土壤中分离和筛选出的一株链霉菌(CCTCC保藏号: M2017414),前期研究表明,其对多种作物病害具有良好的抑菌活性。本研究通过链霉菌NBF715防控黄瓜猝倒病研究,为该菌的进一步应用提供基础。
1 材料与方法
1.1 试验材料
供试菌株:瓜果腐霉、多主棒孢Corynesporacassiicola、尖孢镰刀菌Fusariumoxysporum、胶孢炭疽菌Colletotrichumgloeosporioides、立枯丝核菌Rhizoctoniasolani、茄链格孢Alternariasolani、茶拟盘多毛孢Pestalotiopsistheae由湖北省生物农药工程研究中心分离和保存,用于抑菌谱的测定。淡紫褐链霉菌NBF715由本中心分离并保存于中国典型培养物保藏中心(CCTCC),菌种专利保藏号为: M2017414。
供试药剂:250 g/L吡唑醚菌酯乳油(EC),巴斯夫植物保护江苏有限公司。
供试培养基:1)酪蛋白培养基:蛋白胨10 g,葡萄糖1 g,酪蛋白5 g,L-酪氨酸0.1 g,琼脂15 g,蒸馏水1 L,pH 7.4;2)铬天青CAS培养基:铬天青S 0.605 g,十六烷基三甲基溴化铵 0.729 g,FeCl·6H2O 2.645 mg,蛋白胨4.5 g,葡萄糖9 g,牛肉浸出粉2.7 g,NaCl 4.5 g,琼脂20 g,蒸馏水1 L,pH 7;3)几丁质培养基:NH4H2PO41 g, KCl0.2 g,MgSO4·7H2O 0.2 g,1%胶体状几丁质(m/V)100 mL,琼脂20 g,蒸馏水1 L,pH 7;4)羧甲基纤维素钠(CMC)培养基:NaNO32 g,KH2PO41 g,KCl 0.5 g,MgSO40.5 g,FeSO40.01 g,CMC-Na 10 g,蒸馏水1 L;5)淀粉培养基:可溶性淀粉10 g,蛋白胨5 g,NaCl 3 g,牛肉浸膏3 g,琼脂15 g,蒸馏水1 L,pH 7;6)茯苓粉培养基:茯苓粉4 g,KH2PO46.8 g,Na2HPO417.9 g,酵母提取物6.7 g,苯胺蓝0.06 g,琼脂12 g,蒸馏水1 L,pH 6.8;7)高氏1号培养基:可溶性淀粉10 g,NaCl 0.5 g,K2HPO4·3H2O 0.5 g,KNO31 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,琼脂20 g,蒸馏水1 L,pH 7.4;8)ISP2培养基:酵母提取物 4 g,麦芽提取物 10 g,葡萄糖 4 g,琼脂 15 g,蒸馏水 1 L,pH 7.3。
黄瓜购自种子店,品种为‘帅兔’。
1.2 试验方法
1.2.1NBF715菌株抑菌谱测定
NBF715菌株和植物病原菌分别在ISP2和PDA平板上活化备用。用直径4 mm打孔器打取NBF715菌饼,置于平板中央两侧,距离中心约30 mm,48 h后打取病原菌菌饼置于平板中央,以不加链霉菌NBF715作为对照,待对照菌落长满培养皿后测量菌落直径,并计算抑菌率。
抑菌率=[(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)]×100%。
1.2.2NBF715对瓜果腐霉菌丝形态影响
从对峙培养的平板中抑菌带边缘和对照菌落边缘挑取菌丝,在光学显微镜和扫描电镜下观察菌丝形态并拍照,扫描电镜菌丝处理参考Li等的方法[11]。
1.2.3水解酶和产嗜铁素活性测定1.2.3.1产嗜铁素活性测定
使用打孔器打取NBF715菌饼接种于CAS培养基平板,28℃培养箱黑暗培养7 d后观察是否产生黄色晕圈[12]。
1.2.3.2水解酶活性测定
菌株分别接种于几丁质、酪蛋白、CMC、淀粉和茯苓粉培养基平板,28℃培养箱黑暗培养7 d后观察是否产透明圈[12-13]。其中酪蛋白平板需在培养后加入10%三氯乙酸。CMC平板需加入1 g/L 刚果红,染色1 h后倒掉染液,再用1 mol/L NaCl溶液浸泡1 h。淀粉平板需加入2.5%卢氏碘液,浸泡15 min 后倒掉,用无菌水冲洗。
1.2.4NBF715发酵液对瓜果腐霉抑菌活性和对黄瓜猝倒病的防效
将NBF715菌株孢子从斜面培养基划线至高氏1号平板,28℃培养箱黑暗培养7 d后用4 mm打孔器打取菌饼至100 mL ISP2液体培养基,180 r/min,28℃振荡培养5 d作为种子液,随后按5%体积接入100 mL ISP2液体培养基,180 r/min,28℃振荡培养7 d备用。将发酵液10 000 r/min离心15 min,取上清液用 0.22 μm滤膜过滤除菌得到无菌发酵液。采用菌丝生长速率法测定无菌发酵液对瓜果腐霉的抑菌活性。无菌滤液分别稀释10、25、50倍和100倍,再与PDA以1∶9(V/V)混合,以加入相同体积无菌培养基作为对照,每处理3个重复。28℃黑暗培养至对照长满平板,测量对照和处理的瓜果腐霉菌落直径,并计算抑菌率。
将瓜果腐霉在PDA平板上30℃黑暗培养3 d,用无菌手术刀切取边长15 mm的三角形菌丝块作为接种的病原物,菌丝面朝上置于育苗基质(草炭∶蛭石∶珍珠岩=3∶1∶1,体积比)表面。育苗基质装载量为距离穴盘表面2 cm处。黄瓜种子用1%次氯酸钠浸泡2 min消毒,随后用无菌水冲洗3次,置于湿润纱布中30℃催芽,随后将黄瓜种子浸于发酵液原液和5倍稀释液中30 min,对照药剂为有效成分1 000 μg/mL吡唑醚菌酯,空白对照为无菌水。将各处理种子置于菌丝块上,随后覆上育苗基质,每处理3个重复,每个重复72粒种子。28℃光照培养10 d,统计出苗数并计算发病率和防效[14]。
发病率=(播种种子数量-正常苗数量)/播种种子数×100%;
防治效果=(对照发病率-处理发病率)/对照发病率×100%。
1.3 数据分析
试验数据使用SPSS 13.0软件进行统计学分析,采用 LSD 多重比较法进行差异显著性检验。
2 结果与分析
2.1 NBF715菌株抑菌谱
在供试的几种病原菌中,NBF715菌株对瓜果腐霉抑菌活性最好,对峙培养2 d后出现明显的抑菌带(图1),抑菌率达到55.6%(表1),对立枯丝核菌、茶拟盘多毛孢、多主棒孢、茄链格孢、胶孢炭疽菌和尖孢镰刀菌也具不同程度的抑菌活性。

图1 NBF715菌株与瓜果腐霉对峙培养Fig.1 Confrontation culture between NBF715 strain and Pythium aphanidermatum

表1 NBF715菌株对植物病原菌离体抑菌效果1)Table 1 Inhibition effect of NBF715 strain on plant pathogens in vitro
2.2 NBF715菌株对瓜果腐霉菌丝形态的影响
在光学显微镜下观察,与对照菌丝相比,经对峙处理的瓜果腐霉菌落边缘菌丝出现明显的扭曲、膨胀变形和消解(图2)。在扫描电镜下观察,处理菌丝出现扭曲和破裂的情况(图3)。
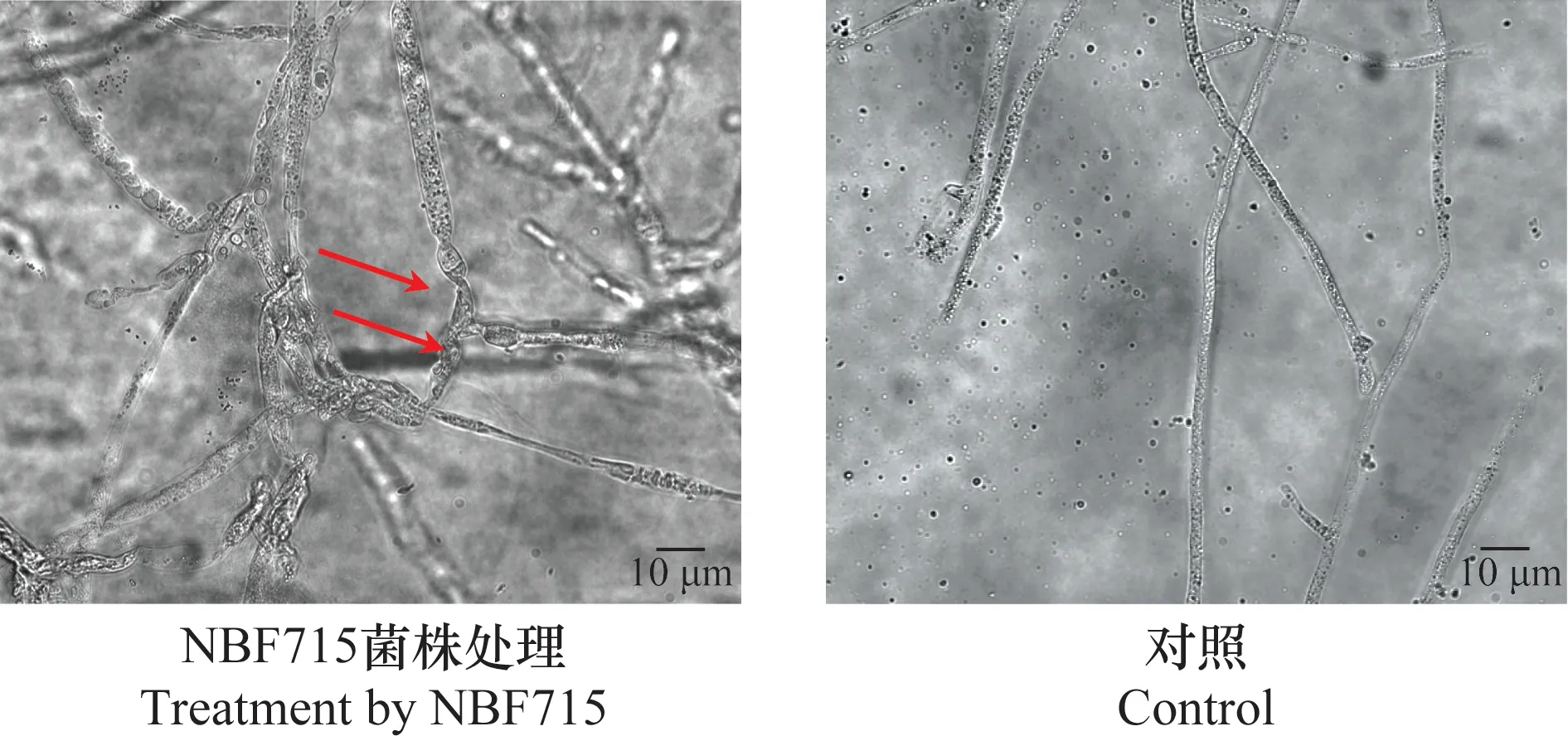
图2 菌株NBF715处理后瓜果腐霉菌丝的显微观察Fig.2 Microscopic observation on mycelia of Pythium aphanidermatum treated by NBF715 strain

图3 菌株NBF715处理后瓜果腐霉菌丝的扫描电镜观察Fig.3 Scanning electron microscopy observation on mycelia of Pythium aphanidermatum treated by NBF715 strain
1) 数据后标不同小写字母表示经最小显著差异法检测在0.05 水平差异显著。下同。
The data marked with different lowercase letters are significantly different at 0.05 level base on least significant difference method. The same applies below.
2.3 NBF715产嗜铁素能力和酶活性
通过离体定性试验表明,NBF715菌株能够在CAS平板、淀粉平板、CMC平板和茯苓粉平板产生晕圈或透明圈(图4),说明其具有产嗜铁素和淀粉酶、纤维素酶及β-1,3-葡聚糖酶能力。

图4 菌株NBF715水解酶活性和产嗜铁素能力Fig.4 Hydrolase activities of strain NBF715 and its ability to produce siderophore
2.4 NBF715发酵液对瓜果腐霉抑菌活性及对黄瓜猝倒病防控效果
NBF715无菌发酵液对瓜果腐霉具有良好的抑菌活性,随着发酵液浓度提高,抑菌率显著提高,10倍和25倍稀释发酵液抑菌率分别为84.1%和69.2%(表2)。
盆栽试验表明,NBF715发酵液浸种对黄瓜猝倒病具有良好的防控效果,经NBF715菌株发酵液原液和5倍稀释液浸种后发病率显著降低,发酵液原液防效高于对照药剂吡唑醚菌酯(表2)。

表 2 菌株NBF715发酵液对瓜果腐霉抑菌活性和黄瓜猝倒病的防效Table 2 Inhibitory effect of strain NBF715 fermentation broth on Pythium aphanidermatum and its control effect on damping-off of cucumber
3 结论与讨论
本研究确定了淡紫褐链霉菌 NBF715对瓜果腐霉的离体抑菌活性、对菌丝形态的影响、抑菌谱、产嗜铁素能力及水解酶活性和活体盆栽防效。
关于作物猝倒病的生物防控,之前的研究以生防细菌和生防真菌为主,如解淀粉芽胞杆菌Bacillusamyloliquefaciens[10],哈茨木霉Trichodermaharzianum,荧光假单胞菌Pseudomonasfluorescens[14-15]。本研究首次报道S.enissocaesilis对猝倒病防控效果。该菌种不仅对瓜果腐霉具有良好的抑菌作用,对其他6种常见的植物病原菌也具有良好的抑制作用,这些结果为其进一步的研究提供了基础。NBF715无菌发酵液对瓜果腐霉具有良好的抑菌作用,需要进一步对活性物质进行分离和鉴定。经NBF715处理的瓜果腐霉菌丝,发生扭曲、膨胀和消解,可能是其一种抑菌机制。Chen等[16]报道Streptomycessp.CB-75处理尖孢镰刀菌后菌丝发生变形、收缩、坍塌和弯曲,本研究与其结果相似。
嗜铁素是生防菌产生的最普遍的抑菌代谢产物,菌株超强螯合能力的铁载体螯合了环境中痕量的铁,能有效地与病原菌竞争铁离子从而抑制病原菌生长[17-18],NBF715菌株和瓜果腐霉竞争铁离子可能是其一个重要的抑菌机制。纤维素酶、淀粉酶和β-1,3-葡聚糖酶是植物病原真菌细胞壁的降解酶[19],NBF715菌株具有上述3种细胞壁降解酶活性,表明其具有破坏瓜果腐霉细胞壁结构的能力,该结果与光学显微镜和扫描电镜观察结果一致。
本文只进行了发酵液的活性评价,还需进行菌剂的防控效果研究,为产品的登记和田间应用推广奠定基础。
