丁苯酞在成人脂肪基质细胞分化为神经元样细胞过程中的分化促进及自噬激动作用观察
2022-08-08陆艳卉徐康赵紫烨李斌郭佳周桂娟
陆艳卉,徐康,赵紫烨,李斌,郭佳,周桂娟
1 唐山市人民医院神经内科,河北唐山 063000;2 唐山市人民医院检验科
成人脂肪基质细胞(ADSC)来源于脂肪组织,具有多向分化的潜能,具有容易获得、数量多、容易扩增等特点,成为细胞移植治疗神经系统疾病最有前途的干细胞之一。β-巯基乙醇是一种抗氧化剂,有毒性,然而在微克量级上却是少数几种可以延长小鼠寿命的化合物之一[1]。研究显示,β-巯基乙醇作为一种化学诱导剂,可诱导ADSC 分化为神经元样细胞,但诱导速度较慢,并且在几小时内就会出现细胞凋亡[2-6]。自噬在细胞的生长发育过程中具有双重作用,既是一种异于凋亡的细胞程序性死亡,又可以作为一种保护和防御机制来抵御环境变化对细胞造成的损伤,保护细胞免于凋亡和坏死[7-11],所以适度调节自噬水平已经成为预防或治疗神经系统病变的一条重要途径[12]。雷帕霉素作为经典的自噬激活剂,能够诱发和增强自噬反应[13]。丁苯酞(Dl-3-nbutylphthalide,NBP)从芹菜中提取,具有改善线粒体功能、抗氧化应激、抑制凋亡、降低谷氨酸释放、促进神经元再生等多种神经保护作用[14],在缺血性卒中的治疗等方面被广泛研究与应用,但其对自噬的影响及作用机制尚不清楚。2019 年9 月10 日—2020年12月10日,我们观察了丁苯酞在ADSC 诱导分化为神经元样细胞过程中的分化促进及自噬激动作用,现报告如下。
1 材料与方法
1.1 成人ADSC 的提取和培养 采用针吸法抽取成人(20~35 岁)志愿者腹部皮下脂肪组织(无内分泌及血液系统疾病),参照叶长青等[4]的实验方法,提取原代细胞,置于37 ℃、体积分数为5%的CO2饱和湿度培养箱中进行培养,期间每隔2~3 d换一次培养基,到10~14 d 细胞达到80%~90%融合时,按1∶2 比例进行传代培养。本研究经河北省唐山市人民医院伦理委员会批准施行,批准文号:RMYY-LLKS-2022-015,并经志愿者知情同意。
1.2 细胞分组、诱导分化及丁苯酞给予方法 将传至第3~6 代的成人ADSC,用胰酶-EDTA 进行消化、离心,制成单细胞悬液,将细胞按照1×107/L 的细胞浓度接种于已经预先放置无菌盖玻片的培养板中,制成细胞爬片,待细胞生长至70%~80%融合时,应用1 mmol/L 的β-巯基乙醇进行预诱导,培养24 h 后弃去,冲洗3 次后,分为β-巯基乙醇组、β-巯基乙醇+ 丁苯酞组、β-巯基乙醇+ 雷帕霉素组。其中β-巯基乙醇组加入含5 mmol/L 的β-巯基乙醇正式诱导液诱导其向神经元样细胞分化,β-巯基乙醇+ 丁苯酞组加入5 mmol/L 的β-巯基乙醇和10 µmol/L 的丁苯酞,β-巯基乙醇+ 雷帕霉素组加入5 mmol/L 的β - 巯基乙醇和200 µg/L 的雷帕霉素。
1.3 不同时间点各组细胞形态学观察及细胞分化率测算 取各组细胞,在预诱导、诱导1 h、诱导3 h、诱导5 h、诱导8 h时,采用倒置相差显微镜观察各组细胞形态学变化。在高倍视野下(×100)随机计数视野中的分化细胞数及细胞总数,计算细胞分化率。细胞分化率=分化细胞数/细胞总数×100%。观察3个样本,每个样本计数5次,取平均值。
1.4 诱导1 h、诱导5 h时各组细胞超微结构观察及自噬小体和自噬溶酶体数量测算 取各组细胞,在诱导1 h、诱导5 h 时后进行消化、离心,3%戊二醛、1%饿酸固定,丙醛脱水,环氧树脂包埋,超薄切片机切片,2%醋酸铀和枸橼酸铅染色,在透射电镜下观察细胞的超微结构并摄片。透射电镜下随机选取5个视野,计数自噬小体和自噬溶酶体数量。
1.5 不同时间点各组细胞存活率观察 取各组细胞,在诱导1 h、诱导3 h、诱导5 h、诱导8 h 时,按5×103个/孔密度接种至96孔板,每板设6个复孔,每孔加入5 g/L 的MTT 20µL,37 ℃孵育4 h,吸去孔内液体,每孔加入150µL 的二甲基亚砜(dimethyl sulfoxide,DMSO),于37 ℃恒温摇床低速震荡15 min。在酶联免疫检测仪上于490 nm 处测量各孔的OD值,以OD值表示各组细胞存活率。
1.6 各组细胞中神经元特异性烯醇化酶(NSE)、神经丝蛋-200(NF-200)、LC3 蛋白检测 采用免疫细胞化学法。取各组细胞,消化后制成细胞爬片,取出细胞爬片,用40 g/L多聚甲醛固定30 min,0.1%Triton-X-100 处理8 min,3% H2O2孵育10 min 以消除内源性过氧化物酶的活性,室温孵育15 min,冲洗3次,滴加封闭血清,37 ℃孵育15 min 后倾去,勿洗,滴加稀释的一抗NF-200(1∶100)、NSE(1∶100)、LC3(1∶100),4 ℃过夜,加入山羊抗兔多克隆二抗,37 ℃孵育30 min,加入3,3’-二氨基联苯胺显色,其中NSE、NF-200 取诱导5 h 细胞进行检测,LC3 取诱导1 h、3 h、5 h、8 h 时细胞进行检测。在高倍视野下(×100)随机计数视野中的阳性细胞数及细胞总数,计算阳性细胞率。阳性细胞率=阳性细胞数/细胞总数×100%。观察3个样本,每个样本计数5 次,取平均值。
1.7 统计学方法 采用SPSS23.0 统计软件。计量资料呈正态分布时以±s表示,多组间比较用单因素方差分析,两两比较用LSD-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 不同时间点各组细胞形态学变化及细胞分化率比较 诱导后的三组细胞形态学变化相似,细胞核变的大而圆,细胞质开始向细胞核方向浓缩,细胞体周围可见明显的光晕。在诱导5 h时,分化的细胞呈典型的神经元样细胞形态,细胞体向细胞核方向回缩成锥形,折光性明显增强,细胞伸出较长的轴突样突起,末端可见一级和二级分支。
不同时间点各组细胞分化率比较见表1。由表1可知,随着诱导时间的延长,各组细胞分化率显著升高(P均<0.05),在诱导5 h时达到峰值,而诱导8 h 时与诱导5 h 时细胞分化率无差异(P>0.05);与β-巯基乙醇组相比,β-巯基乙醇+雷帕霉素组、β-巯基乙醇+ 丁苯酞组细胞分化率均显著升高(P均<0.05);与β-巯基乙醇+雷帕霉素组相比,β-巯基乙醇+ 丁苯酞组在诱导1 h、3 h 时细胞分化率均显著升高(P均<0.05),在诱导8 h 时细胞分化率显著降低(P<0.05)。
表1 不同时间点各组细胞分化率比较(%,±s)
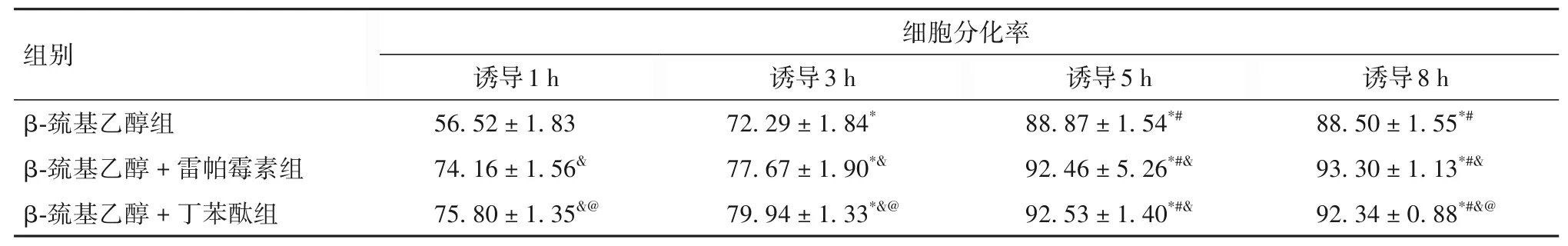
表1 不同时间点各组细胞分化率比较(%,±s)
注:与诱导1 h相比,*P<0.05;与诱导3 h相比,#P<0.05;与β-巯基乙醇组相比,&P<0.05;与β-巯基乙醇+雷帕霉素组相比,@P<0.05。
?
2.2 诱导1 h、诱导5 h时各组细胞超微结构及自噬小体和自噬溶酶体数量比较 诱导1 h、诱导5 h 时各组细胞超微结构见图1。由图1可见,诱导分化的神经元样细胞的细胞核体积大而圆,染色浅,其中常染色质多、异染色质较少,细胞质中可见溶酶体、高尔基复合体、线粒体等丰富的细胞器以及由大量密集扁平囊状粗面内质网构成的典型尼氏小体结构。部分神经元样细胞的细胞浆可见大量内质网扩张,线粒体出现肿胀、嵴断裂,有的甚至肿胀变形、空泡化;同时,细胞内出现具有双层膜结构的自噬小体;在自噬小体和初级溶酶体融合形成的自噬溶酶体内可见含有高密度的吞噬颗粒。
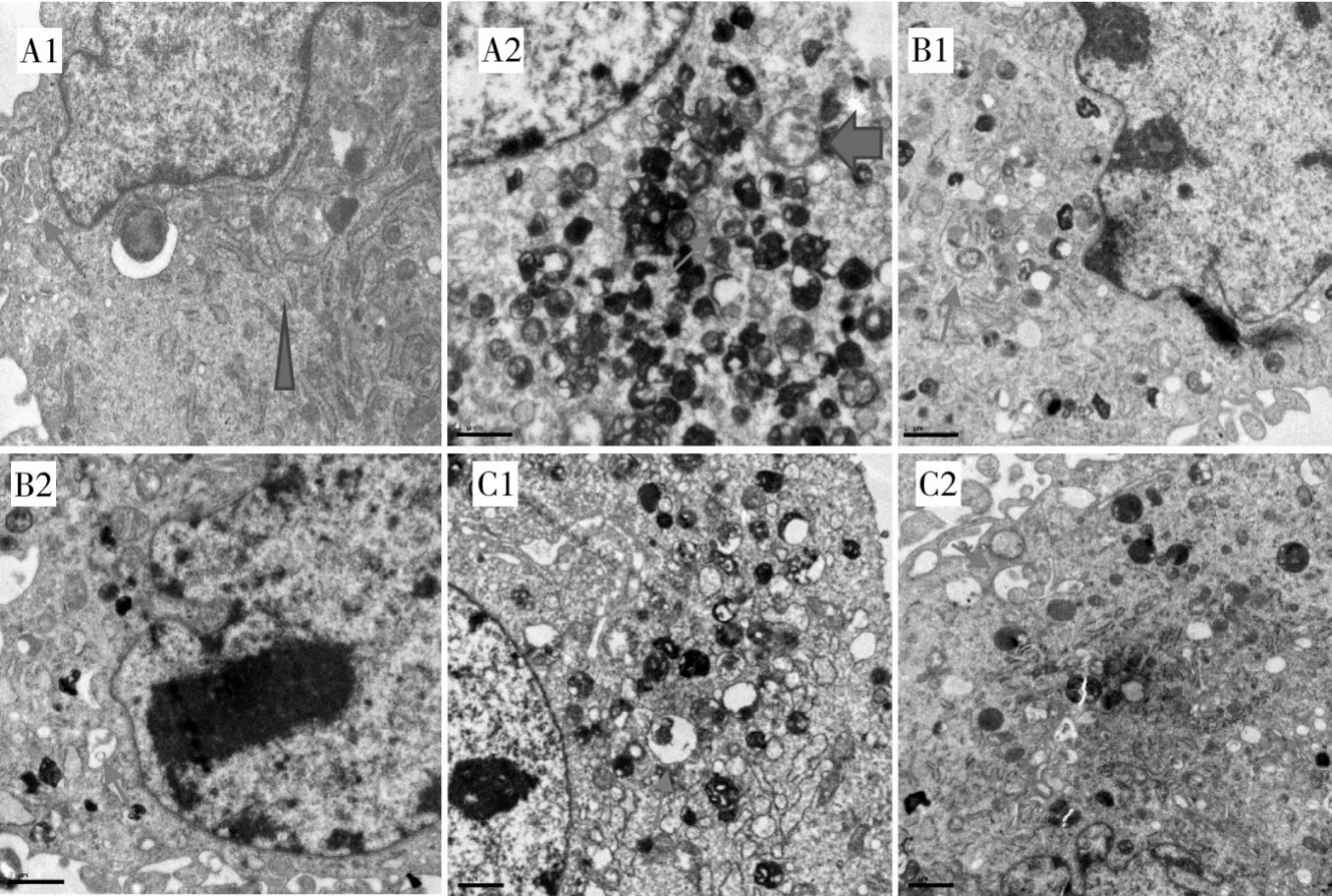
图1 诱导1 h、诱导5 h时各组细胞超微结构(×10 000倍)
诱导1 h、诱导5 h 时各组细胞自噬小体和自噬溶酶体数量比较见表2。由表2 可知,诱导5 h 时各组细胞自噬小体及自噬溶酶体数量均高于诱导1 h时(P均<0.05),β-巯基乙醇+ 丁苯酞组、β-巯基乙醇+ 雷帕霉素组细胞自噬小体及自噬溶酶体数量均高于β-巯基乙醇组(P均<0.05)。
表2 诱导1 h、诱导5 h时各组细胞自噬小体及自噬溶酶体数量比较(个,±s)
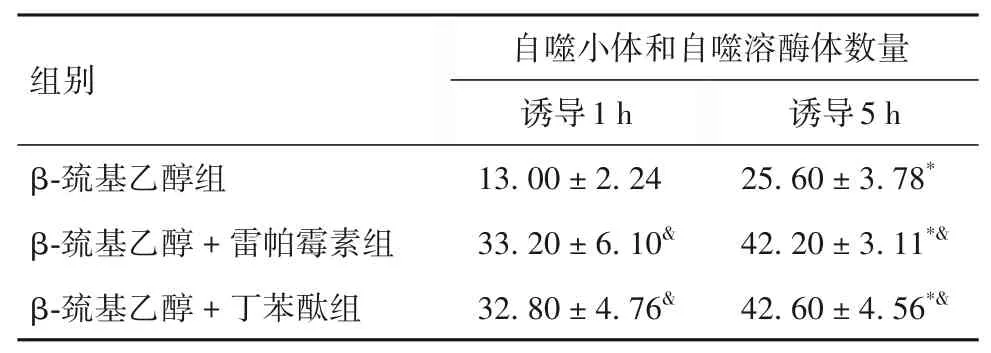
表2 诱导1 h、诱导5 h时各组细胞自噬小体及自噬溶酶体数量比较(个,±s)
注:与诱导1 h时相比,*P<0.05;与β-巯基乙醇组比,&P<0.05。
?
2.3 不同时间点各组细胞存活率比较 不同时间点各组细胞存活率比较见表3。由表3可知,随着诱导时间的延长,各组细胞存活率均显著下降(P均<0.05);与β-巯基乙醇组相比,β-巯基乙醇+雷帕霉素组、β-巯基乙醇+丁苯酞组细胞存活率均显著升高(P均<0.05);与β-巯基乙醇+雷帕霉素组相比,β-巯基乙醇+丁苯酞组在诱导1、5、8 h 时细胞分化率均显著降低(P均<0.05)。
表3 不同时间点各组细胞存活率比较(±s)
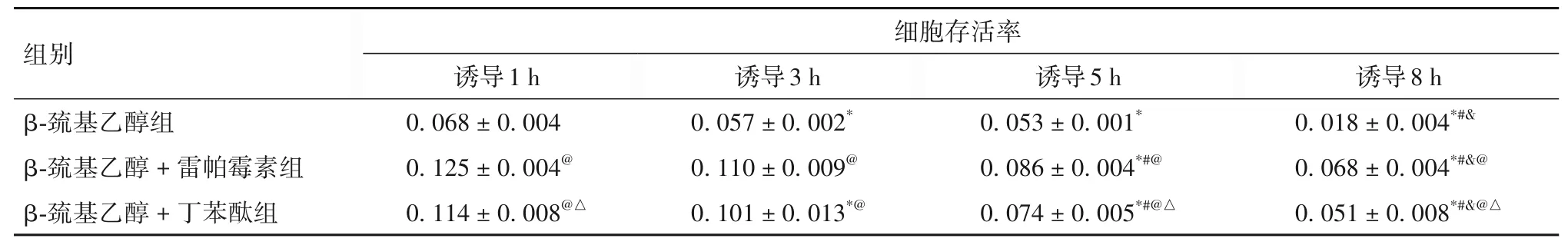
表3 不同时间点各组细胞存活率比较(±s)
注:与诱导1 h相比,*P<0.05;与诱导3 h相比,#P<0.05;与诱导5 h相比,&P<0.05;与β-巯基乙醇组相比,@P<0.05;与β-巯基乙醇+雷帕霉素组相比,△P<0.05。
?
2.4 各组NSE、NF-200、LC3 阳性细胞率比较 各组NSE、NF-200 阳性细胞率比较见表4。由表4 可知,与β-巯基乙醇组相比,β-巯基乙醇+ 雷帕霉素组、β-巯基乙醇+ 丁苯酞组NSE、NF-200 阳性细胞率均显著升高(P均<0.05);与β-巯基乙醇+雷帕霉素组相比,β-巯基乙醇+丁苯酞组NSE 阳性细胞率显著升高(P<0.05)。
表4 各组NSE、NF-200阳性细胞率比较(%,±s)
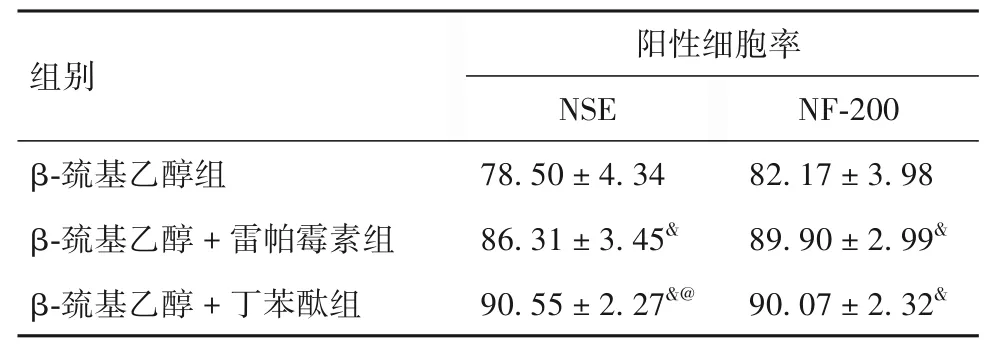
表4 各组NSE、NF-200阳性细胞率比较(%,±s)
注:与β-巯基乙醇组相比,&P<0.05;与β-巯基乙醇+雷帕霉素组相比,@P<0.05。
?
不同时间点各组LC3 阳性细胞率比较见表5。由表5 可知,随着诱导时间的延长,各组LC3 阳性细胞率均显著升高(P均<0.05),在诱导5 h 时达到峰值,而诱导8 h 时与诱导5 h 时LC3 阳性细胞率无差异(P>0.05);与β-巯基乙醇组相比,β-巯基乙醇+ 雷帕霉素组、β-巯基乙醇+ 丁苯酞组LC3 阳性细胞率均显著升高(P均<0.05);与β-巯基乙醇+ 雷帕霉素组相比,β-巯基乙醇+ 丁苯酞组在诱导1 h、3 h 时LC3 阳性细胞率均显著升高(P均<0.05),在诱导8 h 时LC3 阳性细胞率显著降低(P<0.05)。
表5 不同时间点各组LC3阳性细胞率(%,±s)

表5 不同时间点各组LC3阳性细胞率(%,±s)
注:与诱导1 h 时相比,#P<0.05;与诱导3 h 时相比,△P<0.05;与诱导5 h 时相比,◆P<0.05;与β-巯基乙醇组比,&P<0.05;与β-巯基乙醇+雷帕霉素组比,@P<0.05。
?
3 讨论
ADSC 在β-巯基乙醇的诱导下可定向分化为神经元样细胞,但诱导后神经元样细胞存活时间较短,几小时就发生死亡。研究[5]发现,凋亡是诱导后细胞死亡原因之一。自噬是细胞维持自身稳态的一种自适应机制。在生理状态下,细胞内部营养供给充足,自噬维持在较低的水平;在饥饿、缺氧等应激状态下,自噬可通过代谢受损的细胞器和细胞质成分为细胞提供新的营养,起到积极防御作用[15]。温和的自噬能保护细胞免受外界因素的侵害,促进细胞存活,严重的自噬将诱导细胞发生自噬性死亡[16]。
雷帕霉素作为经典的自噬激活剂,它可以通过抑制mTOR 的活性而诱发和增强自噬反应[17]。研究[18]发现,丁苯酞具有保护线粒体、抗氧化应激、抗凋亡、抗炎、调控自噬、抗血小板聚集、改善循环等作用。丁苯酞能够通过诱导自噬,上调Beclin-1、LC3-Ⅱ等水平,抑制血小板源性生长因子诱导的血管平滑肌细胞增殖,从而改善心肌重塑。
自噬在ADSC 诱导分化为神经元样细胞过程中的作用尚不明确。我们通过在ADSC 诱导分化为神经元样细胞的反应过程中加入雷帕霉素、丁苯酞对自噬的作用进行研究。本研究结果显示,ADSC 诱导分化5 h 时存活细胞中88%分化为神经元样细胞,并且此时的分化率达高峰,而此后的细胞分化率则不再明显升高,但随诱导时间延长存活的细胞也越来越少;在整个诱导分化过程中分化的细胞具有典型的自噬的超微结构改变,可见自噬小体及自噬溶酶体,且随诱导时间延长,自噬小体及自噬溶酶体数量逐渐增多。作为细胞自噬的标志蛋白,β-巯基乙醇组LC3阳性细胞率在诱导5 h时达到高峰,与细胞分化的变化趋势以及自噬小体及自噬溶酶体数量变化相同,但是各个诱导组LC3 阳性细胞率却明显低于细胞分化率。这些结果提示诱导分化过程中分化细胞的自噬功能不足,致使分化过程中产生的大量代谢产物不能及时有效地清除,从而导致细胞死亡,也是细胞分化率在诱导5 h后不再明显增加的重要原因之一。
我们在正式诱导反应时分别加入雷帕霉素和丁苯酞,结果显示细胞分化率在诱导反应1 h就达70%以上,且随诱导反应时间延长增加;同时,这两组发生自噬反应的细胞数量明显增多,强度也明显增强,在诱导反应1 h 时,LC3 阳性细胞率已高达90%以上,并且在整个反应过程中均维持在很高的水平,且到诱导8 h 时LC3 的阳性细胞率较前无明显下降。而LC3的阳性细胞率在1 h时达90%以上,诱导各个时间点均高于分化率,在1 h、3 h阳性为著。加入雷帕霉素和丁苯酞后细胞的细胞分化率明显增高,也证实雷帕霉素、丁苯酞可促进细胞分化。但也有研究[19]显示,雷帕霉素对骨髓造血干细胞向树突状细胞分化的过程影响较小,使分化的树突状细胞处于稳定的不成熟状态,需要进一步研究以证实及鉴别。在正式诱导反应时加丁苯酞和雷帕霉素后,细胞的分化率及LC3阳性细胞率在诱导5 h相差不大,故丁苯酞对自噬也有促进作用,且与雷帕霉素激动作用相当,而细胞的存活率较只有β-巯基乙醇组升高,说明雷帕霉素、丁苯酞均能通过增强自噬,促进诱导后神经元样细胞生存。
在三组细胞整个分化过程中,发生自噬的细胞比率均明显高于发生细胞分化的比率,这进一步证实了自噬是细胞分化过程中的重要基础和支撑性反应。因此,细胞在分化过程中必须有足够的自噬能力才能保证细胞诱导分化,这也是大量获得目标细胞的关键环节和基础条件之一。本研究中,虽然雷帕霉素、丁苯酞应用与否细胞分化都显示相似的形态学变化,但细胞分化速度和程度则具有显著不同。诱导剂中加入雷帕霉素和丁苯酞后,ADSC 诱导分化反应1 h,就有70%的细胞出现了较长的突起,已经出现神经元的雏形。但在β-巯基乙醇组,诱导反应3 h才能够达到该种分化程度,该结果说明在ADSC 诱导分化过程中,雷帕霉素和丁苯酞不但可以立即激活分化细胞的自噬反应,提高自噬强度,而且也可以加快ADSC 的分化速度。自噬的调控是一个非常复杂的过程,涉及许多信号通路,诱导分化反应中的细胞具体信号传导通路还不清楚,而丁苯酞促进自噬的机制也不明确。
ADSC 诱导分化为神经元样细胞过程中,透射电镜下可见细胞浆中出现大量内质网扩张、线粒体肿胀、嵴断裂,有的甚至发生肿胀变形和空泡化,并且可见包裹有吞噬线粒体的双层膜结构的自噬小体以及由含有高密度吞噬颗粒的初级溶酶体融合而形成的单层膜状结构的自噬溶酶体的自噬的发生。在诱导剂中加入雷帕霉素和丁苯酞后,分化细胞形态学变化相似,但自噬小体及自噬溶酶体的数量明显增多,且随诱导时间延长逐渐增多。检测发现,随着诱导分化时间延长而LC3 阳性细胞率升高,但生存细胞数量逐渐下降,自噬水平不足以清除肿胀破坏的线粒体以及分解产物,导致细胞的分化速度减慢,甚至细胞发生死亡。也有研究[20]证实,神经细胞的自噬增强具有神经保护作用。雷帕霉素、丁苯酞是一种很有前途的预防和治疗神经退行性疾病的药物,尤其是用于早期的帕金森综合症和阿尔茨海默氏病以及PMP22 相关性脱髓鞘性多发性神经病的治疗方面。
综上所述,ADSC 诱导分化为神经元样细胞过程中,自噬起到保护和支撑性作用,丁苯酞可促进细胞分化,并通过升高自噬小体和自噬溶酶体数量等自噬激动作用提高了细胞存活率。
