pSS患者外周血和唇腺组织中差异表达基因生物学功能分析、关键基因筛选及唇腺组织中免疫细胞变化观察
2022-08-08饶钰君田龙龙张勇斌闵星星陈桂玉李国青
饶钰君,田龙龙,2,张勇斌,闵星星,2,陈桂玉,2,李国青
1 扬州大学附属医院风湿免疫科,江苏扬州 225000;2 大连医科大学研究生院
原 发 性 干 燥 综 合 征(primary Sjögren’s syndrome,pSS)是一种以淋巴细胞增殖和进行性外分泌腺损伤为特征的慢性系统性自身免疫病[1-2]。pSS的发生发展与遗传、环境、免疫机制等因素相关,但目前其确切发病机制尚未阐明,临床治疗中多为经验性用药以延缓病情。因此,深入探索pSS 的发病机制和发现更多可靠的诊断及预后评估标志物,对pSS 患者的预后改善极其关键。生物信息学是分子生物学与信息技术相结合的一门交叉学科,对揭示疾病的分子机制具有重要意义。基因芯片作为其中一种新兴技术,被用于高效地获取生物信息和疾病表达谱数据,为理解疾病发生的机制提供可供选择的 思 路[3]。 NCBI GEO(Gene Expression Omnibus,https://www.ncbi.nlm.nih.gov/geo/)数据库是一个储存芯片、二代测序以及其他高通量测序数据的数据库。本研究从GEO数据库下载pSS患者与健康人的微阵列数据集[4],从中筛选出与疾病相关的差异表达基因,并利用STRING 数据库对差异表达基因进行功能富集分析,获得关键调控基因及其富集的信号通路、分子功能及生物学过程,筛选调控pSS 发生发展的关键基因,还采用CIBERSORT算法初步评估pSS 患者唇腺组织中22 种免疫细胞浸润情况,并进一步分析不同类型免疫细胞之间的相关性,旨在确定pSS 外周血和唇腺组织中潜在的生物标志物并评估其免疫细胞浸润情况,为pSS 的精准诊断和分子机制研究提供生物信息学理论参考。
1 材料与方法
1.1 pSS相关基因表达谱数据的选取及预处理 选取GEO 数据库收集的pSS 相关基因表达谱芯片GSE51092,该芯片基于GPL6884 平台(Illumina HumanWG-6 v3.0 expression beadchip),包括190例pSS患者和32 例健康人的外周血和唇腺组织中mRNA表达谱[5]。利用R 软件(版本4.0.3,https://www.rproject.org/)读取该数据集的原始数据,运用稳健多阵列均数算法进行背景校正和数据归一化。所有数据来自网上公开数据库,未涉及任何在人体或动物身上进行的实验。
1.2 pSS 患者外周血和唇腺组织中差异表达基因的生物学功能分析、发生发展关键调控基因的筛选
1.2.1 pSS 患者外周血和唇腺组织中差异表达基因的筛选 通过R 软件的Limma 包,设置|logFC|>0.5 和P-value<0.05 为 筛 选 阈 值,筛 选pSS 患者与健康人外周血和唇腺组织中的差异表达基因。
1.2.2 pSS 患者外周血和唇腺组织中差异表达基因的生物学功能分析 包括基因本体论(Gene ontology,GO)功能富集分析、基于京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)信号通路富集分析、基因集富集分析(Gene set enrichment analysis,GSEA)。其中,GO 功能富集分析是对基因进行注释和生物学过程分析的重要工具,分为生物学过程、分子功能和细胞组分三方面。KEGG 信号通路富集分析是用于从大规模分子数据集中了解基因的富集通路。使用R 软件的cluster-Profiler 包对其进行GO 和KEGG 富集分析,P<0.05认为有统计学意义。GSEA 用来评估一个预定义的基因集中基因表达量的变化是否有某些特定的基因集合的倾向性[6],判断基因集里面的成员在基因列表里是随机分布还是主要聚集在列表的顶部或底部,若聚集在在列表顶部或底部,则说明此基因集成员对表型的差异有贡献。GSEA 一般以NOMP-value<0.05、FDR q-value<0.25、|NES|>1 作为显著富集的筛选标准。
1.2.3 pSS 发生发展关键调控基因的筛选 通过STRING 数据库构建差异表达基因的蛋白互作网络(Protein-protein inter- action,PPI)(score>0.4),然后利用Cytoscape 软件(www. cytoscape. org/)的Cytohubba 插件,选取连接度值排序前10 的差异表达基因,即为可能参与pSS 发生发展的关键调控基因。
1.3 pSS 患者唇腺组织中免疫细胞变化情况观察 免疫细胞浸润分析是针对组织中不同免疫细胞的浸润程度差异,分析其与疾病的进展和预后之间的相关性。使用R语言程序并链接基于线性支持向量回归的CIBERSORT 反卷积算法,对已获标准化处理的全基因RNA-Seq 表达矩阵与免疫细胞表达矩阵进行融合分析,对T 细胞、记忆和原始B 细胞、活化和静止NK 细胞等22 种免疫细胞的细胞占比进行预测评估,以细胞占比表示免疫细胞浸润情况[7]。随后采用Pearson 相关分析法分析各类免疫细胞间的相关性,并观察pSS 患者和健康人之间的免疫细胞占比差异。P<0.05 为差异有统计学意义。
2 结果
2.1 pSS患者外周血和唇腺组织中差异表达基因的生物学功能分析、发生发展关键调控基因筛选结果
2.1.1 pSS 患者外周血和唇腺组织中差异表达基因的筛选结果 筛选出282个差异表达基因,包括165个上调基因和117个下调基因,上调的基因有RNF36、STAT1、PARP9、EPSTI1、STAT2、MAFB、IFIH1、TTYH3、GBP1、TDRD7、IFI44、PARP12、CXCL10、GBP5、CEACAM1、PARP14、XAF1、RSAD2、TTC21A、LY6E、IFI44L、DDX58、SP140、PML、IFIT3、IL15、ATF3、IFIT2、ISG15、IFITM3、MT1A、BATF2、IFI27、OTOF、MUC1、TOP2A、CCL8、CHMP5、MX1、HES4、NEXN、AGRN、GPD2、CCR1、MASTL、OAS2、IFI6、FANCL、SCO2、VRK2、MERTK、OAS1、CCL2、HESX1、PCGF5、USP18、INCA、IRF7、PGAP1、CCNA2等,下调的基因有NRCAM、MMP28、FBLN2、CD248、IMPA2、ASF1B、THRA、ARL3、FEZ1、MATK、F8A3、FGF9、CAPN5、HGD、LRRN3、ALPL、RASD1、TKTL1、FCGBP、TLE2、COLQ、RFX2、ATG9B、PTGDS、GPR77、CXCR6、CLIC3、MPZL1、SIRPB2、SDK2、CYP2S1、EDAR、FBXO9、TGM3、CXCL5、AK5、VWCE、RPL3L、MICAL2、COCH、COL6A2、PFN2、THBD、CD8B、DSC1、HOMER2、CD8B1、AXIN2、CTDSPL、CRAT等。
2.1.2 pSS 患者外周血和唇腺组织中差异表达基因的生物学功能分析结果 GO 功能富集分析结果显示,pSS 外周血和唇腺组织中差异表达基因在生物学过程体现在病毒应答、病毒防御应答、Ⅰ型干扰素(IFN)信号通路、病毒基因组复制、IFN-γ 介导的信号通路等过程上;分子功能变化主要集中在双链RNA 结合、翻译调节活性、NAD+ADP-核糖转移酶活性等功能上;而在细胞组分上的改变无显著的富集结果。KEGG 信号通路富集分析发现,显著富集的信号通路包括冠状病毒(COVID)-19、人乳头瘤病毒感染、甲型流感、丙型病毒性肝炎、EB 病毒感染、麻疹、NOD 样受体信号通路、急性髓系白血病等。GSEA 分析结果显示,差异表达基因富集在免疫反应通路,包括对病毒的防御反应、对IFN-γ 的应答、RIG-I样受体信号通路、调控破骨细胞分化等通路。
2.1.3 pSS 患者发生发展关键调控基因的筛选结果 构建的PPI 网络由259个节点和1 025个边组成,其中连接度值前10 的差异表达基因为STAT1、IRF7、CXCL10、MX1、ISG15、IFIT3、IFIH1、OAS1、OAS2、IFIT2(图1)。
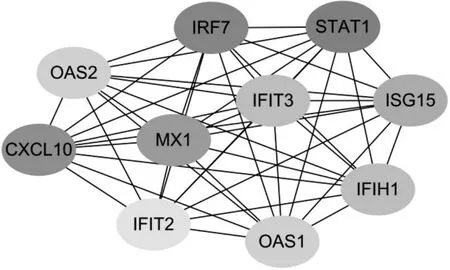
图1 CytoHubba插件筛选出的参与pSS发生发展的关键调控基因
2.2 pSS 患者唇腺组织中免疫细胞变化情况 pSS患者唇腺组织中细胞占比较高的免疫细胞类型分别是M2 巨噬细胞、M0 巨噬细胞、M1 巨噬细胞、幼稚B细胞、活化的CD4+T 细胞、活化的NK 细胞、调节性T 细胞(Treg)、静息的肥大细胞,其中活化的NK 细胞与CD8 + T 细胞的细胞占比呈正相关关系(r=0.44,P<0.05),活化的记忆CD4 + T 细胞与Treg 的细胞占比呈负相关关系(r=-0.54,P<0.05)。与健康人相比,pSS 患者唇腺组织中活化树突状细胞(DC)的细胞占比显著增加(P<0.001),CD8+T细胞的细胞占比显著降低(P=0.038)。
3 讨论
pSS是一种病情杂糅、症状多样的自身免疫性疾病,临床上缺乏敏感、特异的诊断指标,通常基于病理检测联合影像技术确诊,此时大多数患者病情已进展,往往失去最佳治疗时机,导致预后不良。因此,需要不断探索其发病机制,寻找诊断的特异性标志物和精准治疗的靶点,这对改善pSS 患者的预后至关重要。
本研究从GEO 数据库下载了pSS 表达谱数据,共鉴定了282个差异表达基因,并对其生物学功能和信号转导途径进行功能分析。GO 富集主要包括病毒应答、病毒防御应答、Ⅰ型IFN 信号通路、病毒基因组复制、IFN-γ 介导的信号通路、双链RNA 结合、翻译调节活性、NAD+ADP-核糖转移酶活性等;KEGG 分析发现显著富集的通路包括COVID-19、人乳头瘤病毒感染、甲型流感、丙型病毒性肝炎等,其中关于COVID-19 通路的结果提示pSS 的疾病状态可驱动或增加COVID-19 的易感性。目前已有多中心研究支持自身免疫性疾病患者表现出更高的COVID-19 患病率和病情恶化风险[8-9]。另外,GSEA分析将常规GO/KEGG 分析中容易遗漏的差异表达不显著却有重要生物学意义的基因包含在内,挖掘出更多的具有生物学意义的信息,其结果表明基因集与病毒防御应答、对IFN-γ 的应答、RIG-I 样受体信号通路等相关。以上结果均提示了病毒感染和多种免疫反应等信号通路与pSS 的发生发展密切相关,而这些富集的信号通路也可能是pSS 患者的免疫治疗评估中的关键因素,为pSS 的治疗提供新思路。
本研究筛选出的10个pSS发生发展关键调控基因排序如下:STAT1、IRF7、CXCL10、MX1、ISG15、IFIT3、IFIH1、OAS1、OAS2、IFIT2。STAT1 是Ⅰ型IFN信号通路关键的转录激活因子,通过酪氨酸和丝氨酸残基的磷酸化而激活,指导IFN 调节基因的转录,参与细胞生长、分化及凋亡[10]。STAT1 被激活后可增加体内活性氧含量而引起肺纤维化,因此pSS 患者因活性氧明显增多,容易继发间质性肺病[11]。IRF7 是IFN 依赖性免疫应答的调节因子,介导多种免疫相关细胞的I 型IFN 反应,诱导IFN-α 和其他促炎细胞因子的转录。ISG15为IFN刺激基因,参与介导I 型IFN 通路的活化和传导而发挥抗病毒作用。MX1 则受IFN 调节,通过抑制病毒基因组复制、翻译、抑制出芽等途径发挥抗病毒作用,其基因表达与pSS 疾病活动相关,有望成为潜在的生物标志物[12]。IFIT3、IFIT1 以及IFIT2 属于IFN 诱导蛋白家族,参与抗病毒免疫反应[13]。OAS1、OAS2 则是在IFN 诱导下编码抗病毒反应的必需蛋白,其水平升高可激活核糖核酸酶L,诱导病毒分解[14]。最后,趋化因子配体10(CXCL10)是一种B细胞稳态趋化因子,在淋巴组织发育和调节免疫细胞运输中发挥关键作用,其表达上调可促使生发中心形成和增加淋巴细胞浸润程度,以加速pSS 疾病进展。研究[15]发现,CXCL10 与pSS 的口眼干燥和高蛋白血症有关,可能是体现pSS 疾病活动性的生物标志物。总之,上述基因或蛋白分子主要涉及了抗病毒感染和免疫调节两方面,这提示了pSS 的发生发展与病毒感染引起的免疫反应密切相关,也为我们更深刻地认识pSS 的发病机制以及研究pSS 潜在治疗靶标提供了有价值的线索。
从免疫系统的角度评估不同类型免疫细胞间的浸润差异及动态调节,对阐明pSS 发病的分子机制和开发新的免疫治疗靶点具有重要价值。免疫细胞浸润的类型和比例与临床结果密切相关,其不仅对患者的生存具有预测价值,还可作为药物靶标来提高患者的预后,影响治疗效果。组织中某种免疫细胞相对含量升高时,可针对该免疫细胞进行个性化的用药,从而提高疾病的诊治水平。CIBERSORT 是一种分析工具,可基于标准化处理后的基因芯片表达谱数据来估算组织中的22 种免疫细胞种类和相对含量,且能量化组织中特定细胞类型的丰度。它使用RNA-seq 数据来评估免疫细胞的表达,并从样本中获得不同的免疫细胞比例。该工具在白细胞亚群和恶性肿瘤预后基因的应用中相当成熟,现如今也被用于分析风湿免疫性疾病的免疫细胞浸润情况,如狼疮性肾炎、特应性皮炎、骨关节炎等[16-18]。本研究采用CIBERSORT 反卷积法对pSS 的免疫细胞间的相关性进行分析,得出活化的NK 细胞与CD8+T 细胞呈正相关关系,活化的记忆CD4+T 细胞与Treg 呈负相关关系,侧面反映不同免疫细胞之间在pSS 的病程进展中存在协同或拮抗作用。但是因为目前暂无大规模的基础研究对不同类型免疫细胞之间的相关性进行验证,此预测仅具有一定的参考价值。
我们对pSS 患者合计健康人的免疫细胞浸润水平进行比较,发现pSS 患者较健康人的外周血和唇腺组织中活化DC 的浸润比例明显增加(P<0.001),提示了DC 浸润在pSS 免疫病理中起关键作用。以往DC 一直被认为是体内唯一的抗原提呈细胞,而参与pSS 发病的免疫病理过程相关报道较少,其作用被低估。相关研究[19]发现,DC 可产生大量I 型IFN,并刺激MHC Ⅰ和Ⅱ类分子、共刺激分子、趋化因子及其受体的表达,诱导B 细胞成熟和分化成浆细胞。其中,浆细胞样DC 能在被Toll样受体识别病毒核酸时迅速产生高达1 000 倍于其他细胞的Ⅰ型IFN[20],而B 细胞衍生的自身抗体则刺激DC 产生Ⅰ型IFN、自身抗原而驱动免疫反应,从而形成一个以Ⅰ型IFN 为中心的包含先天系统和适应性系统的正前馈环路[21]。可见IFN 通路的失调是pSS 重要的特征之一,而DC 的稳态也与全身自身免疫的疾病状态直接相关。
另外,本研究还发现pSS 患者较健康人的CD8 + T 细胞浸润比例相对减少,但差异变化并不明显(P=0.038),这与以往相关研究并非完全一致。研究[22]报道,CD8 + T 细胞在pSS 患者外周血中明显减少,推测CD8 + T 细胞减少可通过其对病毒感染的控制而促进pSS 的发展。但也有研究[23]报道,CD8 + T 细胞在自身免疫性疾病中浸润增加,可促使炎性细胞因子分泌、扭曲分化曲线以及阻挡呼吸暂停等途径,从而促进疾病的发生。考虑本研究的CIBERSORT 分析基于有限的基因数据,可能会造成检验效能偏低,需更大样本去验证CD8 + T 细胞的浸润情况。有关其他免疫细胞相关研究[24]发现,CD4 + T 淋巴细胞在腺体组织中浸润比例较高,与pSS 疾病活动和病灶积分密切相关。Th1/Th2 细胞在机体内相互制约,若比例失衡将促进炎症反应,如分泌IL-4、IL-6、TNF-α、IFN-γ等细胞因子,激活Fas/Fas-L 信号通路,刺激淋巴细胞浸润,导致唾液腺分泌功能破坏、靶器官进一步损害。Treg 则是分泌IL-10、TGF-β 等抑制性细胞因子而发挥维持机体免疫平衡作用。若通过增加体内Treg 含量而抑制炎症因子表达也不失为一种治疗pSS 的方法[25]。可见,这些免疫细胞浸润差异、不同亚群间的密切联系及相互转化等,可导致免疫系统失衡,造成组织损伤。未来能否针对某一类细胞亚群作为发病机制研究或治疗靶标,还需更多研究支持。
本研究尚有不足之处。一是纳入的基因芯片样本量有限,容易造成误差,可进一步增加GEO 芯片数据或联合其他数据库进行分析;二是CIBERSORT 算法是基于有限的遗传数据,导致免疫浸润评估时出现偏倚,仍需进一步体外培养或动物实验验证。今后课题组的相关工作将基于生物样本进行实验研究,以验证本研究结果的准确性,并进一步探讨关键基因和免疫浸润之间的调控关系。
综上所述,与健康人相比,pSS 患者外周血和唇腺组织中有282个差异表达基因;差异表达基因与病毒感染、I 型IFN 信号通路传导、对病毒的防御反应等免疫反应通路有关,STAT1、IRF7、CXCL10等10个基因可能是pSS 发生发展的关键调控基因。pSS 患者唇腺组织中活化的NK 细胞与CD8 + T 细胞的细胞占比正相关,活化的记忆CD4 + T 细胞与Treg 的细胞占比负相关;与健康人相比,pSS 患者唇腺组织中活化DC 的细胞占比增加、CD8+T 细胞的细胞占比降低。本研究为pSS 诊断生物标志物的开发和免疫靶标治疗研究提供了一些新思路和方向,为pSS 发生发展的分子机制研究提供新的见解。
