沉默TSPAN13对前列腺癌细胞增殖、迁移和侵袭的影响
2022-08-08李蕾蕾王志强李常颖王兴芬孟庆阳梁锐
李蕾蕾,王志强,李常颖,王兴芬,孟庆阳,梁锐
1 天津医科大学第二医院病理科,天津 300211;2 天津医科大学第二医院肛肠外科;3 天津医科大学第二医院泌尿外科研究所
前列腺癌(PCa)是男性第二常见癌症,2020 年全球估计有超过141万例新发PCa病例和37.5万例相关死亡病例[1]。近年来,随着人口老龄化以及饮食结构改变,包括中国在内的亚洲国家PCa 的发病率一直在上升,尤其是老年男性[2-3]。肿瘤发生、发展过程中存在诸多基因异常表达,随着高通量测序技术和转录组学研究的快速发展,更多的异常基因被发现。四跨膜蛋白(TSPANs)是细胞表面蛋白,长度为204~355个氨基酸,包含4个跨膜结构域、细胞内 N 端和 C 端、2 个细胞外结构域和1 个细胞内环[4-5]。TSPANs 在细胞-细胞黏附、细胞外基质-细胞相互作用、细胞生长和凋亡等方面发挥关键作用[6-8]。TSPAN13 是 TSPANs 家族的成员之一。研究表明,TSPAN13 在人乳腺癌组织中高表达,抑制TSPAN13 表达可降低ZR-75-30 乳腺癌细胞的生长速度[9]。此外,敲除 TSPAN13 可抑制结肠癌细胞增殖和集落形成[10]。而 TSPAN13 是否参与 PCa 发生、发展仍不清楚。2020 年 5 月—2021 年 5 月,我们探讨了TSPAN13 在PCa 中的表达及沉默TSPAN13 后其在PCa细胞系中的生物学功能和潜在机制。
1 材料与方法
1.1 材料 胎牛血清购自天津可典生物科技有限公司,DMEM 培养液、RPMI1640 培养液、胰酶、青链霉素双抗均购自上海源培生物科技有限公司。SYBR Green Fast q-PCR Mix 购自瑞士罗氏公司;反转录试剂盒购自美国Thermo 公司;qRT-PCR 引物由上海生工生物工程股份有限公司合成。PVDF 膜、Transwell 培养小室购自美国 Millipore 公司;ECL 化学发光试剂购自上海雅酶生物医药科技有限公司;TRIzol(总RNA抽提试剂)、Western blotting蛋白预染Marker、TSPAN13 抗体、Lipofectamine2000 均购自美国 Invitrogen 公 司 ;GADPH 抗 体 购 自 Proteintech 公司,NC 及si-TSPAN13 由上海吉玛基因有限公司合成;CCK-8试剂购自西安米鼠生物科技有限公司;基质胶购自美国BD 公司;细胞凋亡试剂盒以及细胞周期试剂盒均购自北京索莱宝生物科技有限公司。人PCa 细胞系(PC3、22Rv1、LNCAP、DU145)和人良性前列腺增生(BPH)细胞系BPH-1均由天津医科大学第二医院泌尿外科研究所惠赠。
1.2 方法
1.2.1 PCa 及 BPH 组织中 TSPAN13 蛋白表达检测 征得天津医科大学第二医院伦理委员会同意后,在病理科收集2019 年PCa 组织和BPH 组织的病理蜡块各20例份,将蜡块重新切片后进行免疫组化检测。病理组织纳入标准:①PCa:患者术前行前列腺穿刺活检术,确诊PCa,同时术前、术后均未行任何抗肿瘤治疗,并且患者自身无其他肿瘤病史。②BPH:患者首先行经尿道前列腺电切术,术后确诊为BPH,但不包括同时伴有前列腺上皮内瘤变。实验采用SP 免疫组化二步法检测PCa 及BPH 组织中TSPAN13 蛋白表达。60 ℃烤片1 h,复温至室温后二甲苯脱蜡30 min,PBS 洗3 次后在高温下使用EDTA 进行抗原修复,PBS 洗3 次,然后在湿盒内进行孵育,滴加阻断内源性过氧化物酶室温孵育10 min,PBS 冲洗 3 次,TSPAN13 抗体均按照说明书比例稀释,滴加一抗后4 ℃冰箱过夜,PBS冲洗3次,滴加二抗室温孵育 1 h,PBS 冲洗 3 次,滴加 DAB 显色液,室温孵育5 min,最后苏木素复染,脱水,透明,封片。
1.2.2 细胞培养 PC3 细胞、22Rv1 细胞、LNCAP细胞、DU145 细胞用含10%胎牛血清和1%青链霉素双抗的RPMI1640 培养基培养,BPH-1 细胞用含10%胎牛血清和1%青链霉素双抗的DMEM 培养基培养,培养环境均为37 ℃、5%CO2、饱和湿度。
1.2.3 TSPAN13 mRNA 在 PCa 细 胞 系 及 BPH-1 细胞中的表达检测 采用RT-PCR 法。首先对贴壁的细胞提取总RNA,再使用反转录试剂盒将配好的试剂置于金属浴中,设定参数(25 ℃5 min→42 ℃60 min→70 ℃ 5 min),进行反转录合成 cDNA。GAPDH 正向引物:5'-ACAACTTTGGTATCGTGGAAGG-3',反向引物:5'-GCCATCACGCCACAGTTTC-3';TSPAN13正向引物:5'-TATCTTGCGCTTGTTTAGCCC-3',反向引物:5'-ACTTGCCGTATTGTTCCAACC-3'。之后将引物以及其余反应物按说明书配置成一定比例的反应体系用无酶枪头加入96孔板,再放入提前预热好的qPCR 仪中,设定参数95 ℃ 10 min→(95 ℃ 15 s→60 ℃ 20 s→72 ℃ 30 s)×40,观察 qPCR 的熔解曲线和扩增曲线,计算实验数据,最后用GraphPad Prism软件进行柱状图量化分析结果。
1.2.4 TSPAN13 蛋 白 在 PCa 细 胞 系 及 BPH-1 细 胞中的表达检测 采用Western blotting 法。首先使用蛋白提取试剂对贴壁细胞进行总蛋白提取,通过Bradford 法测定蛋白质浓度,蛋白样品与5×SDS 上样缓冲液以4∶1 的体积混合,100 ℃煮沸5 min(或95 ℃煮沸10 min);按照蛋白定量结果进行聚丙烯酰胺凝胶电泳,然后将蛋白转到PVDF 膜上,用5%的脱脂牛奶进行封闭,封闭完成后进行一抗二抗的孵育,最终采用ECL 化学发光法对蛋白条带进行成像处理,最后用Image J软件进行量化分析结果。
1.2.5 细胞分组及转染 本实验采用双细胞系验证,因此在PC3 和DU145 细胞中的分组情况一样。细胞分组:阴性对照组(NC组)、小干扰转染组1(si1-RNA组)、小干扰转染组2(组si2-RNA),将1.0×105个PC3细胞和1.5×105个DU145细胞接种于6孔板中培养过夜,转染前将培养基更换为Opti-MEM培养基,使用Lipofectamine2000将针对TSPAN13的特异性si-RNA(si1-TSPAN13:5'-AGACUAACCAAGGUGUAAAGC-3',si2-TSPAN13:5'-AUUAGCAGCAGACUAACCA-3')转染至细胞,12 h 后进行加液处理。再将6 孔板放入细胞培养箱中进行正常培养即可。待48 h或72 h 细胞长满后,对转染si-RNA 后的细胞进行RNA和蛋白的提取及相关的生物学行为验证实验。
1.2.6 si-RNA 转染后细胞中TSPAN13 表达检测 参照 1.2.3 和 1.2.4,采用 RT-PCR 和 Westernblotting法检测各组细胞TSPAN13 表达。选择合适的si-RNA进行后续的生物学行为验证。
1.2.7 细胞增殖能力检测 采用CCK-8 法。首先使用针对TSPAN13 特异性si2-RNA 对PC3 细胞和DU145 细胞进行沉默处理,取处于对数生长期的各组细胞,用不含血清的RPMI1640 培养基制备成2×104/mL 的细胞悬液,取100 µL 细胞悬液接种到96孔板中,每组细胞5 个复孔,将 10 µL 的CCK-8 溶液按照0、24、48、72 h 时间点分别添加到培养基中,并在37 ℃下孵育4 h。采用酶标仪测量每个孔在波长450 nm 处的吸光度(OD 值)。最终对各组的吸光度进行统计分析。
1.2.8 细胞克隆生成能力检测 采用细胞集落形成实验。首先使用针对TSPAN13特异性si2-RNA对PC3 细胞和DU145 细胞进行沉默处理,取处于对数生长期的各组细胞,用含10%血清的RPMI1640培养液制备成1×103/mL的细胞悬液,取2 mL细胞悬液接种到6孔板中,以十字方向轻轻晃动使细胞分散均匀。将培养皿置37 ℃、5%CO2培养箱中培养5~7 d,当培养皿中出现肉眼可见克隆时,终止培养,4%的多聚甲醛固定,0.1%的结晶紫染液染色,拍照记录实验结果。最终对克隆形成的细胞集落数进行计数统计分析。
1.2.9 细胞迁移能力检测 采用细胞划痕实验。首先使用针对TSPAN13特异性si2-RNA 对PC3细胞和DU145 细胞进行沉默处理,提前用标记笔在6 孔板背面均匀划横线,每隔0.5~1 cm 一横线以方便定位。取对数生长期的各组细胞,用含10%血清的RPMI1640 培养液制备成 1×105/mL 的细胞悬液,取2 mL 细胞悬液接种到6 孔板中,待其融合度达90%以上时用200 µL 的无菌枪头参照垂直于孔板背后的横线进行划痕(注意枪头要垂直划痕,且划痕时里面必须有液体),每个孔划3道。尽量去除脱落的细胞,然后加入2 mL不含血清的RPMI1640培养基,置于37 ℃培养箱中继续培养,分别于划痕后的0、24 h进行取点拍照并保存(必须是同一位置)最终对其迁移距离进行分析。
1.2.10 细胞侵袭能力检测 采用Transwell 实验。首先使用针对TSPAN13特异性si2-RNA 对PC3细胞和DU145 细胞进行沉默处理,取处于对数生长期的各组细胞,用不含血清的RPMI1640 培养液制成密度为1×105/mL 的细胞悬液。采用孔径为8.0 mm 的Transwell 小室,在小室加入50µL 的基质胶后,待其凝固后再加入 200 µL 的细胞悬液,将 750 µL 含20%血清的RPMI1640 培养基分别加入下腔室72 h/120 h 后,对通过膜的细胞用0.1%结晶紫染色,并在荧光显微镜下计数细胞数:随机选取5个视野进行计数并做统计分析。
1.3 统计学方法 采用SPSS25.0 统计软件。计量数据符合正态分布以表示,组间比较采用t检验及方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 生物信息学分析TSPAN13 mRNA 在PCa 中表达 GEO 数据库及TCGA 数据库预测结果证实,TSPAN13 mRNA在PCa样本中表达高于正常前列腺样本(P<0.01),见图1。
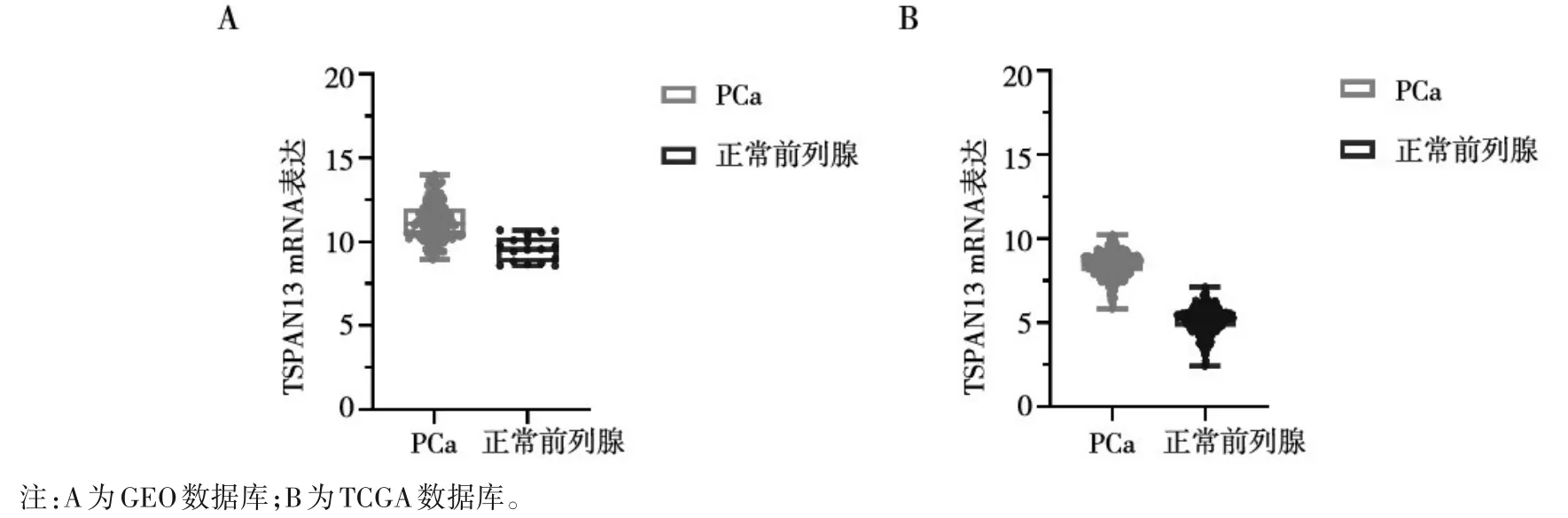
图1 TSPAN13 mRNA在PCa样本和正常前列腺样本中的表达
2.2 IHC 验证生物信息学的分析结果 对分别选取的 20例 PCa 和 BPH 组织切片进行 IHC 染色,结果显示,TSPAN13 在PCa 中的阳性表达率为65%(13/20),在BPH 中的阳性表达率为10%(2/20),相较于BPH,TSPAN13在PCa组织中的阳性表达率增加(P<0.01)。
2.3 人PCa 细胞系(PC3、22Rv1、LNCAP、DU145)、BPH-1 细胞中TSPAN13 mRNA 和蛋白表达 人PCa细胞系 PC3、22Rv1、LNCAP、DU145、BPH-1 细胞中TSPAN13 mRNA 相对表达量分别为6.524±0.077、2.168 ± 0.017、6.635 ± 0.136、4.037 ± 0.057、1.001 ± 0.460,TSPAN13 蛋白相对表达量分别为5.161 ± 0.218、2.437 ± 0.091、3.059 ± 0.289、3.006 ± 0.211、1.000 ± 0.101,TSPAN13 mRNA 在人PCa 细胞系(PC3、22Rv1、LNCAP、DU145)中的表达高于BPH-1 细胞(P均<0.01);TSPAN13 蛋白在人PCa 细胞系(PC3、22Rv1、LNCAP、DU145)中的表达高于BPH-1细胞(P均<0.01)。
2.4 转 染 si-RNA 后 PC3 和 DU145 细 胞 中TSPAN13 mRNA 和蛋白表达 转染si-RNA 72 h 后,PC3 细 胞 中 NC 组 、si1-TSPAN13、si2-TSPAN13 组TSPAN13 mRNA 相对表达量分别为1.002±0.083、0.275 ± 0.053、0.068 ± 0.049,蛋白相对表达量分别为1.000±0.017、0.375±0.056、0.349±0.037,PC3 细胞中 si1-TSPAN13、si2-TSPAN13 组 TSPAN13 mRNA 和蛋白的表达均低于 NC 组(P均<0.01);DU145 细胞中 NC 组、si1-TSPAN13、si2-TSPAN13 组TSPAN13 mRNA 相对表达量分别为1.000±0.031、0.282 ± 0.028、0.196 ± 0.033,蛋白相对表达量分别为1.000±0.039、0.313±0.008、0.063±0.057,在 DU145 细 胞 中 si1-TSPAN13、si2-TSPAN13 组TSPAN13 mRNA 和蛋白表达均低于 NC 组(P均<0.01),且si2-TSPAN13 的沉默效果更明显,差异有统计学意义(P<0.01)。
2.5 沉默 TSPAN13 后 PC3 和 DU145 细胞的增殖能力和克隆形成能力 转染si-RNA 72 h 后,PC3 细胞中 NC 组、si2-TSPAN13 组细胞 OD 值分别为 2.062 ±0.085、1.598 ± 0.016,DU145 细胞中 NC 组、si2-TSPAN13 组 细 胞 OD 值 分 别 为 1.918 ± 0.052、1.071 ± 0.053,在 PC3 细胞中 si2-TSPAN13 组 OD 值低于NC 组(t=15.87,P<0.01);在DU145 细胞中si2-TSPAN13 组 OD 值低于 NC 组(t=21.74,P<0.01)。对转染si-RNA 的细胞进行划痕操作24 h 后,PC3 细胞中NC 组、si2-TSPAN13 组细胞克隆数分别为(906.667 ± 24.379)、(334.667 ± 9.074)个,DU145细胞中NC 组、si2-TSPAN13 组细胞克隆数分别为(1 059.000 ± 58.924)、(747.667 ± 31.817)个,在PC3、DU145 细胞中 si2-TSPAN13 组细胞克隆数低于NC组(P均<0.01)。
2.6 沉默 TSPAN13 后 PC3 和 DU145 细胞的迁移和侵袭能力 转染si-RNA 72 h 后,PC3 细胞中NC 组、si2-TSPAN13 组细胞迁移率分别为(65.997 ±2.899)%、(45.723 ± 2.531)%,DU145 细胞中 NC组、si2-TSPAN13 组细胞迁移率分别为(63.829 ±4.365)%、(27.432 ± 3.508)%,在 PC3 和 DU145 细胞中si2-TSPAN13组细胞迁移率均低于NC组(P均<0.01)。转染 si-RNA72 h 后,PC3 细胞中 NC 组、si2-TSPAN13 组细胞穿膜数分别为(106.400± 9.343)、(4.200 ± 2.490)个 ,DU145 细 胞 中 NC 组 、si2-TSPAN13 组细胞穿膜数分别为(273.800± 9.628)、(52.800 ± 6.535)个,在 PC3 和 DU145 细胞中 si2-TSPAN13组细胞穿膜数均低于NC组(P均<0.01)。
3 讨论
PCa 是男性最常见的癌症之一,其最初发病较为隐蔽,通常随时间的推移会发展为去势抵抗性PCa,在现有诊断和治疗条件下,PCa 患者的生存和预后仍不理想,患者最终会因产生耐药而无法治愈,导致死亡。因此找到PCa相关的异常基因并了解其致病机制,对PCa 的早期诊断和寻找治疗靶点极为重要。从BPH到PCa中最常见的异常基因是雄激素受体(AR)和磷脂酶和张力蛋白同源物(PTEN)。PCa 主要是由AR 信号驱动的细胞生长介导的激素驱动疾病。在PCa 中,雄激素信号传导上调。其在循环雄激素的影响下调节AR 作用,增强与AR 调节的各种基因转录和表达相关的AR 活性,从而影响PCa的发生、发展[11]。
PTEN 是一种肿瘤抑制因子,在PCa 样本中表达下调。PTEN 的下调导致PI3K/Akt 通路的激活从而影响 PCa 的发生、发展[12]。此外 PTEN 的下调还与较高的Gleason 评分、进展风险和治疗后复发以及晚期局部或转移性疾病和死亡相关[13]。此外,TMPRSS2、MYC、SMAD4、EZH2 等基因异常表达构成了基因组多样性启动PCa并推动其进展[14]。
四膜蛋白家族中的部分蛋白,如CD82、CD151和CD81 参与了有机体诸多生理过程,因而受到越来越多关注[15-17]。在体外研究中,TSPAN1 的下调抑制了结肠癌细胞的增殖和侵袭[18],在p53 突变的肺癌细胞中过表达TSPAN2 与癌症的侵袭和转移有关[19],在大鼠胰腺癌、肺癌等模型中,TSPAN8 有助于外泌体诱导的内皮细胞活化[20]。作为四膜蛋白家族的成员,TSPAN13 参与了肿瘤的发生发展。有研究报道,TSPAN13 在乳腺癌中的表达与细胞的增殖和迁移相关[21]。但 TSPAN13 在 PCa 中的表达及其相关功能却鲜见报道。
IHC 实验验证结果显示,TSPAN13 蛋白在PCa中阳性率高于BPH,ARENCIBIA 等[22]研究结果与本研究的结果一致。其次,在PCa 细胞和BPH-1 细胞中通过RT-PCR 和Western blotting 实验验证结果显示,与 BPH-1 细胞相比,TSPAN13 mRNA 和蛋白在PCa细胞中高表达。
TSPAN13 在PCa 中高表达,实验针对TSPAN13的碱基编码序列设计了si-RNA,通过RT-PCR 和Western blotting 两种方法检测序列的特异性,其结果显示,沉默 TSPAN13 后,TSPAN13 mRNA 和蛋白表达均降低,且si2-TSPAN13 的沉默效果优于si1-TSPAN13。因此后续采用si2-TSPAN13 来进行功能试验。
本研究结果表明,沉默TSPAN13 可抑制PC3 细胞和DU145 细胞的增殖和克隆形成能力。沉默TSPAN13 后PC3 细胞和DU145 细胞的迁移和侵袭能力明显下降。
综上所述,沉默TSPAN13 表达可抑制前列腺癌细胞PC3 和DU145 细胞的增殖、克隆生成、迁移、侵袭能力,TSPAN13可能在PCa细胞增殖、迁移和侵袭过程中发挥重要作用。
