血清25(OH)D3、IL-6 在老年冠心病并发衰弱综合征诊断中的价值
2022-08-08马树灿李茹刘智芬肖红英俊岐
马树灿,李茹 ,刘智芬,肖红,英俊岐
1 衡水市人民医院老年医学一科,河北衡水 053000;2 衡水市人民医院中医科
衰弱综合征是一种非特异性状态,老年人由于生理储备功能下降和抗压能力减弱,衰弱性增加,易发生衰弱综合征。据估计,全球衰弱综合征发病率在3.5%~27.3%[1],衰弱综合征可增加罹患其他疾病的风险,降低患者生存质量,严重者可引起患者死亡[2]。冠状动脉粥样硬化性心脏病(CHD)是老年人常见的心血管疾病,亦是导致老年人住院和死亡的主要原因,合并衰弱综合征的CHD 患者共病(高血压、脑卒中、跌倒、残疾、焦虑/抑郁)率增加,进展为痴呆、残疾,丧失生活独立能力的风险明显增高[3]。维生素D 是一种脂溶性维生素,在维持或改善老年人肌肉力量、身体机能和独立方面具有重要作用[4]。白细胞介素-6(IL-6)是一种典型的促炎因子。研究表明,高IL-6 水平与前列腺癌患者衰弱综合征的进展有关[5]。2019年2月—2022年2月,我们分析血清25-羟维生素 D3[25(OH)D3]、IL-6 对老年 CHD 患者并发衰弱综合征的诊断价值,以期为临床诊治提供参考。
1 资料与方法
1.1 临床资料 选择 2019 年 2 月—2022 年 2 月于衡水市人民医院老年病一科门诊就诊或住院的381例老年CHD 患者为研究对象。纳入标准:①冠状动脉造影显示1支或以上冠状动脉狭窄,符合《心血管疾病防治指南和共识2011》诊断标准[6];②年龄≥60岁;③美国纽约心脏病协会(NYHA)分级Ⅰ~Ⅱ级。排除标准:①严重精神疾病、脑卒中后失语、失聪、偏瘫无法完成量表筛查;②住院期间死亡患者或病情不稳定患者;③合并恶性肿瘤患者。本研究获衡水市人民医院伦理委员会批准,患者均知情同意并签署同意书。
1.2 衰弱综合征评估和分组 患者入组后均采用Fried 衰弱表型评分[7]评估衰弱状态。CHS 衰弱评分包括体质量下降、疲乏、肌力、步速、体力活动5项内容,总分0~5分,0分为健康,1~2分为衰弱前期,3分及以上为衰弱期。根据Fried衰弱评分将患者分为衰弱组(≥1分)和非衰弱组(<1分)。
1.3 基线资料收集 包括年龄、性别、受教育年限、体质量指数(BMI)、吸烟史、饮酒史、基础疾病、既往病史(手术史、1 年内跌倒史、多重用药史)]、营养状态[营养风险筛查表-2002(NRS-2002)[8],NRS2002评分<3分为无营养风险,NRS2002评分≥3分表示存在营养风险]、查尔森共病指数(CCI)[0-37 分,评分越高,共病指数越高[9]]、肌少症(参考2014 年亚洲肌肉减少症工作小组制定的诊断标准[10])、焦虑[焦虑自评量表(SAS),SAS 评分50 分以上视为患有焦虑[11]]、抑郁[抑郁自评量表(SDS),SDS 评分53 分以上视为患有抑郁[12]]。
1.4 实验室检查 门诊患者就诊当日、住院患者住院后次日晨采集肘静脉血3 mL 注入干燥试管,待血液凝固后取上层液离心处理,分离血清上机检测。采用AU5800(美国贝克曼库尔特公司)检测总胆固醇(TC)、甘油三酯(TG)、白蛋白、血肌酐(Scr)。选择Access2 全自动化学发光仪(美国贝克曼库尔特公司),应用电化学发光法测定血清25(OH)D3水平。选择上转发光免疫分析仪(北京热景公司),采用酶联免疫吸附试验检测血清IL-6。选择法国梅里埃免疫分析仪,采用酶联免疫吸附试验检测血清脑钠肽(BNP)。
1.5 统计学方法 采用SPSS25.0统计软件。计量资料符合正态分布以表示,比较采用t检验。计数资料以例(%)表示,比较采用χ2检验。多因素Logistic回归分析老年CHD患者并发衰弱综合征的影响因素;采用受试者工作特征(ROC)曲线分析25(OH)D3、IL-6诊断老年CHD患者并发衰弱综合征的价值。P<0.05为差异有统计学意义。
2 结果
2.1 患者基线资料比较 根据Fried衰弱评分将患者分为衰弱组133例和非衰弱组248例。衰弱组年龄、受教育年限比较差异有统计学意义(P均<0.05),女性、近1 年内跌倒史、多重用药史、有营养不良风险、肌少症、焦虑、抑郁比例高于非衰弱组(P均<0.05),CCI指数高于非衰弱组(P<0.05),其他指标比较差异无统计学意义(P均>0.05),见表1。
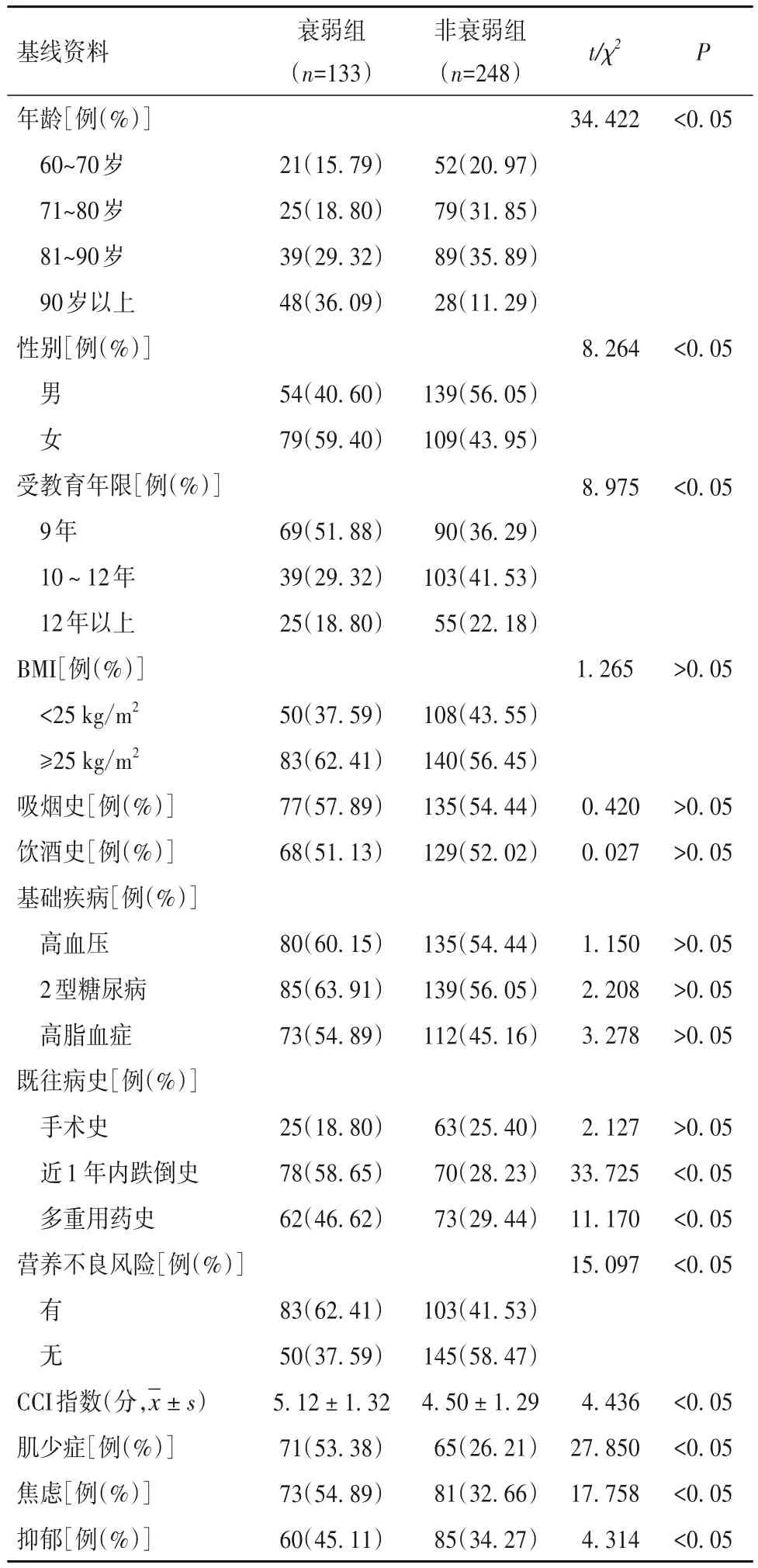
表1 两组基线资料比较
2.2 两组实验室指标比较 衰弱组血清Scr、IL-6、BNP 水平高于非衰弱组(P<0.05),血清白蛋白、25(OH)D3水平低于非衰弱组(P均<0.05),两组血清TG、TC 水平比较差异无统计学意义(P均>0.05),见表2。
表2 两组实验室指标比较()
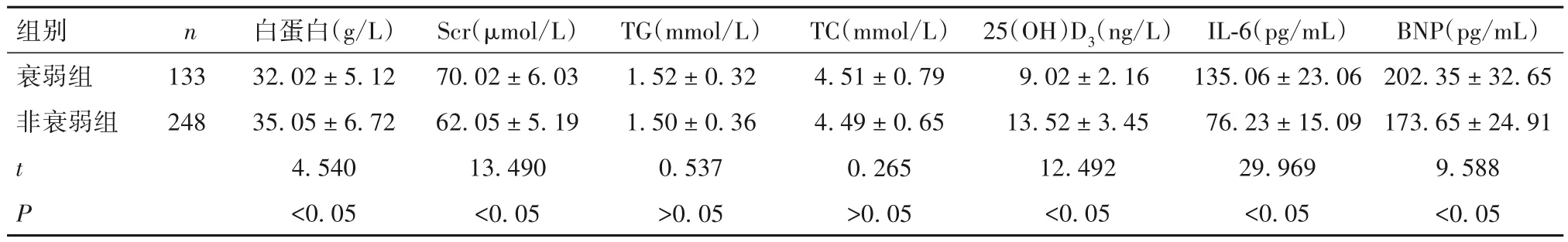
表2 两组实验室指标比较()
组别 n衰弱组非衰弱组133 248 t P白蛋白(g/L)32.02±5.12 35.05±6.72 4.540<0.05 Scr(µmol/L)70.02±6.03 62.05±5.19 13.490<0.05 TG(mmol/L)1.52±0.32 1.50±0.36 0.537>0.05 TC(mmol/L)4.51±0.79 4.49±0.65 0.265>0.05 25(OH)D3(ng/L)9.02±2.16 13.52±3.45 12.492<0.05 IL-6(pg/mL)135.06±23.06 76.23±15.09 29.969<0.05 BNP(pg/mL)202.35±32.65 173.65±24.91 9.588<0.05
2.3 老年CHD 患者并发衰弱综合征的影响因素 以年龄、受教育年限、性别、近1 年内跌倒史、多重用药史、有营养不良风险、肌少症、焦虑、抑郁、CCI 指数、Scr、IL-6、白蛋白、BNP、25(OH)D3为自变量,以老年CHD 患者并发衰弱综合征因变量,向后逐步法排除无关变量(入α=0.05,出α=0.10),最终年龄高、近1年内跌倒史、CCI指数高、焦虑、肌少症、IL-6水平高是老年CHD患者并发衰弱综合征的危险因素(P均<0.05),25(OH)D3是老年CHD 患者并发衰弱综合征的保护因素(P<0.05),见表3。
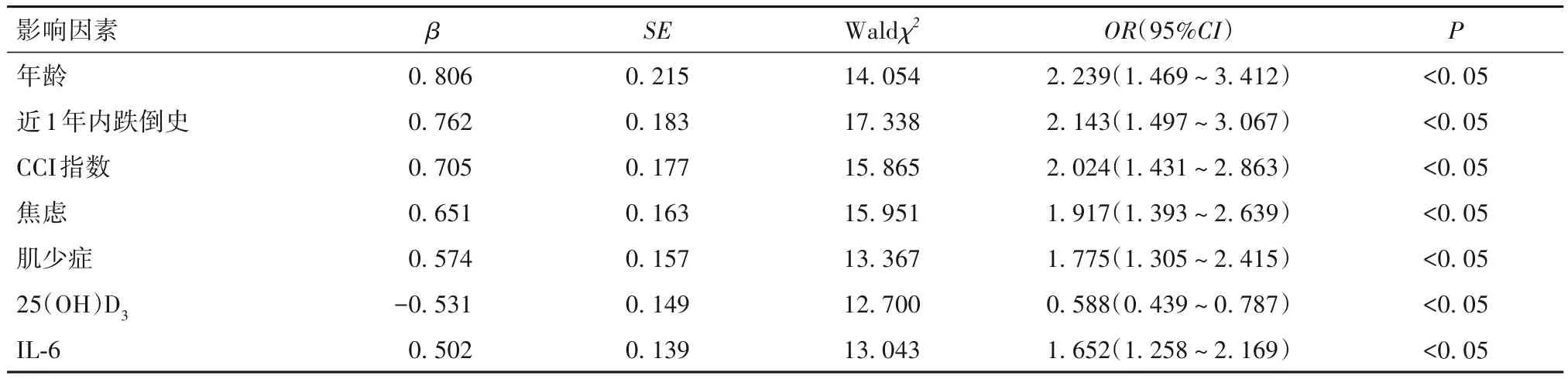
表3 老年CHD患者并发衰弱综合征的Logistic回归分析结果
2.4 25(OH)D3、IL-6 诊断老年 CHD 患者并发衰弱综合征的价值 25(OH)D3、IL-6 诊断老年 CHD 患者并发衰弱综合征的最佳截断值分别为11.51 ng/L、109.35 pg/mL,曲线下面积(AUC)分别为 0.695、0.718,联合25(OH)D3、IL-6诊断老年CHD患者并发衰弱综合征的AUC为0.907,高于25(OH)D3、IL-6单独诊断(Z分别为7.556、6.904,P均<0.05),见表4。
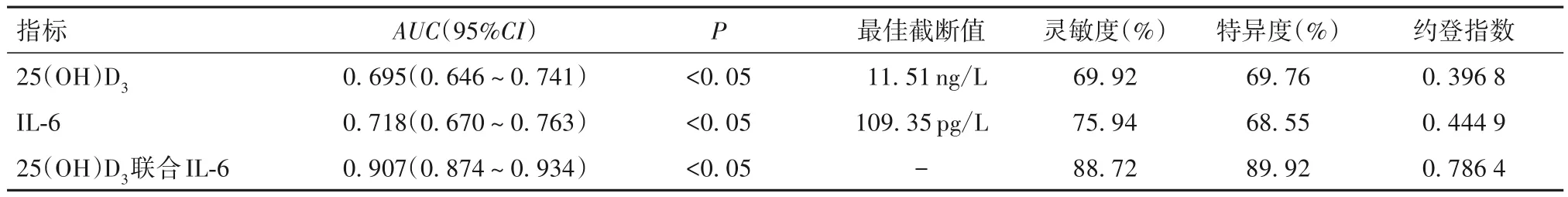
表4 25(OH)D3、IL-6诊断老年CHD患者并发衰弱综合征的效能
3 讨论
衰弱综合征的特征是个体体内储备减少、身体机能衰退导致应对内源性和(或)外源性压力源的脆弱性增强,衰弱综合征是老年CHD 患者预后不良的一个强有力预测因子。研究显示,衰弱综合征与老年急性冠脉综合征患者住院期间发生心律失常、医院获得性肺炎、住院死亡率、发病30 d内病死率和发病30 d 内再入院有关[13]。国外报道显示,越南老年急性冠脉综合征患者衰弱综合征发病率为48.1%(156/324)[14]。国内李鑫等[15]报道,老年稳定性冠状动脉粥样硬化性心脏病患者合并衰弱综合征的发病率为52.48%(53/101)。翟红丽等[16]报道显示,老年CHD 患者合并衰弱综合征的发病率为33.79%(49/145)。本研究中老年CHD 患者衰弱综合征的发病率为34.91%(133/381),与翟红丽等[16]报道结果一致,低于李鑫等[15]和越南地区[14]报道,可能与地区差异或样本偏差有关。
本研究结果显示,年龄、近1年内跌倒史、CCI指数、焦虑、肌少症、25(OH)D3、IL-6 是老年CHD 患者并发衰弱综合征的危险因素。单因素分析结果显示,老年CHD 患者衰弱综合征发病率随着年龄的增长而增加,其中90 岁以上衰弱综合征的发病率达50%。研究显示,老年人是衰弱综合征的高发人群,当老年人暴露于压力源时常常会出现衰弱状态,增加不良健康结果[17]。跌倒是老年人最常见的致死、致残受伤因素之一,据统计,老年人中24.2%有跌倒史,8.3%有严重跌倒史[18]。衰弱综合征老人存在行走困难和更高的跌倒风险,合并衰弱综合征老人跌倒发生率高达6.7%~44%[19]。本研究衰弱组近1年内跌倒史比例高于非衰弱组,表明近期跌倒史与衰弱综合征的发生密切相关。共病指同时存在两种或以上的慢性疾病,老年人多合并高血压、冠心病、糖尿病等多种基础疾病,导致不良事件和死亡风险增加。荟萃分析结果显示,衰弱综合征患者共病患病率为72%,共病患者衰弱综合征患病率为16%,共病和衰弱之间存在双向关联性[20]。欧洲一项横断面研究显示,共病和衰弱综合征往往同时存在,女性衰弱综合征和共病的患病率更高[21]。焦虑是老年人常见的精神障碍,CHD 患者发病入院时焦虑发病率为42.6%,并随时间推移而增高[22],伴有焦虑的老年人衰弱前期和衰弱综合征患病率普遍较高,焦虑与我国老年人衰弱综合征有关[23]。肌少症是衰弱综合征的主要组成部分,是老年人发病、残疾和死亡的强有力预测因子,衰弱综合征患者多伴低肌肉质量和力量,肌少症被认为是衰弱综合征的先兆表现[24]。肌少症和衰弱综合征发病机制:随着年龄增长免疫功能逐渐下降,进而介导中性粒细胞功能障碍,中性粒细胞中磷酸肌醇3 激酶-蛋白激酶B 信号通路失调,导致机体慢性炎症状态,导致肌少症和衰弱综合征[25]。
维生素D 90%由阳光照射时皮肤合成,10%由饮食摄入,其前体是7-脱氢胆固醇(维生素D3原),由肝脏从胆固醇合成,在皮肤中先转化为维生素D3前体,再在太阳照射下转化为胆钙化醇(维生素D3),维生素D 与维生素D 结合蛋白结合通过肝脏代谢成无生物活性的25(OH)D3或骨化二醇,后被转运到肾脏经25-羟基维生素D1-羟化酶或1-α-羟化酶代谢成具有生物活性的1,25-二羟基维生素D[1,25(OH)2D)]或骨化三醇[26]。
本研究衰弱组血清25(OH)D3水平低于非衰弱组,25(OH)D3缺乏是老年CHD 患者并发衰弱综合征的危险因素,证明维生素D 缺乏与老年CHD 患者并发衰弱综合征有关,可能机制:维生素D 受体在肌细胞、成肌细胞、骨骼肌细胞核中表达,活性维生素D通过与其受体结合调节钙和磷酸盐稳态以及肌肉细胞增殖和分化,维生素D缺失与体质量减少、肌肉质量减少、握力和运动能力降低有关[26]。维生素D 状态与衰弱综合征之间联系很大程度上是由肌少症发展介导,VAN 等[27]报道指出,较高的维生素 D水平与较低的衰弱综合征患病率相关。
炎症反应是一种可能与衰弱综合征密切相关的潜在病理生理变化,促炎细胞因子可通过促进蛋白质降解或通过影响代谢途径导致衰弱综合征的发生[28]。IL-6 是维持体内平衡的典型细胞因子,当机体感染或组织损伤时,IL-6 大量合成并通过激活急性期和免疫反应启动宿主防御反应,IL-6 过度合成可导致急性全身炎症反应综合征和免疫介导的慢性疾病[29]。本研究发现,血清IL-6 水平升高与老年CHD 患者并发衰弱综合征发生有关。TEMBO 等[29]检测了581例老年男性血清IL-6 水平,发现高IL-6水平与衰弱综合征发生呈正相关。IL-6参与衰弱综合征机制[30]:首先,IL-6通过促进骨骼肌蛋白水解和诱导胰岛素抵抗导致肌肉萎缩;其次,IL-6升高促使活性氧形成,进一步激活泛素-蛋白酶体系统叉头盒O3a 促进肌肉蛋白水解;第三,IL-6 可诱导核糖体S6激酶信号转导,下调转录蛋白激活因子,促使肌细胞生长因子磷酸化,导致骨骼肌细胞萎缩。ROC 曲线分析结果显示,25(OH)D、IL-6 诊断老年 CHD 患者并发衰弱综合征具有一定价值,联合两项指标后诊断效能明显提高,表明25(OH)D、IL-6 可作为老年CHD患者并发衰弱综合征的潜在生物学标志物。
综上所述,年龄高、近1 年内跌倒史、CCI 指数高、焦虑、肌少症、IL-6 水平高是老年CHD 患者并发衰弱综合征的危险因素,25(OH)D3水平高是保护因素;血清 25(OH)D3、IL-6 联合诊断老年 CHD 患者并发衰弱综合征有较高价值。
