重复经颅磁刺激通过抑制线粒体凋亡途径对缺血再灌注大鼠脑组织损伤的干预作用▲
2022-08-08方增焜李昌柳黄东挺江文宇
方增焜 黄 永 李昌柳 黄东挺 江文宇 董 奎
(1 广西中医药大学附属国际壮医医院康复医学科,南宁市 530000; 广西壮族自治区江滨医院2 物理治疗科,3 科教部,4 神经康复科,南宁市 530000)
缺血性脑卒中是导致人类死亡和残疾的主要原因,老年人受到的影响尤为严重[1]。缺血性脑卒中是由于脑血管系统闭塞,导致流向大脑某一区域的血液减少或停止,从而引起脑组织缺氧和坏死。脑组织缺血再灌注后,线粒体产生过量的活性氧,进一步损害脑细胞;同时,胶质细胞被激活后释放炎症细胞因子,并在梗死核心周围形成瘢痕。梗死核心周围是被称为“半暗带”的危险组织区域,是缺血性脑卒中研究的主要目标[2]。
经颅磁刺激是利用脉冲磁场作用于大脑中枢神经系统,在大脑的特定区域内诱导电流,通过改变刺激频率可达到兴奋或抑制局部大脑皮质的作用。这种感应电流可以抑制较低频率的神经活动,同时可以刺激较高频率的神经活动[3]。近年来,重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)在成瘾性疾病、抑郁症、帕金森病、精神分裂症和脑卒中等疾病中的治疗潜力逐渐受到重视[4]。研究表明,脑卒中患者经rTMS治疗后运动功能得到显著改善[5],这为脑卒中患者的康复带来了希望。然而,rTMS治疗的细胞和分子学作用机制仍不清楚。本研究建立大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)大鼠模型,探讨rTMS对缺血性脑卒中的作用机制。
1 材料与方法
1.1 实验动物 18只雄性健康SD大鼠购于广西医科大学实验动物中心(动物生产许可证号:SCXK桂2014-0001),体重220~250 g,7~8周龄,适应性饲养1周,室温(25±2) ℃,湿度40%~60%,自由饮水进食。将大鼠按照随机数字表法分为假手术组、缺血再灌注组、缺血再灌注+rTMS组,每组6只。
1.2 试剂和仪器 主要试剂:原位细胞死亡检测试剂盒(Roche Applied Science公司,批号:11684817910),二喹啉甲酸试剂盒(北京普利莱基因技术有限公司,批号:2500T),GAPDH抗体(Santa Cruz公司,批号:sc-25778),Caspase-9抗体(武汉博士德生物工程有限公司,批号 :A00080-7),细胞色素C(cytochrome C,CytC)抗体(Thermo Fisher Scientific公司,批号:45-6100),B细胞淋巴瘤2相关X蛋白(B-cell lymphoma-2-associated X protein,Bax)抗体(武汉博士德生物工程有限公司,批号:A00183),小鼠抗免IgG二抗(武汉博士德生物工程有限公司,批号 :BM2020)。主要仪器:磁场刺激仪(依瑞德集团,YRDCCY-Ⅰ型),透射电子显微镜(日本Hitachi公司,型号:H-9500),电泳仪(Bio-Rad公司,型号:1645050)。
1.3 大鼠MCAO模型的建立 通过腹腔注射氯胺酮(40 mg/kg)和甲苯噻嗪(10 mg/kg)进行麻醉,观察无夹爪反射即可进行后续手术操作,术中维持麻醉时上述药物浓度减半,围术期监测大鼠的体温、呼吸频率。常规备皮、消毒后,行颈中线垂直切口,显露右侧颈总动脉,分离颈内动脉,使用动脉夹夹闭颈总动脉和颈内动脉。然后分离颈外动脉,双线结扎颈外动脉并剪断(留3~4 mm),在距颈总动脉分叉约5 mm处,剪一斜行45°小口剪口,插入单丝尼龙缝合线栓,松开颈总动脉动脉夹,至颈总动脉分叉口后将颈外动脉和线栓逆时针旋转,使线栓进入颈内动脉,松开颈内动脉动脉夹,继续进线至大脑中动脉,当感觉到阻力时停止插入,插入深度约为19 mm。闭塞2 h后拔出线栓再灌注,最后结扎切口,缝合皮肤。假手术组大鼠除不插线栓外,其他操作均一致。在整个手术、闭塞和再灌注过程中,用直肠体温计监测大鼠体温,并通过平板热垫维持在大鼠体温在36.0 ℃~38.0 ℃之间。待大鼠麻醉苏醒后,将其送回笼中,自由获得食物、水。
1.4 干预方法 (1)缺血再灌注+rTMS组:使用带有70 mm 8字形线圈的磁场刺激仪,对大鼠进行rTMS。线圈位于大鼠眼睛和耳朵之间的背中央,线圈手柄垂直于大鼠的身体轴,在手术结束后2 h即进行第1次治疗,刺激频率为0.5 Hz,强度为70%最大输出强度,连续刺激20次为1组,2组/d,于大鼠处死前1日结束治疗。(2)假手术和缺血再灌注组:将线圈放置在靠近大鼠头部且背对大鼠头部的位置,以确保听觉条件相似,但不进行电磁刺激,余处理同缺血再灌注+rTMS治疗组。
1.5 运动功能评估 分别于术后第1、3、7天,采用改良神经功能缺损评分(modified Neurological Severity Score,mNSS)[6]评估各组大鼠的运动功能。mNSS包括运动试验、感觉试验、平衡木试验、反射缺失和异常运动。总分18分,评分越高,神经功能损害越严重。
1.6 脑组织病理学改变 在术后第7天,各组随机取3只大鼠,断颈法处死后立刻取出脑组织,利用冷冻切片机制作8 μm厚的冠状切片。切片经苏木精染色5 min后,1%盐酸乙醇分化5 s,将切片置于氨水中10 s,伊红染色3 min,脱水,用乙醇和二甲苯清除,最后用中性香脂密封。显微镜下观察大鼠缺血脑组织的病理学改变。
1.7 透射电镜观察缺血周围皮层组织中的线粒体结构 在术后第7天,断颈法处死各组剩余3只大鼠,取出大脑,解剖右侧部分大脑缺血周围皮层组织(假手术组取相应区域的脑组织),用1%四氧化锇和1%亚铁氰化物固定90 min,经磷酸缓冲盐溶液洗涤后,采用乙醇和丙酮分级脱水,然后用树脂包埋。制备超薄切片,醋酸铀酰和柠檬酸铅染色。在透射电子显微镜下观察皮层组织的线粒体超微结构。
1.8 检测细胞凋亡 取1.7中右侧剩余缺血周围皮层组织制作冷冻切片,使用原位细胞死亡检测试剂盒进行末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling,TUNEL)染色,以评估神经元凋亡情况。先用10%福尔马林固定冷冻切片24 h,然后用TBS冲洗3次,每次5 min;用2% H2O2孵育切片10 min,用TBS洗涤3次,每次5 min,与TUNEL反应混合物酶反应,然后将切片放于37 ℃的湿盒子孵育1 h,用TBS冲洗3次,每次5 min。最后,将新鲜制备的3,3-二氨基联苯胺溶液直接加入组织切片中,使用苏木精进行复染。最后,用DM2500型荧光显微镜(Leica公司)观察细胞凋亡情况。脑组织细胞凋亡率(%)=(阳性细胞数/总细胞数)×100%。
1.9 Western blot检测相关蛋白的表达 取1.7中缺血脑组织进行匀浆并溶解在含有1 mmol/L苯甲基磺酰氟、2%蛋白酶和磷酸酶抑制剂混合物的冰冷RIPA裂解缓冲液中。采用二喹啉甲酸法测量蛋白浓度。通过10%~15%的SDS-PAGE分离等量(20~40 μg)的蛋白后,进行电转印将蛋白转至PVDF膜上,再用含脱脂牛奶的TBS封闭PVDF膜(pH值7.4)1 h,然后一抗4 ℃孵育过夜,抗体稀释比例如下:GAPDH为1 ∶2 000,Caspase-9、Bax为1 ∶500,CytC为1 ∶1 000。用TBST冲洗PVDF膜3次(5 min/次)后,用相应的二抗(1 ∶5 000)在室温下孵育90 min。最后用TBST洗膜3次(5 min/次)后,利用ECL发光液(普利莱公司,批号:P1020),进行X胶片曝光,最后用ImageJ软件检测相关蛋白的相对表达量。
1.10 统计学分析 采用GraphPad Prism 8软件进行统计分析和作图。正态分布的计量资料以(x±s)表示,多组间的比较采用方差分析(两两比较采用LSD-t检验),重复测量资料的比较采用重复测量方差分析;非正态分布的计量资料以M(Q)表示,组间比较采用秩和检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 3组大鼠的运动功能变化 3组间的mNSS差异有统计学意义(F组间=539.843,P组间<0.001),术后各时间点其余两组的mNSS均高于假手术组,而第7天缺血再灌注+rTMS组mNSS低于缺血再灌注组(P<0.05);3组的mNSS均有随时间下降的趋势(F时间=230.515,P时间<0.001);分组与时间有交互效应(F交互=8.118,P交互<0.001)。见表1。

表1 3组大鼠mNSS的比较(x±s,分)
2.2 3组大鼠脑组织的病理学改变 缺血再灌注组大鼠出现较大的脑缺血梗死面积,而缺血再灌注+rTMS组大鼠的梗死区域较缺血再灌注组明显缩小,见图1A。此外,HE染色结果显示,假手术组大鼠脑组织结构、细胞形态正常,缺血再灌注组大鼠脑组织出现组织疏松、细胞稀疏、肿胀等异常表现,而缺血再灌注+rTMS组大鼠脑组织上述异常表现减轻,见图1B。
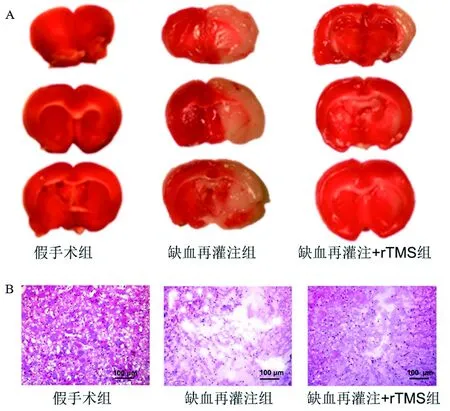
图1 3组大鼠脑组织大体和镜下病理表现(HE染色,×40)
2.3 3组大鼠脑缺血周围皮层组织中的线粒体结构 假手术组大鼠大脑神经细胞出现含高致密基质的线粒体,线粒体结构完整而且外膜光滑无肿胀;缺血再灌注组大鼠的大部分大脑神经细胞线粒体肿胀伴低致密基质,结构破坏明显,数目显著减少,棘突排列紊乱,线粒体膜破损严重,呈现线粒体空泡化的趋势;而缺血再灌注+rTMS组大鼠的线粒体异常形态表现较缺血再灌注组减轻。见图2。
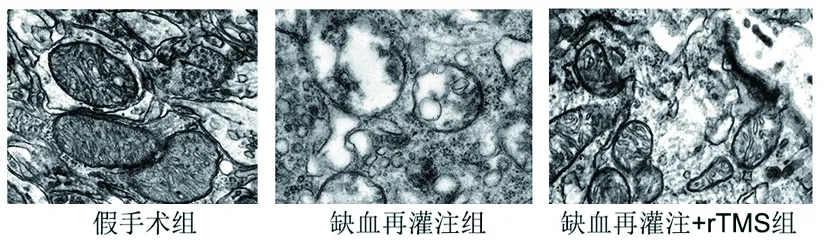
图2 3组大鼠缺血周围皮层组织中的线粒体结构
2.4 3组大鼠脑缺血周围皮层组织中神经细胞凋亡情况 假手术组仅可见个别凋亡神经细胞,缺血再灌注组的神经细胞凋亡明显增多,而缺血再灌注+rTMS组的神经细胞凋亡情况较缺血再灌注组减轻,见图3。假手术组、缺血再灌注组、缺血再灌注+rTMS组的脑组织细胞凋亡率分别为0.65(1.33)%,75.45(17.03)%,51.40(18.43)%,组间差异有统计学意义(H=14.360,P=0.001),其中缺血再灌注组的细胞凋亡率高于假手术组,而缺血再灌注+rTMS组的细胞凋亡率低于缺血再灌注组(均P<0.05)。

图3 3组大鼠神经细胞凋亡情况
2.5 3组大鼠缺血脑组织中线粒体凋亡通路关键蛋白的表达情况 缺血再灌注组大鼠缺血脑组织的Caspase-9、CytC、Bax的蛋白表达量均高于假手术组(均P<0.05);缺血再灌注+rTMS组大鼠缺血脑组织的CytC、Bax的蛋白表达量均低于缺血再灌注组(均P<0.05),但两组间Caspase-9的蛋白表达量差异无统计学意义(P>0.05)。见图4和表2。
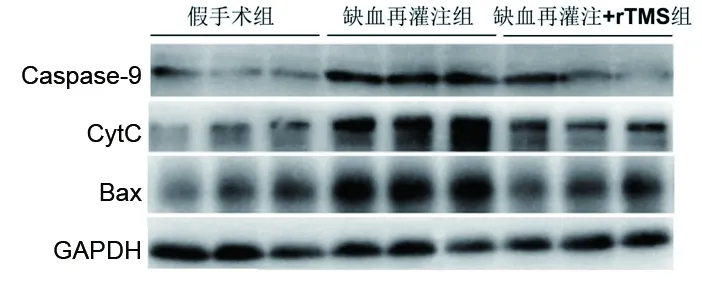
图4 3组Caspase-9、CytC、Bax蛋白表达情况
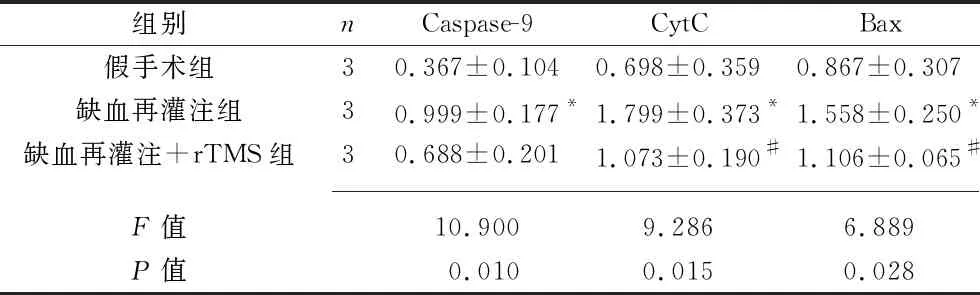
表2 3组大鼠Caspase-9、CytC、Bax蛋白相对表达量的比较(x±s)
3 讨 论
缺血性脑卒中是导致我国中老年人身体残疾的主要原因,脑卒中后偏瘫降低了患者的生活质量,给家庭和社会造成了重大的经济负担。目前康复治疗是治疗脑卒中所致神经功能障碍的主要方法[7]。本研究采用MCAO法建立缺血再灌注大鼠模型,术后缺血再灌注组大鼠的mNSS高于假手术组(P<0.05),并出现较大的脑缺血梗死面积,这提示建模成功;而与缺血再灌注组相比,缺血再灌注+rTMS组大鼠术后第7天的mNSS降低(P<0.05),脑缺血梗死面积减小,组织疏松、细胞稀疏、肿胀等异常表现减轻,这提示rTMS对脑缺血再灌注损伤具有治疗作用,能够减小脑组织的缺血面积,改善神经功能缺损,这与既往针对慢性脑卒中患者的研究结果[5]相似。
发生缺血再灌注损伤时,线粒体是细胞存活的关键调节器,线粒体功能障碍可通过各种分子机制加重缺血性神经元损伤,因此靶向干预线粒体可能是治疗缺血再灌注损伤的有效方案[8]。Andrabi等[9]给予缺血再灌注损伤大鼠普拉克索进行干预,发现其可通过抑制CytC从线粒体向细胞质的转移,从而抑制线粒体膜通透性,从而促进缺血再灌注损伤大鼠的神经功能恢复。已有研究报告,rTMS可通过增强脑源性神经营养因子/原肌球蛋白相关激酶B信号通路的表达,以及抗凋亡机制,促进运动功能的恢复[10-11]。本研究从线粒体凋亡途径探讨rTMS治疗脑缺血再灌注损伤的可能机制,结果显示,缺血再灌注组大鼠脑缺血周围皮层组织中的细胞凋亡率升高,大部分线粒体肿胀伴低致密基质,结构破坏明显,数目显著减少,棘突排列紊乱,线粒体膜破损严重,呈现线粒体空泡化的趋势,而缺血再灌注+rTMS组大鼠脑缺血周围皮层组织中的细胞凋亡率降低,上述异常表现均明显减轻。这提示rTMS可以逆转缺血再灌注损伤导致的脑组织线粒体结构破坏与凋亡,这为rTMS在缺血性脑卒中的应用提供了理论支持。
脑神经细胞凋亡是脑缺血基本病理过程,其中Caspase-9、CytC、Bax是经典的凋亡标志分子。B细胞淋巴瘤(B-cell lymphoma,Bcl)-2蛋白家族成员可调控蛋白质从线粒体内外膜间隙释放到胞质。Bcl-2家族中的促凋亡蛋白Bax通常定位于胞质或松散地附着于线粒体,在缺血时发生构象变化,导致其移位、寡聚并插入线粒体外膜。这些Bcl-2相关蛋白(Bcl-2、Bcl-2L1、Bax和Bcl-2拮抗/杀伤因子1)在缺血再灌注导致的神经元死亡中调节线粒体外膜的通透性,并且刺激线粒体释放CytC,CytC通过凋亡蛋白酶激活因子-1的多聚化与Caspase-9形成凋亡小体,导致下游胱天蛋白酶的级联反应[12-13]。本研究通过Western blot发现,缺血再灌注可促进凋亡蛋白Bax、CytC、Caspases-9的表达升高,而rTMS可降低CytC、Bax蛋白的表达(P<0.05)。这进一步印证了rTMS可以通过抑制线粒体凋亡途径实现对缺血再灌注损伤的干预作用。
总之,rTMS能够改善缺血再灌注引起的大鼠神经功能缺损,其可能通过抗线粒体凋亡而发挥作用,这为rTMS在脑卒中治疗中的作用提供了理论依据。然而,本文只从线粒体凋亡途径探索其内在机制,而rTMS广泛刺激颅脑,无特定靶向性[14],因此rTMS的神经保护作用可能是多机制共同作用的结果,后续研究可以探索更多的潜在治疗机制,发现新的治疗靶点,拓展rTMS在颅脑神经损伤方面的应用。
