胃癌组织中COX-2蛋白、UHRF1蛋白表达及其与胃癌患者临床病理特征的相关性分析
2022-08-08张凯高建华路志宇谢元元
张凯 高建华 路志宇 谢元元
(榆林市第一医院,(1.普通外科二病区;(2.消化内科,陕西 榆林 719000)
研究[1]证实,环氧化酶2(COX-2)在肿瘤的发生、发展中具有重要作用,且在消化道大部分肿瘤中有过度表达。泛素样含PHD和环指域蛋白1(UHRF1)属于表观遗传学调节因子,主要与细胞生长有关,现有研究[2-3]发现其在喉癌、肺腺癌等肿瘤疾病的发生发展过程具有重要的作用。本文主要探讨胃癌组织中COX-2蛋白、UHRF1表达及其与胃癌患者临床病理特征的相关性。
1 资料与方法
1.1一般资料 选取2016年5月至2019年4月于我院普通外科就诊的124例胃癌患者作为研究对象。纳入患者符合胃癌相关诊断标准[4],并经影像学及病理活检证实者;患者TNM分期:Ⅰ~Ⅳ期;凝血及造血功能正常;未合并其他肿瘤者;患者均经外科手术切除治疗,且术前均未行放化疗。已排除转移情况或胃癌分期存在分歧者;既往胃部手术史者;临床资料不完整,伴有严重脏器功能不全、精神性疾病、认知功能以及交流障碍等的患者;出现肝肾肺等远处转移,无法耐受手术切除治疗者;胸膜粘连、肺脓肿等导致邻近脏器转移者;手术未能顺利完成或术中切除脾脏者。纳入患者中,男95例,女29例;年龄(59.14±6.79)岁;肿瘤≤5 cm 86例,肿瘤>5 cm 38例;局部浸润深度T1+242例,T3+482例;高分化5例,中分化39例,低分化80例;伴淋巴结转移63例,无淋巴结转移61例;临床病理分期:Ⅰ~Ⅱ期70例,Ⅲ~Ⅳ期54例;病变部位:胃体癌28例,胃食管交界癌96例。患者均对本研究知情同意,并经我院医学伦理研究协会同意。
1.2方法 患者均经外科手术切除治疗,并于手术中留取距肿瘤边缘>1 cm处的胃癌组织以及距肿瘤边缘5 cm处的癌旁组织,常规脱水,石蜡包埋,连续切片(厚度4 μm)。COX-2蛋白及UHRF1蛋白的表达水平均采用免疫组织化学法(SP法)进行检测,主要试剂包括鼠抗人UHRF1的多克隆抗体及免疫组化染色试剂盒(英国Abcam公司),鼠抗人COX-2单克隆抗体及免疫组化染色试剂盒(美国Cay-man公司),DAB显色试剂盒、SP免疫组化试剂盒、磷酸缓冲盐溶液(PBS)均由武汉博士德生物工程有限公司提供。实验步骤参照试剂盒说明书进行,以试剂公司提供的阳性照片作阳性对照。
1.3结果判定 采用双盲法进行判定,依据每个点的阳性染色细胞构成比和染色强度进行评分和判读。COX-2的判定:无色0分,浅黄色1分,棕黄色2分,棕褐色3分;阳性细胞<5% 0分,阳性细胞构成比为5%~25% 1分,阳性细胞构成比为26%~50% 2分,阳性细胞构成比为51%~75% 3分,阳性细胞构成比为>75% 4分。根据染色强度分值与阳性细胞百分比分值的乘积判定,阴性(-):0~1分,弱阳性(+):2~3分,中等阳性(++):4~6分,强阳性(+++):6分以上。UHRF1的判定:无色0分,浅黄色1分,浅黄色和棕黄色之间2分,深黄色3分,阳性染色细胞构成比为0为0分,阳性细胞构成比为0%~25% 1分,阳性细胞构成比为25%~50% 2分,阳性细胞构成比为50%~75% 3分,阳性细胞构成比为>75% 4分。根据染色强度分值与阳性细胞百分比分值的乘积判定,阴性(-):0分,弱阳性(+):1~4分,中等阳性(++):5~8分,强阳性(+++):9~12分。
1.4统计学方法 采用SPSS21.0软件对数据进行分析,计数资料使用频数表示,行χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1COX-2蛋白及UHRF1蛋白 胃癌组织中COX-2蛋白表达阳性率为66.94%,高于癌旁组织的22.58%(χ2=54.669,P<0.05);HRF1蛋白表达阳性率为65.32%,高于癌旁组织的48.39%(χ2=27.811,P<0.05)。见表1。

表1 COX-2蛋白及UHRF1蛋白在胃癌组织及癌旁组织中的比较[n(%),N=124]
2.2相关性分析 COX-2蛋白表达与局部浸润程度、是否淋巴结转移、临床分期有关(χ2=8.231、14.09、11.622,P均<0.05);UHRF1蛋白表达与肿瘤大小、局部浸润程度、是否淋巴结转移、临床分期有关(χ2=11.201、8.788、16.66,P均<0.05)。见表2。
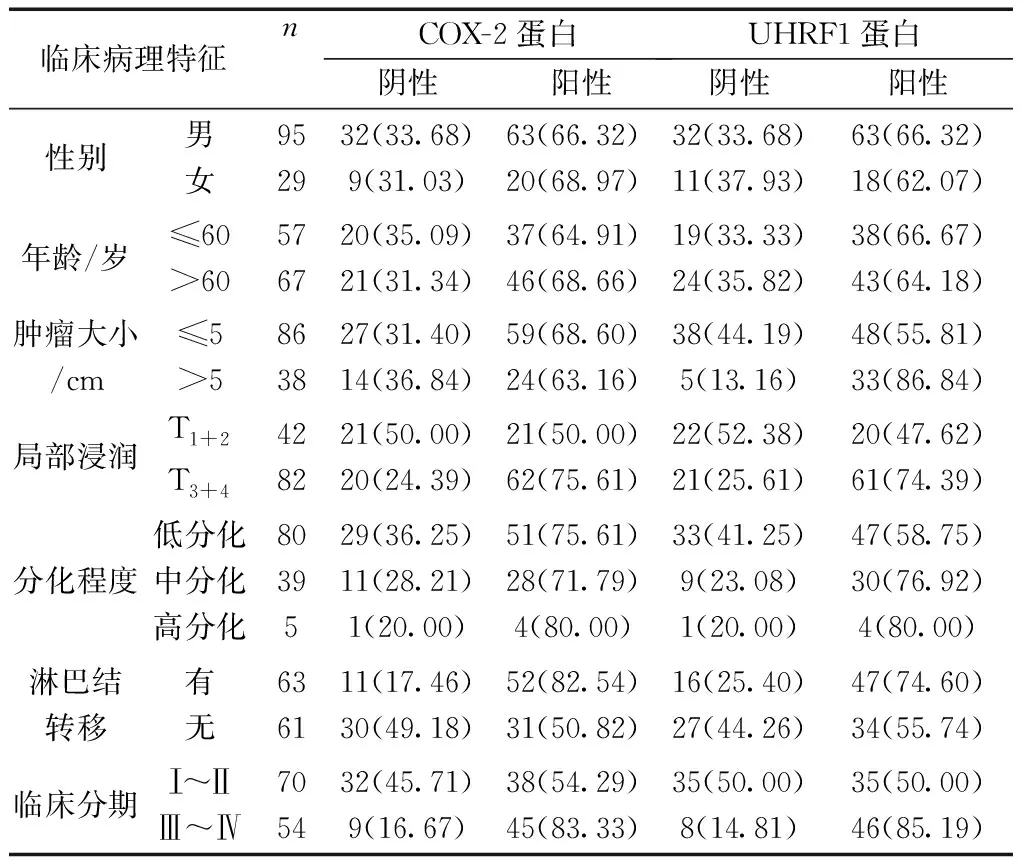
表2 COX-2蛋白表达与胃癌患者临床病理特征的相关性分析
3 讨 论
研究[5]显示,胃癌在我国的恶性肿瘤发病率中位列第一位,以腺癌较为多见。现阶段胃癌的诊断主要借助于胃十二指肠镜检查及病理学检查,但大部分胃癌患者就诊时已处于进展期,分析与胃癌患者相关的生物学标志物对其早期诊断、控制胃癌进展及探讨治疗靶点均有重要意义。COX是花生四烯酸转化为前列腺素(PG)过程中的限速酶,也是炎症发展过程中的一个重要的诱导酶。COX-2属于COX中与肿瘤细胞增殖、侵袭、转移及预后密切相关的同工酶,受COX-2基因的控制,存在于核膜和微粒体膜,研究[6]指出其具有促进肿瘤增殖、肿瘤血管新生等作用,还可以通过诱导肿瘤细胞的侵袭、抑制细胞凋亡等多种途径参与肿瘤的发生和发展。研究[7]显示,胃癌组织中COX-2阳性表达率显著高于癌旁组织,可明显促进胃癌组织中肿瘤血管新生;本研究得到了与之相似的结果,胃癌组织中COX-2蛋白表达阳性率高于癌旁组织,且卡方分析显示,COX-2蛋白表达与局部浸润程度、是否淋巴结转移、临床分期有关,进一步说明COX-2蛋白的阳性表达与胃癌细胞的生物学行为、淋巴结转移等密切相关。
UHRF1属UHRF超家族成员之一,含有多个功能结构域,是新发现的一种与细胞生长相关的核蛋白基因,可参与机体维持子细胞的DNA甲基化状态、调控细胞生长及维持基因组稳定、调节淋巴细胞的发育和功能等多种生理及代谢过程,在增殖旺盛的正常组织具有较高表达。UHRF1现已成为某些肿瘤早期诊断和预后评价的重要指标之一,既往研究[8]显示其在多种肿瘤组织中呈过表达状态,还能通过调控抑癌基因失活、细胞周期、凋亡等多种过程来影响肿瘤的发生发展。本研究结果显示,胃癌组织中UHRF1蛋白表达阳性率高于癌旁组织,且卡方分析显示,UHRF1蛋白表达与局部浸润程度、是否淋巴结转移、临床分期有关,提示UHRF1 在胃癌组织中过表达,且其表达与胃癌发生、发展密切相关。研究[9-10]指出,UHRF1可通过其SRA 结构域结合半甲基化的DNA,并趋化DNA甲基转移酶到DNA复制的分叉处,催化新合成的DNA链发生甲基化,进而调控基因表达。UHRF1可通过增加p16 INK4A 、hMLH1、p21和RB等肿瘤抑癌基因甲基化,从而抑制其表达,最终促进肿瘤的发生发展有关。此外,UHRF1还能调节淋巴细胞的发育和功能,调控细胞生长等,加之UHRF1在维持基因组的稳定性以及细胞中的DNA甲基化方面具有重要作用,一旦机体受到外力侵害或刺激破坏这种维持作用,将触发多基因的随机表达,破坏细胞内的稳态,使得细胞凋亡或者细胞周期阻滞,促进肿瘤的发生发展。
综上所述,胃癌组织中COX-2蛋白及UHRF1蛋白呈过表达状态,且与胃癌肿瘤大小、局部浸润程度、是否淋巴结转移、临床分期有关。
