具有区分力的叶酸片体外溶出度测定方法研究
2022-08-08陈倩倩刘正平刘艺盈毛楷凡杨雪华李大伟
陈倩倩 ,刘正平 ,刘艺盈,毛楷凡 ,杨雪华 ,李大伟 ,
(1. 山东省药学科学院,山东 济南 250101;2. 国家药品监督管理局药物制剂技术研究与评价重点实验室,山东 济南 250101;3. 中国药科大学 生命科学与技术学院,江苏 南京 211198;4. 山东福瑞达医药集团有限公司山东省黏膜与皮肤给药技术重点实验室,山东 济南 250101)
叶酸是一种水溶性维生素,因绿叶中含量十分丰富而得名,又名蝶酰谷氨酸。在自然界中有几种存在形式,其母体化合物是由喋啶、对氨基苯甲酸和谷氨酸3种成分结合而成。叶酸为黄色结晶[1-2],微溶于水,但其钠盐极易溶于水,不溶于乙醇;在酸性环境中易被破坏,对光、热也不稳定。
叶酸在体内的吸收部位主要为小肠上部,吸收后的叶酸存在于肠壁、肝、骨髓等组织中,在还原型辅酶II(NADPH)参与下被叶酸还原酶还原成具有生理活性的四氢叶酸,参与嘌呤、嘧啶的合成。该药属生物药剂学分类系统(biopharmaceutics classification system,BCS)中的III/IV类药物,即低渗透性药物,临床主要用于各种原因引起的叶酸缺乏及叶酸缺乏所致的巨幼红细胞贫血等。叶酸片(5 mg)原研厂家为法国赛诺菲公司(商品名:Speciafoldine)。根据原国家食品药品监督管理总局公布的第一批可豁免或简化生物等效性(BE)试验的品种目录,5 mg规格的叶酸片可豁免BE试验,采用体外评价的方法进行一致性评价。
口服固体制剂的体外评价方法主要是体外溶出度的测定[3-8]。溶出度试验是考察药品内在质量的有效方法,同时可验证仿制药与参比制剂的质量一致性及处方工艺的一致性、合理性[9-11]。在临床试验研究成本不断攀升的背景下,采用有区分力的溶出曲线来剖析制剂的内在质量,无疑是提高生物等效性试验通过率的最有效和经济的手段[12-14]。本文以叶酸片为模型药物,采用紫外分光光度法检测叶酸含量,测定自制制剂与参比制剂在不同pH溶出介质(0.1 mol/L盐酸溶液、pH 4.5醋酸盐缓冲液、pH 5.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液)中的溶出度,并使用相似因子(f2)法进行溶出曲线的相似性评价,以期为叶酸片仿制药质量一致性评价和处方开发提供参考。
1 仪器与试药
1.1 仪器
860DL自动溶出仪(美国Logan公司);S40型pH酸度计[梅特勒-托利多仪器(上海)有限公司];Agilent 8454紫外可见分光光度计(美国安捷伦公司);MS204TS/02电子天平[梅特勒-托利多仪器(上海)有限公司];金怡SHA-2水浴振荡器(金坛市医疗仪器厂)。
1.2 试药
叶酸原料药(河北冀衡药业有限公司,批号:16050190);叶酸对照品(中国食品药品检定研究院,批号:100074-201715,含量:92.6 %);叶酸参比制剂Speciafoldine(规格5 mg/片,批号:18FA098);自制叶酸片(规格5 mg/片,山东省药学科学院);磷酸二氢钾,乙酸钠,氢氧化钠,冰乙酸,盐酸均为分析纯。
2 方法与结果
2.1 溶液的配制
2.1.1 叶酸供试品溶液的配制 取自制叶酸片,参考《中国药典》2020年版二部中叶酸片溶出度检查项方法[15],分别以0.1 mol/L盐酸溶液、pH 4.5醋酸盐缓冲液、pH 5.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液为溶出介质(介质体积为900 ml),转速为75 r/min,温度(37 ℃),分别于各时间点取样,补液10 ml,取出的溶出液经0.45 μm滤膜过滤,取续滤液作为供试品溶液。
2.1.2 叶酸对照品溶液的配制 精密称取叶酸对照品约10 mg,精密称定,置100 ml量瓶中,加pH 6.8磷酸盐缓冲液溶解,并稀释至刻度,摇匀,精密量取1 ml,置50 ml量瓶中,加溶出介质稀释至刻度,摇匀,作为对照品溶液。
2.2 不同pH介质中溶解度的测定
按国家药品监督管理局发布的《普通口服固体制剂溶出曲线测定与比较指导原则》 中“溶出介质配制方法”[16],配制pH分别为1.0,2.0,3.5,4.5,5.0,5.5,6.0,6.8,7.8 的溶出介质。取过量的叶酸原料药,置 25 ml量瓶中,分别加入以上溶出介质,超声30 min 后置摇床中,37 ℃振荡 24 h,0.45 μm微孔滤膜过滤,取续滤液,照紫外-可见分光光度法,在281 nm处测定吸光度。计算不同 pH介质中叶酸的溶解度,绘制叶酸在不同pH值条件下的溶解度曲线。见图1。

图1 叶酸的pH值-溶解度曲线
由图1可见,叶酸的溶解度呈明显的pH依赖性。随着pH值的升高,叶酸的溶解度增大。即在酸性环境中难溶,在碱性环境中易溶。
2.3 不同pH溶液中稳定性的测定
精密称取叶酸原料药适量,置100 ml量瓶中,加入pH 6.8磷酸盐缓冲液溶解并定容,摇匀,作为叶酸原料药贮备液。分别用不同介质(0.1 mol/L盐酸溶液、pH 4.5醋酸盐缓冲液、pH 5.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液)对叶酸原料药贮备液进行逐级稀释,使叶酸质量浓度约为 5 μg/ml,分别于 0,1,2,4,8 h 取样,按紫外-可见分光光度法在281 nm处测定吸光度。考察叶酸在不同溶出介质中的稳定性。结果见表1。

表1 叶酸在不同pH溶液中的稳定性
结果表明,测定浓度下,叶酸在pH 4.5醋酸盐缓冲液、pH 5.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液中8 h内稳定性良好,但在0.1 mol/L盐酸溶液中稳定性相对较差,随放置时间的延长其吸光度呈线性减小趋势。
2.4 溶出曲线测定方法
取参比制剂或自制制剂12片,照溶出度检查(《中国药典》2020年版四部通则0931第二法)[17],采用桨法,溶出介质(0.1 mol/l盐酸溶液、pH 4.5醋酸盐缓冲液、pH 5.0醋酸盐缓冲液、pH 6.8磷酸盐缓冲液)经超声脱气处理,介质体积为900 ml,转速为75 r/min,水温为37 ℃,依法操作,在规定的时间点取溶液10 ml(同时补充10 ml 溶出介质),过0.45 μm滤膜滤过,取滤液,照紫外-可见分光光度法,在281 nm处测定吸光度,按下式计算每片溶出度。

式中,A为供试品溶液的吸光度;Wt为对照品质量;S为供试品溶液的稀释倍数;At为对照品溶液的吸光度;W为供试品标示量;St为对照品溶液的稀释倍数。
2.5 溶出曲线测定方法优化
2.5.1 试验装置 对于叶酸片,《日本药典》第17版(JP17)中推荐桨法,《中国药典》2020年版推荐篮法,因此对不同溶出装置进行了考察。取叶酸片的参比制剂,分别采用篮法、桨法测定其在pH 6.8磷酸盐缓冲液中的溶出度。结果见图2。在pH 6.8磷酸盐缓冲液中,桨法的溶出呈缓慢上升趋势,直至全部溶出。而篮法5 min时基本已全部溶出且达平台期,溶出速率过快,无法反应参比制剂溶出过程中的质量特性。且参比制剂处方中含磷酸氢钙,密度大,易沉积,篮法不适用于本品溶出曲线研究。最终确定为桨法。
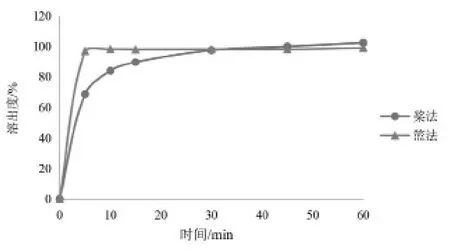
图2 采用篮法和桨法测定的叶酸片在pH 6.8磷酸盐缓冲液中的溶出曲线
2.5.2 溶出转速的选择 溶出曲线研究和对比过程中应采用较缓和的转速,使溶出方法具有更好的区分能力。本文采用桨法,以pH 5.0醋酸盐缓冲液、pH 6.8 磷酸盐缓冲液900 ml作为溶出介质,不同时间点取样10 ml,照紫外-可见分光光度法检测各样品溶液和对照品溶液的吸光度,按下式计算累积溶出度。根据《普通口服固体制剂溶出曲线测定与比较指导原则》[18]中“普通片剂桨法溶出转速应从低转速开始筛选”要求,以转速 50,75 r/min 进行筛选,测定参比制剂 (Speciafoldine®)的溶出曲线。
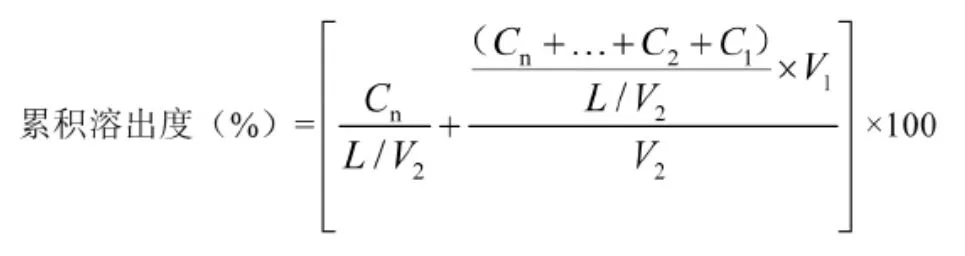
式中,Cn为各时间点取出的样品溶液浓度;L为制剂标示量;V1为各时间点固定的取样体积;V2为溶出介质体积。
结果见图3。由图3可见,在pH 6.8磷酸盐缓冲液中,转速75 r/min时,15 min已全部溶出并达到平台期,溶出速率较快;在pH 5.0醋酸盐缓冲液中,转速75 r/min时,120 min全部溶出且达到平台期。转速降到50 r/min时,两种介质中溶出明显减慢,且溶出杯底部有堆积,以至于在试验时间内未达到溶出平台,无法反应参比制剂溶出过程中的质量特性。因此溶出转速选择75 r/min。
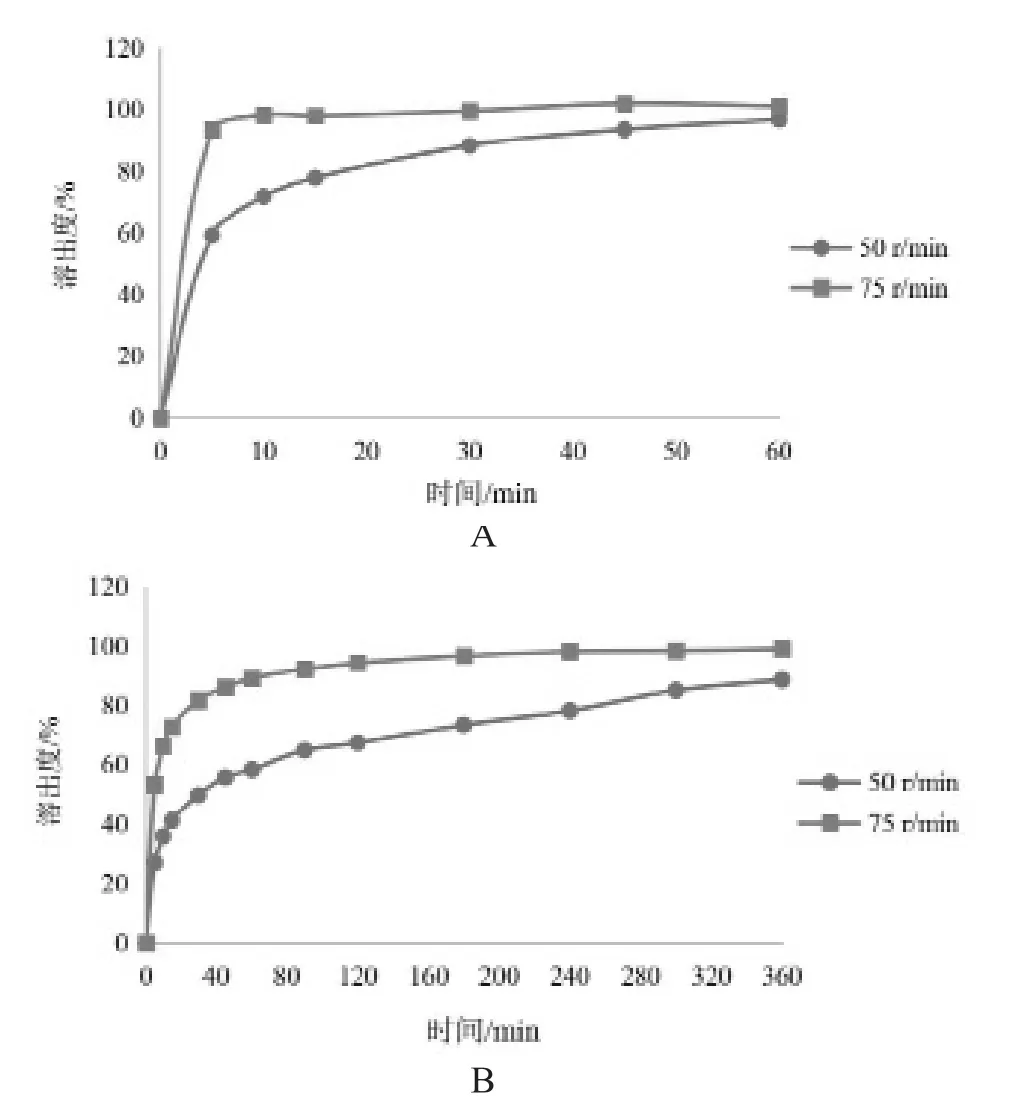
图3 叶酸片在不同转速下的溶出曲线
2.5.3 溶出介质的选择 参照《中国药典》2020年版二部叶酸片溶出度测定方法[15]、《普通口服固体制剂溶出曲线测定与比较指导原则》[18]及叶酸在不同pH溶液中稳定性,叶酸溶解度呈pH相关性,溶液pH对片剂溶出度的影响较大。因此在固体制剂常用的溶出介质基础上(0.1 mol/L盐酸溶液、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液和水)增加了pH 5.0醋酸盐缓冲液。叶酸在pH 4.5醋酸盐缓冲液、pH 5.0醋酸盐缓冲液、pH 6.8 磷酸盐缓冲液中8 h内稳定性良好;在0.1 mol/L盐酸溶液中稳定性相对较差,随放置时间的延长其吸光度呈线性减小趋势,但在此介质中,可评估自制制剂与参比制剂在酸性环境中的降解情况。因各地水质存在差异会引起pH值变化,故未选择水作为叶酸片的溶出介质。因此,最终确定0.1 mol/L盐酸溶液、pH 4.5醋酸盐缓冲液、pH 5.0醋酸盐缓冲液、pH 6.8 磷酸盐缓冲液做为溶出介质进行溶出曲线相似性评价。
2.6 有区分力的溶出条件确定
参考《普通口服固体制剂溶出曲线测定与比较指导原则》,采用桨法,转速75 r/min,以0.1 mol/L盐酸溶液、pH 4.5醋酸盐缓冲液、pH 5.0醋酸盐缓冲液、pH 6.8 磷酸盐缓冲液作为溶出介质,测定并绘制参比制剂在各溶出条件下的溶出曲线,从中筛选出符合有区分力的溶出条件。
结果见图4。由图4可见,在pH 6.8磷酸盐缓冲液中,叶酸溶解度较高,叶酸片溶出较快,难以体现自制片剂与参比制剂的差异。在0.1 mol/L盐酸溶液、pH 4.5醋酸盐缓冲液或pH 5.0醋酸盐缓冲液中,叶酸溶解度较低,可筛选适宜的具有区分力的溶出条件。4种溶出介质中叶酸参比制剂的溶出曲线差异明显,其中符合45~60 min释放达85 %或90~120 min达85 %,且溶出曲线无拐点和突释的溶出介质为pH 5.0醋酸盐缓冲液。因此溶出介质确定为pH 5.0醋酸盐缓冲液。

图4 叶酸片在不同溶出介质中的溶出曲线
综上,确定具有区分力的溶出条件为:桨法,转速75 r/min,以pH 5.0醋酸盐缓冲液900 ml为溶出介质。
2.7 采用有区分力的溶出条件筛选叶酸片处方
以不同处方制备叶酸片(A、B、C),以市售的叶酸原研片作为参比制剂,以2.6项下具有区分力的溶出条件对叶酸片处方进行筛选。溶出曲线见图5。采用相似因子(f2)法比较溶出曲线相似性,当两条溶出曲线相似因子(f2)数值不小于50时,可认为溶出曲线相似。制备处方以所得溶出曲线与参比制剂相似者,即f2因子数值最大者为佳。
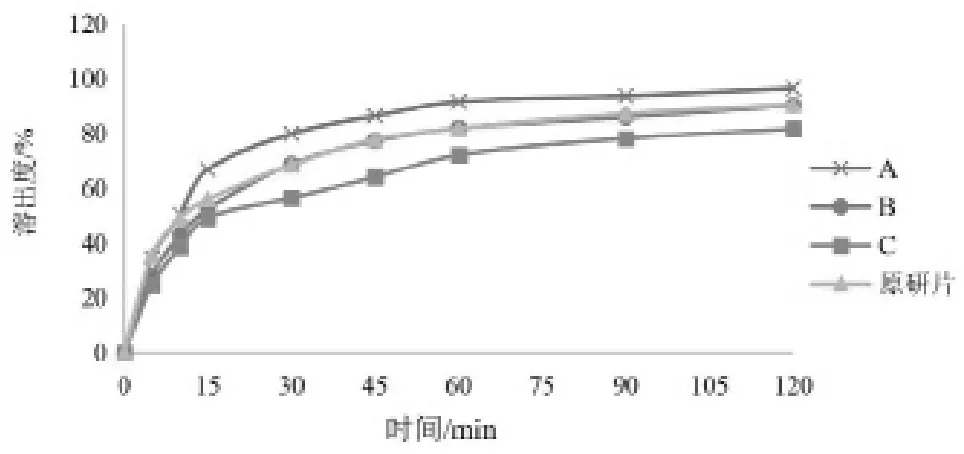
图5 叶酸自制片与参比制剂在具区分力条件下的溶出曲线

表2 叶酸自制片处方要点及相应f2因子
由结果可知,不同处方制备的叶酸片在具有区分力的溶出条件下溶出曲线与参比制剂相似,相似因子f2均大于50,且随着处方中原料药与磷酸氢钙的比值不同,相似因子f2也发生变化。当采用处方B时,f2数值最大且最佳。因此,采用pH 5.0醋酸盐缓冲液为溶出介质,对叶酸片的处方工艺有区分力。
2.8 溶出度测定方法学验证
2.8.1 专属性实验 根据自制制剂的处方比例,制成不含主药的空白辅料样品 (约相当于5 mg规格的叶酸片辅料量)。加pH 6.8磷酸盐缓冲液25 ml溶解,并用pH 5.0醋酸盐缓冲液25 ml稀释成空白辅料溶液;另精密称取叶酸对照品适量,置100 ml量瓶中,加pH 6.8磷酸盐缓冲液稀释至刻度,摇匀,作为对照品贮备液,精密量取5 ml,置100 ml量瓶中,加pH 5.0醋酸盐缓冲液稀释至刻度,摇匀,作为对照品溶液。过滤,取续滤液,分别对叶酸对照品溶液和空白辅料溶液按照紫外-可见分光光度法在281 nm处测定吸光度,紫外吸收光谱图见图6。结果证明空白辅料在281nm处无吸收,该方法专属性良好。

图6 叶酸专属性紫外吸收光谱图
2.8.2 线性试验 精密称取叶酸对照品适量,置100 ml量瓶中,加pH 6.8磷酸盐缓冲液溶解至刻度,摇匀,精密量取 0.5,1,2,5,8,10 ml,分别置100 ml量瓶中,加pH 5.0醋酸盐缓冲液稀释至刻度,摇匀,制成叶酸质量浓度(C)分别为 0.689,1.377,2.754,6.885,11.016,13.771 μg/ml的系列溶液;分别取上述系列溶液,照紫外-可见分光光度法,在281 nm处测定吸光度。以C为横坐标、吸光度(A)为纵坐标进行线性回归,得线性方程为Y=0.0600x+0.0024,相关系数r2为1.0000。表明叶酸片在0.689~13.771 μg/ml范围内线性关系良好。
2.8.3 精密度 分别取线性试验项下浓度为6.885 μg/ml的对照品溶液,连续测定6次,浓度平均值为6.903 μg/ml,RSD为0.01 %,说明精密度良好。
2.8.4 滤膜吸附性 取浓度为 6.885 μg/ml的叶酸对照溶液,用 0.45 μm微孔滤膜过滤,分别取过滤前溶液及5,10,15,20,25,30,40,50,60 ml滤液,照紫外-可见分光光度法,在281 nm处测定吸光度(A),A的RSD为0.82 %,表明滤膜对叶酸无吸附。
2.8.5 回收率试验 精密称取叶酸对照品适量,加pH 6.8磷酸盐缓冲液超声溶解至刻度,摇匀, 作为对照品贮备液。精密量取5 ml,置100 ml量瓶中,加pH 5.0醋酸盐缓冲液稀释至刻度,摇匀,作为对照品溶液。分别精密量取对照品贮备液3,5,7 ml各3份,分别置9个100 ml量瓶中,加空白辅料约95 mg,加pH 5.0醋酸盐缓冲液稀释至刻度,摇匀,作为供试品溶液。取对照品溶液及供试品溶液各适量,照紫外-可见分光光度法,在281 nm处测定吸光度,计算回收率。结果显示,平均回收率为100.41 %,RSD为0.64 %,结果表明,方法准确度良好。
以上溶出度方法学验证指标均满足要求,提示建立的溶出度检查方法可行。
2.9 自制制剂与参比制剂溶出对比
参照《普通口服固体制剂溶出度实验技术指导原则》[18],采用非模型依赖法中的相似因子(f2)法[19]比较自制制剂与参比制剂在0.1 mol/L盐酸溶液、pH 4.5醋酸盐缓冲液、pH 5.0醋酸盐缓冲液和pH 6.8磷酸盐缓冲液中的溶出曲线相似性。按下式计算相似因子值。结果见图7。

图7 叶酸自制制剂和参比制剂在不同溶出介质中的溶出曲线

式中,Rt为t时间参比样品平均溶出量;Tt为t时间受试样品平均溶出量;n为取样时间点的个数。
由图7可见,叶酸片自制制剂与参比制剂在pH 6.8磷酸盐缓冲液中,15 min溶出度大于85 %,在其他3种介质中,f2值均大于50。说明自制制剂与参比制剂在4种溶出介质中的溶出行为相似。
3 讨论与结论
在口服固体制剂质量评价中,最为有效的手段是建立能体现参比制剂内在质量、具有区分力的溶出曲线。本研究通过筛选试验装置、溶出转速、溶出介质等,确定叶酸片具有区分力的溶出条件:桨法,最佳转速为75 r/min,pH 5.0醋酸盐缓冲液作为溶出介质。此条件下,药物的溶出曲线呈明显的上升期和平台期。可用于区别不同处方的叶酸片,经验证方法重复性较好。
评价溶出曲线相似性的方法众多,各有优缺点,有些侧重于对整体溶出度进行评价,有些则侧重于对局部进行评价。本研究采用的f2法为整体比较法,其中f2计算简便,能比较自制制剂与参比制剂溶出曲线的差异。具有区分力的叶酸片溶出曲线测定方法可用于区分不同处方工艺产品的质量差异,有利于进一步的处方筛选和工艺优化。本研究建立的体外溶出度测定方法可为评价叶酸片仿制制剂的内在质量及一致性评价研究提供试验依据。在本品的一致性评价中,还应关注原料药粒径、晶型等因素的影响,为处方工艺优化提供全面技术支撑。
