急性Stanford A型主动脉夹层术后膈肌功能障碍的临床研究
2022-08-08李静沈骁孙加奎孙芳薛寅莹章文豪章淬
李静 沈骁 孙加奎 孙芳 薛寅莹 章文豪 章淬
(南京医科大学附属南京医院(南京市第一医院)重症医学科,江苏 南京 210006)
急性Stanford A型主动脉夹层(acute Stanford type A aortic dissection,ATAAD)是临床上一种极为凶险的心血管疾病,即使手术技术、麻醉及围手术期监护治疗水平不断进步,当前ATAAD患者围手术期死亡率仍为25%[1-2]。严重的应激反应、炎性细胞因子和活性氧的释放激活、缺血和缺血再灌注损伤、急诊手术打击及术中深低温停循环过程等,常造成术后患者呼吸系统相关并发症高发,从而导致机械通气时间延长及撤离困难,而膈肌功能障碍可能是尚未被充分认识和关注的重要原因之一。膈肌功能障碍在心脏外科术后常见,发生率为10%~75%[3],本研究的目的在于通过膈肌超声评估以明确ATAAD术后合并左心功能不全的患者中膈肌功能障碍的发生情况,以及膈肌功能对术后撤离机械通气的影响。
1 资料与方法
1.1 研究对象
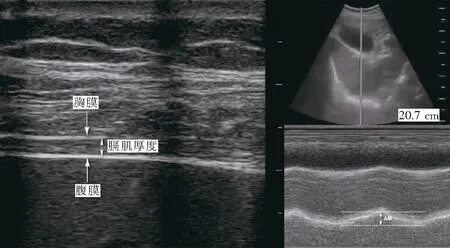
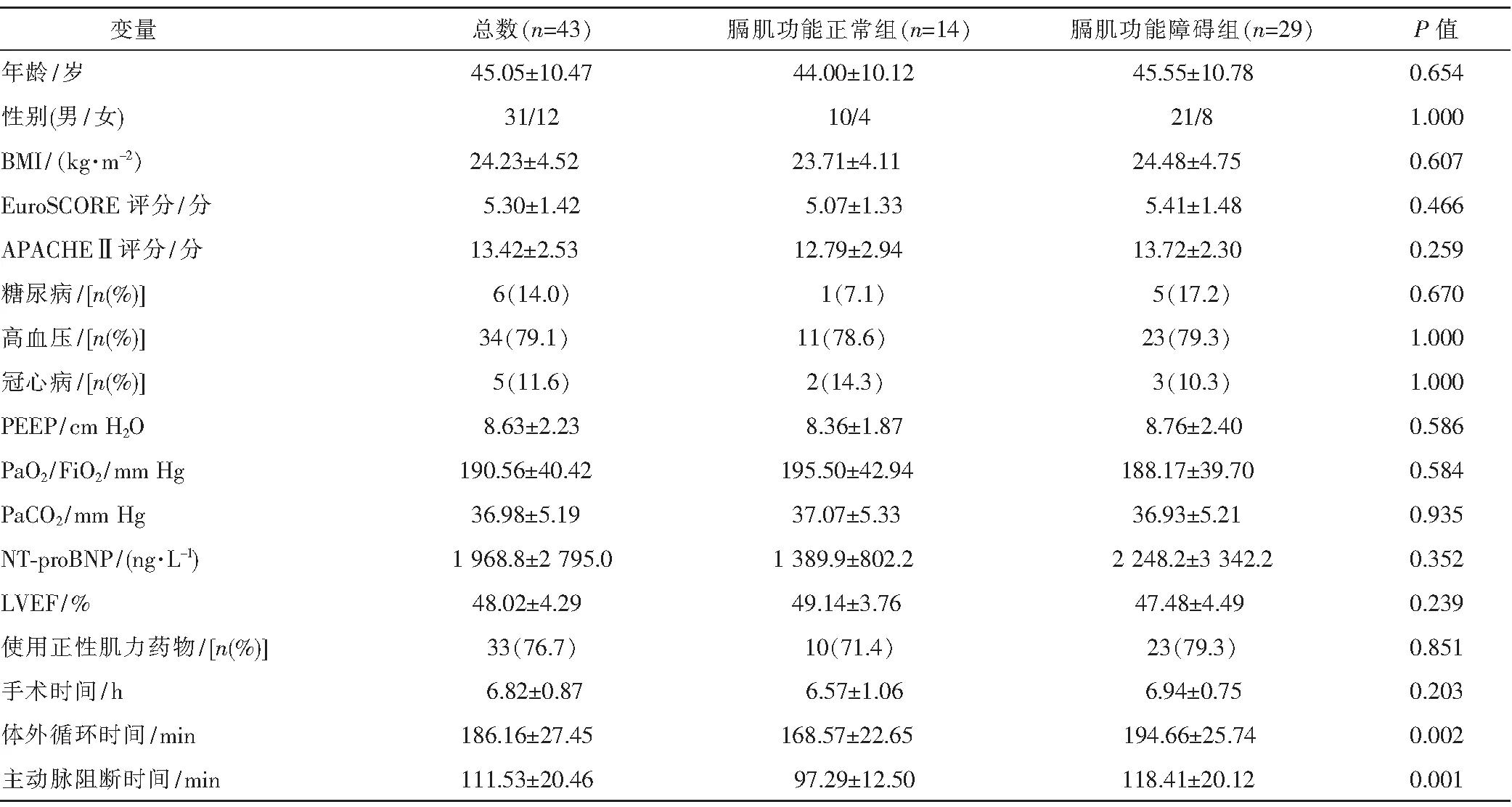
采用前瞻性研究,选取2019年1月—2021年9月入住南京医科大学附属南京医院重症医学科行孙氏手术且术后合并左心功能不全[左室射血分数(left ventricular ejection fraction,LVEF)<55%]的ATAAD患者。纳入标准:(1)由心脏超声和计算机体层摄影血管造影确诊ATAAD;(2)年龄18~65岁,体重50~100 kg;(3)35% 患者术后入住ICU后采用适应性支持通气模式给予机械通气,按性别、身高(理想体重)设置目标分钟通气量为80%~120%,呼气末正压(positive end-expiratory pressure,PEEP)为6~10 cm H2O。待患者神志恢复清醒且能正确完成简单指令后每隔4 h评估患者自主呼吸能力,在能满足下述条件时,以床旁超声测定膈肌功能相关指标:在呼吸机压力支持通气模式下,压力支持水平8~10 cm H2O,PEEP 5~6 cm H2O的条件下,能维持呼吸频率<30次/min,潮气量>6 mL/kg,且无呼吸困难表现,能维持30 min以上。 采用GE VIVID Ⅰ便携式彩色多普勒诊断仪,所有受试者均取头高30 °仰卧位,由同一位取得重症超声资质的重症医师操作(操作医师不参与患者的临床诊治过程)。 首先使用频率4.0~16.0 MHz的线阵探头,置于右侧腋中线第8~10肋间隙与腋前线交点,垂直于胸壁显示并置区(膈肌延伸并覆盖在肋骨上的区域)膈肌结构。二维超声下找到需测量的膈肌,测量胸膜与腹膜之间的距离为膈肌厚度(如图1)。分别测量在平静呼气末最薄的膈肌及最大吸气末最厚的膈肌厚度,测量两个周期取平均值。计算膈肌增厚率(diaphragmatic thickening fraction,DTF)=(最大吸气末厚度-平静呼气末厚度)/平静呼气末厚度。将DTF≥20%定义为膈肌功能正常,纳入膈肌功能正常组;DTF<20%定义为膈肌功能障碍,纳入膈肌功能障碍组。 图1 膈肌厚度的测量及膈肌移动度的测量 再行膈肌移动度(ΔM)检查(如图1):使用频率2.0~5.0 MHz的凸阵探头,置于肋缘与右侧锁骨中线交点,探头指向膈顶,角度≥70 °(测量过程保持角度不变),二维模式下找到需测量的膈肌,使用M模式,将采样线垂直于膈肌,测量膈肌运动幅度,通过M型超声记录波形。嘱受试者平静呼吸,从吸气相开始记录三个呼吸周期的膈肌运动波形,并计算波峰与波谷到基线垂直距离的差值(ΔM),重复三次,取平均值为平静呼吸膈肌移动度。嘱受试者深呼吸,重复上述步骤采集图像并记录深呼吸膈肌移动度。 1.4.1 患者基本情况 性别、年龄、身体质量指数(body mass index,BMI)、欧洲心血管手术危险因素评分(European System for Cardiac Operative Risk Evalution,EuroSCORE)、急性生理学及慢性健康状况评价Ⅱ(Acute Physiology And Chronic Health Evaluation Ⅱ,APACHEⅡ)评分及伴随的基础疾病情况,患者术后入住ICU时心功能指标:N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)水平、LVEF和正性肌力药物应用情况。 1.4.2 手术相关情况 手术时间、体外循环时间、主动脉阻断时间和停循环时间。 1.4.3 患者的膈肌功能测量 平静呼气末厚度、最大吸气末厚度、DTF、平静呼吸移动度和深呼吸移动度。 1.4.4 达到自主呼吸试验条件时的呼吸支持情况及动脉血气氧合指标 PEEP、动脉血二氧化碳分压(PaCO2)、氧合指数(PaO2/FiO2)。 1.4.5 主要临床结局指标 术后有创机械通气时间、需无创机械通气、再次气管插管、行气管切开术、住ICU时间、住ICU期间病死率和住院病死率。 采用SPSS 22.0统计软件进行数据统计分析。正态分布的计量资料以均值±标准差表示,组间样本采用独立样本t检验;计数资料以例数[n(%)]表示,组间比较采用卡方检验或Fisher精确概率法。P<0.05为有统计学意义。 纳入研究的行孙氏手术且术后合并左心功能不全的ATAAD患者共43例(其中男性31例,女性12例),平均年龄(45.05±10.47)岁,BMI(24.23±4.52)kg/m2,术毕时EuroSCORE评分(5.30±1.42)分,APACHEⅡ评分(13.42±2.53)分,LVEF(48.02±4.29)%;合并高血压34例,合并冠心病5例,合并2型糖尿病6例。见表1。 表1 患者的基本特征、临床指标及手术相关指标比较 所有43例患者术后膈肌均能被超声探及并对其形态和功能进行测定,其平均平静呼气末膈肌厚度(1.96±0.20)mm,平均最大吸气末膈肌厚度(2.36±0.27)mm;平均DTF为(20.55±6.38)%,其中DTF<20%(膈肌功能障碍组)29例,DTF≥20%(膈肌功能正常组)14例,膈肌功能障碍发生率为67.4%。其一般临床资料对比包括性别、年龄、BMI、EuroSCORE评分、APACHEⅡ评分、LVEF和伴随基础病的情况,两组之间均无统计学差异,见表1;两组之间膈肌形态及功能指标,见表2,膈肌功能障碍组平均DTF明显小于正常组(P<0.001),膈肌功能障碍组平静呼吸移动度及深呼吸移动度均小于正常组(P<0.001)。 表2 膈肌形态及功能指标比较 两组患者术后LVEF及正性肌力药物的应用情况均无统计学差异;与膈肌功能正常组相比,膈肌功能障碍组主动脉阻断时间[(118.41±20.12)min vs(97.29±12.50)min,P=0.001]及体外循环时间[(194.66±25.74)min vs(168.57±22.65)min,P=0.002]更长,差异具有统计学意义,而两组之间的手术时间无明显差异。见表1。 膈肌功能障碍组的机械通气时间较正常组延长(P<0.001),且住ICU时间较膈肌功能正常组延长(P<0.05),具有统计学差异;撤机后无创辅助通气的比例、再次气管插管的比例以及行气管切开术的比例,两组之间均无统计学差异。见表3。 表3 主要临床结局比较 本研究通过应用床旁超声测定ATAAD患者术后膈肌形态及功能,发现术中主动脉阻断时间及体外循环时间与术后膈肌功能损伤的发生显著相关,该研究中有69.7%的ATAAD合并左心功能不全的患者术后发生了膈肌功能障碍,与膈肌功能正常的患者相比,膈肌功能障碍的患者术后有创机械通气时间、住ICU时间均延长。 心脏外科术后发生的膈肌功能障碍较少被临床医生关注。有研究[4]发现膈肌功能的改变可能与膈神经损伤有关,继发于术中在心包内使用冰冷溶液进行心脏局部冷却、术中膈神经直接损伤。近年来,进一步的研究表明高水平炎症细胞因子和线粒体氧化应激在膈肌功能障碍发展中起核心作用[5],这可能与体外循环过程中产生大量活性氧并激活促炎和促凋亡信号通路有关[6]。最近,Moury等[7]的研究报道,择期心脏手术后DTF的降低程度与体外循环和手术干预的持续时间成正比。主动脉夹层患者膈肌功能方面的研究目前报道较少,ATAAD的发生和发展过程与炎症反应和炎症因子同样密切相关[8];同时,大量炎症介质及促炎因子可能导致膈肌功能损伤的发生。主动脉夹层手术中经历了较一般心脏外科手术更长时间的体外循环过程,在本研究中观察到膈肌功能障碍组较正常组的患者主动脉阻断时间及体外循环时间更长,提示可能与膈肌功能障碍的产生有关。 重症患者发生膈肌功能障碍的两个最大危险因素是机械通气和脓毒症的存在[9],而膈肌功能障碍的出现和发展又可直接导致机械通气时间延长和撤机失败的发生,并可增加病死率[10]。本研究应用床旁超声对膈肌功能进行评估,相对于传统的膈肌功能评估方法如膈肌神经刺激诱发跨膈压、膈肌肌电图等,其为一种简便、无创、安全、可重复及可连续性观察的膈肌功能测定方法,能客观地反映膈肌的形态及膈肌的运动功能,并且其准确性在临床上也被反复证实[11-13]。笔者的研究中,即使是膈肌功能障碍的患者,其平静呼气末膈肌厚度仍基本正常,表明膈肌此时尚未萎缩,提示膈肌收缩力下降早于膈肌形态学的变化,可排除机械通气对膈肌功能的影响,因为机械通气相关性膈肌功能障碍常伴有膈肌萎缩[14],这与郝光伟等[15]的研究一致。究其原因可能与脓毒症对膈肌功能的影响相似,主动脉夹层的早期病理以全身炎症反应和组织低灌注为主,膈肌对代谢底物摄取与利用障碍,使膈肌对负荷性损伤更为敏感,从而导致非萎缩性收缩力下降[16]。 在本研究结果中可见膈肌功能障碍组患者机械通气时间更长,但发生撤机失败需再次气管插管或行气管切开术的患者比例与正常组相似,这一结果可能与临床积极有效的干预措施相关。首先纳入该研究的患者均合并不同程度的左心功能不全,故撤机后根据病情,部分患者即计划性给予序贯无创辅助通气治疗;其次,由于进行了膈肌功能筛查,对于出现膈肌功能障碍的患者,早期给予利于膈肌功能恢复的措施,包括机械通气期间早期行自主呼吸功能锻炼,积极肠内营养、营养神经治疗,撤机后加强深呼吸、咳嗽指导、肺活量锻炼及早期床旁康复训练等。 本研究仍存在一定的局限性:(1)针对临床上主动脉夹层术后撤机困难多发生于合并左心功能不全和/或急性呼吸窘迫综合征的患者,为减少影响因素,本研究仅纳入了合并左心功能不全的ATAAD患者,不能反映所有ATAAD患者术后普遍的膈肌功能情况。(2)应用超声评估患者膈肌功能时,所有的测量仅由一名重症医师完成,且仅评估了患者右侧的膈肌功能,而膈肌功能障碍可能发生于单侧或双侧,因此可能会影响研究结果。(3)随机械通气时间及住ICU时间的延长,部分患者发生了医院内感染,感染及脓毒症的发生可能会影响膈肌功能及撤机的进程,本研究未将该混杂因素纳入分析。后期笔者将进一步扩大样本量并行多种影响因素的分析,以便更深入地研究。 综上所述,膈肌功能障碍在ATAAD术后合并左心功能不全的患者中发生普遍,且与机械通气时间、住ICU时间相关,以床旁超声评价此类患者膈肌功能简便可行,并且对术后撤机具有预测及指导价值。1.2 研究方法
1.3 膈肌功能测定方法
1.4 临床资料收集
1.5 统计学方法
2 结果
2.1 患者的临床资料及基本特征对比
2.2 膈肌功能超声测定情况

2.3 临床指标及手术指标比较
2.4 主要临床结局比较

3 讨论
