经导管主动脉瓣植入术术后抗栓治疗的研究进展
2022-08-08段振娅吴永健
段振娅 吴永健
(北京协和医学院 国家心血管病中心 中国医学科学院阜外医院心内科,北京 100037)
经导管主动脉瓣植入术(transcatheter aortic valve implantation,TAVI)是治疗症状性重度主动脉瓣狭窄患者的重要治疗手段之一,现已成为外科手术禁忌、中高危患者的指南推荐治疗方式,并已逐渐推广至低危患者人群中[1-6]。另外,2021年ESC瓣膜病指南[7]推荐对于不能接受外科手术的主动脉瓣关闭不全患者,可在手术经验丰富的医院经过评估后接受TAVI治疗。但受限于目前的临床数据,国际上TAVI围手术期及手术后的最佳抗栓治疗方案尚未统一。TAVI患者多为老龄患者,合并症多,病情较为复杂,另外由于目前研究证据的不足,如何为接受TAVI的患者制定最佳抗栓策略,如何平衡好卒中与出血的风险,是目前研究领域中讨论的热点。现就TAVI后抗栓治疗的相关热点板块的研究进展进行综述。
1 血栓栓塞和出血事件
血栓栓塞和出血是TAVI常见的并发症,接受TAVI治疗的多是年龄较大、有外科禁忌或是中高危症状性主动脉瓣重度狭窄的患者,且常合并冠状动脉疾病、心房颤动(房颤)等,因此血栓栓塞事件发生的风险升高,而常规予以抗血小板治疗或抗凝治疗也会增加其出血的风险[8-9]。PARTNER 2A研究指出,外科手术中危风险的患者中,TAVI后30 d脑血管缺血事件发生率约为5%,主要出血事件发生率为10%~12%[10]。PARTNER 3研究中手术低风险重度主动脉瓣狭窄患者TAVI后随访1年和2年,卒中的发生率分别为3.3%和3.6%[11]。2016年美国胸科医师学会/美国心脏病学会经导管瓣膜病治疗注册研究年度报告[12]指出,在接受TAVI的54 782例患者中,术后30 d大出血、致命性出血和卒中的发生率分别为4.3%、4.1%和2.1%。GALILEO研究[13]、Nijenhuis等[14]和Brouwer等[15]研究发现,行TAVI患者在围手术期和术后早期出现脑血管缺血事件较为常见,可能是由于血栓、瓣膜组织和异物的脱落所致。行TAVI患者合并冠状动脉疾病较为常见,但围手术期期间心肌梗死很少发生(发生率为1%~3%)。危及生命和致残性出血事件通常发生在术后第1年内,发生率为3%~11%。其中,约50%的出血事件与手术操作相关,可通过CT对入径进行评估,采用超声引导穿刺、小口径导管和薄型缝合闭合装置等操作,可减少出血事件的发生[15]。
2 抗血小板治疗
目前临床数据表明,对于接受TAVI治疗的患者,双联抗血小板治疗(dual antiplatelet therapy,DAPT)相比单独抗血小板治疗(single antiplatelet therapy,SAPT)并不能得到额外的获益。一项纳入了两项小型随机临床试验和两项观察研究(n=672)的荟萃分析指出,TAVI治疗后DAPT相比SAPT在术后30 d的净不良临床事件无显著差异,而DAPT组出血发生率更高[16]。Mangieri等[17]的研究表明,与SAPT(n=108)相比,DAPT(n=331)约5个月在术后1年时出现净不良临床事件和瓣膜血栓形成发生率无明显差异。日本一项较小的单中心研究[18](n=144)发现,DAPT组发生严重危及生命的出血发生率明显高于SAPT组(21% vs 8%)。ARTE研究[19]是最早比较TAVI后DAPT和SAPT预后的随机对照试验,该试验将TAVI后的222例患者等比例随机分为单用阿司匹林组和阿司匹林+氯吡格雷组,结果发现DAPT组致命性大出血事件发生率显著增加(10.8% vs 3.6%,P=0.038),但死亡、卒中和短暂性脑缺血发作(transient ischemic attack,TIA)的发生率无显著差异。POPular-TAVI试验[20]是一项前瞻性、随机对照和开放标签的多中心临床试验,于2014年2月开始,共纳入1 000例患者(队列A:684例;队列B:316例)并随访1年。用于评价TAVI后单用阿司匹林或口服抗凝药物(oral anticoagulants,OAC)疗法与加用3个月氯吡格雷方案相比,能否减少出血并达到临床净获益。该试验分为A和B两个队列,B队列用于验证具有OAC适应证的患者行TAVI后,应用OAC联合与不联合氯吡格雷进行比较。POPular TAVI A队列研究表明相比DAPT组,单用阿司匹林可显著减少出血风险,同时未增加心血管死亡、卒中和心肌梗死死亡风险。单用阿司匹林组50例(15.1%)患者出现了出血,DAPT组89例(26.6%)患者出现出血(RR=0.57,95%CI0.42~0.77,P=0.001),而心血管死亡、卒中或心肌梗死的复合终点事件单用组相比DAPT组并无明显差异。基于最近的临床研究数据,《经导管主动脉瓣植入术患者抗栓治疗的管理共识(2021)》建议对于行TAVI后无OAC指征患者应使用低剂量阿司匹林而不是阿司匹林联合氯吡格雷抗栓治疗(见图1)[21]。
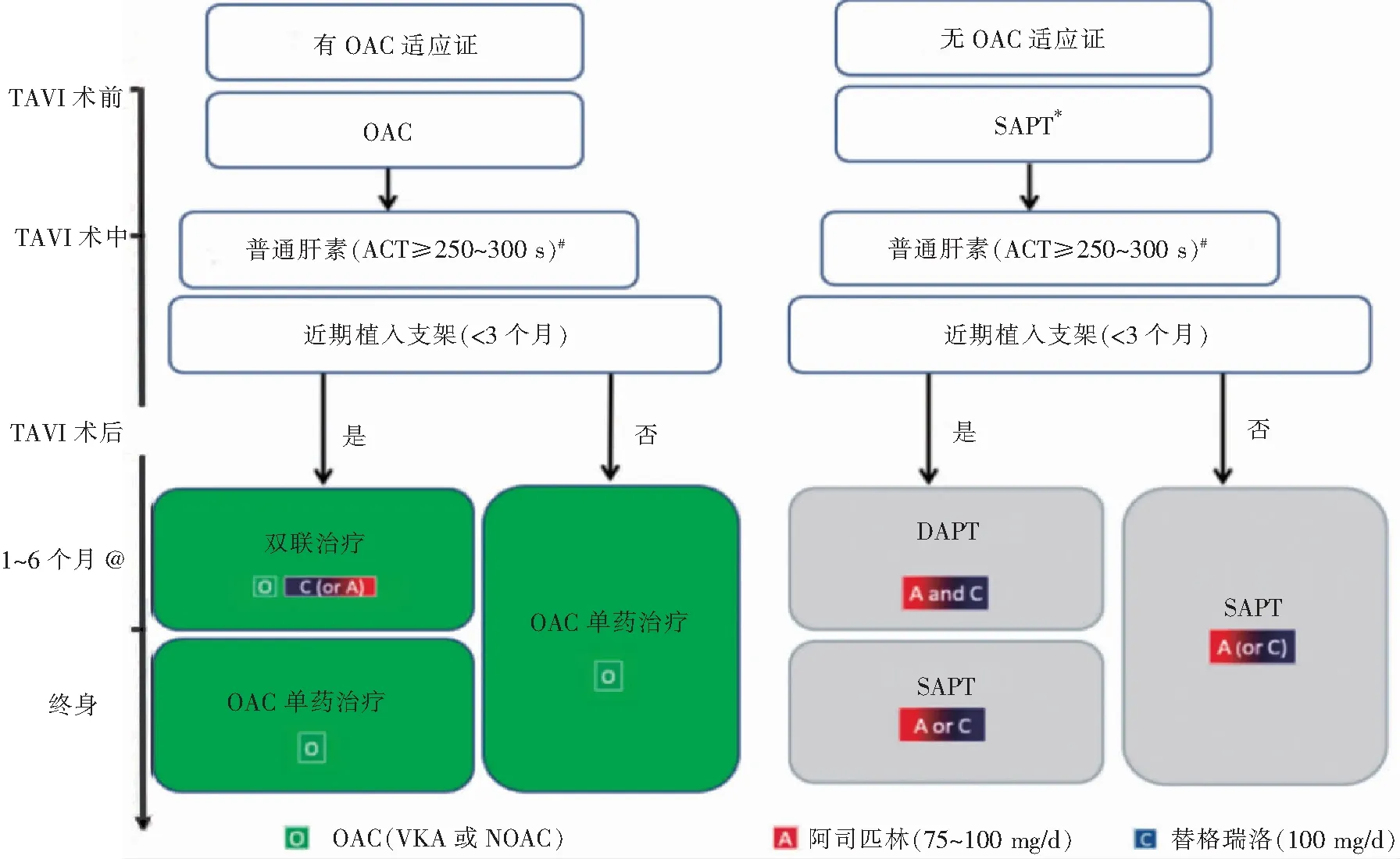
注:ACT,活化凝血时间;VKA,维生素K拮抗剂;NOAC,新型口服抗凝药物;∗表示低剂量阿司匹林或氯吡格雷,#表示若存在肝素诱导性血小板减少症可用比伐卢定替代,@表示维持期取决于出血风险。
3 房颤与抗凝治疗
接受TAVI的患者多为高龄患者,常合并房颤,患病率约为40%,且TAVI后新发房颤也是TAVI常见的并发症之一。基于CHA2DS2-VASc评分,合并房颤接受TAVI的患者几乎都有OAC的治疗指征。关于接受TAVI治疗患者的最佳选择是维生素K拮抗剂(vitamin K antagonist,VKA)还是新型口服抗凝药物(novel oral anticoagulant,NOAC)抗栓,目前缺乏足够的临床证据以及明确的指南推荐。2020年ESC房颤诊断与管理指南[22]建议具备NOAC适应证的患者使用NOAC而非VKA(Ⅰa级)。目前各临床研究关于行TAVI患者接受OAC抗栓治疗后出现血栓栓塞风险的研究结果并不一致。Seeger等[23]在JACC子刊上发表的关于617例患者的研究指出,房颤患者接受TAVI后1年全因死亡率明显高于窦性心律TAVI组(19.1% vs 7.8%,P=0.01),术后30 d阿哌沙班安全终点事件发生率明显少于VKA组(13.5% vs 30.5%,P<0.01)。但一项丹麦注册研究[24]指出,行TAVI后患者使用NOAC和VKA发生血栓栓塞、出血或全因死亡的风险相近。德国的一项注册研究[25]表明,NOAC较VKA在1年时发生全因死亡、心肌梗死和脑血管事件的风险更高。因此,在合并房颤的行TAVI后患者的处理中,目前支持NOAC而非VKA的证据仍缺乏。
一项对房颤患者的观察性研究[26]发现,单用VKA相比VKA联合阿司匹林抗栓治疗可减少严重或危及生命的出血事件的发生,而二者缺血事件发生率无明显差异。POPular TAVI 队列B随机将接受TAVI治疗的房颤患者分为单用OAC和OAC联合3个月氯吡格雷两组,结果发现单用OAC组出血风险明显低于OAC联合氯吡格雷组(21.7% vs 34.6%,P=0.01),而出现心血管死亡、卒中或心肌梗死的复合事件风险并不会更高(13.4% vs 17.3%)[14]。在此研究基础上,专家共识认为对于有OAC指征接受TAVI治疗的患者单用OAC优于OAC联合氯吡格雷抗栓治疗。2021年ESC瓣膜病指南[7]推荐对于存在房颤且有OAC明确禁忌证的患者应考虑接受左心耳封堵术治疗,以减少血栓事件的发生。
4 经皮冠状动脉介入治疗后抗栓
合并冠状动脉疾病在TAVI近期行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的患者较为常见(约20%)。根据2021年管理共识,对于有OAC指征的患者如果PCI支架在最近3个月内植入,予OAC联合氯吡格雷或阿司匹林1~6个月后维持OAC单药终生抗栓治疗;若支架植入时间>3个月则予终生OAC单药抗栓治疗。对于无OAC指征的患者,若支架在最近3个月内植入,予DAPT 1~6个月后维持SAPT终生治疗;若支架植入时间>3个月,则终生使用SAPT治疗。对于存在潜在出血高风险的行TAVI患者,专家共识[21]推荐在参考范围内选择较短时间的DAPT治疗。2021年ESC瓣膜病指南[7]推荐将三联时间进一步缩短,对需长期抗凝的患者行PCI或合并急性冠状动脉综合征药物治疗后,如果支架血栓形成的风险较低或出血风险较高,建议尽早停止服用阿司匹林(<1周),并继续使用OAC和P2Y12受体抑制剂(最好是氯吡格雷)进行为期6个月(急性冠状动脉综合征患者最多12个月)的双重治疗(Ⅰ类推荐,B级证据)。对需长期抗凝的患者行PCI或合并急性冠状动脉综合征药物治疗后,如果支架血栓形成的风险大于出血风险,应考虑使用阿司匹林、氯吡格雷和OAC的三联疗法1周以上,根据对这些风险的评估确定总持续时间(<1个月),并在出院时明确规定(Ⅱa类推荐,C级证据)[7]。当PCI后早期行TAVI时,尚不清楚TAVI期间是否应继续进行抗栓治疗,但专家意见建议在3个月内行PCI时继续进行,因为支架血栓形成的风险在此时间段内最高。
5 生物瓣膜血栓
TAVI瓣膜血栓极少会增加跨瓣压差导致心力衰竭(1%~3%)[13-15]。Evolut低危随机对照试验亚组研究发现,在术后30 d~1年时,TAVI组中低密度瓣叶增厚(hypoattenuated leaflet thickening,HALT)由31例(17.3%)增至47例(30.9%),瓣叶活动度下降(reduced leaflet motion,RLM)由23例(14.6%)增至45例(31.0%),外科主动脉瓣置换术组中HALT由23例(16.5%)增至33例(28.4%),RLM由19例(14.3%)增至30例(27.0%),两组1年内出现HALT和RLM的比例均增加。但主动脉瓣血流动力学状态在术后30 d及1年时与HALT和RLM及二者不同严重程度并无相关关系。且有研究[27]发现亚临床瓣叶血栓(subclinical leaflet thrombosis,SLT)对患者术后1年的死亡、卒中、TIA和心肌梗死的发生率无影响。最近的GALILEO-4D亚组分析[28]指出无OAC指征的行TAVI患者,以利伐沙班为基础的抗栓方案(利伐沙班10 mg+阿司匹林75~100 mg,1次/d)相比以抗血小板为基础的抗栓治疗方案(氯吡格雷75 mg+阿司匹林75~100 mg,1次/d)在预防SLT上更有效。但GALILEO主研究[29]发现利伐沙班组与死亡率、血栓栓塞和出血发生率升高相关。PARTNER 3研究[30]中发现近1/4接受抗血小板治疗的患者存在SLT,且有证据表明OAC可有效地防止和逆转小叶血栓 。但即便抗凝方案未改变,SLT也可自行消退。有观察性研究[21]指出存在SLT的患者,其血栓栓塞风险升高,但这个结论并未在GALILEO和其他研究中被证实。PARTNER-3-CT亚组研究发现SLT组中瓣膜压力梯度在术后30 d和12月时有轻微升高。但由于研究规模较小,暂时还未发现小叶血栓有害于瓣膜功能或临床结果。基于现有研究报道基础上,Rheude等[31]的荟萃分析指出,不论是临床瓣叶血栓还是SLT都不会增加卒中或是TIA风险。而Sannino等[32]的荟萃分析却指出相比无血栓患者,临床瓣叶血栓患者卒中风险显著增加,但SLT卒中风险无明显增加。因此,目前TAVI瓣膜血栓与死亡、卒中、TIA和心肌梗死等临床事件的相关性尚未明确,暂无证据支持常规CT检测TAVI后有无SLT形成,需大样本量研究进一步探索[21]。
6 降低栓塞风险的其他措施
除了采用合理的抗栓方案减少栓塞事件和出血事件,还可采用手术干预的方式减少血栓栓塞的发生。栓塞保护装置可用来减少大脑栓塞,在未来可能成为一种降低栓塞风险的措施。Stachon等[33]的研究纳入41 654例行TAVI后患者,其中有3.8%的患者使用了脑栓塞保护装置,研究发现装置的使用与死亡率降低相关,但并未降低卒中或谵妄的发生率。目前关于是否应使用栓塞保护装置预防脑栓塞事件仍需更多样本数据的研究报道。另外,房颤患者存在很高的缺血性脑卒中风险,其中90%的血栓来源于左心耳,因此左心耳封堵术成为了预防房颤患者血栓栓塞发生的非药物治疗方法,尤其是对于有房颤且无法耐受OAC治疗的患者,左心耳封堵术是非常不错的选择[34]。而且左心耳封堵术的有效性和安全性已得到了验证[35-36]。专家共识也推荐,对于有OAC明确禁忌证的患者应考虑接受左心耳封堵术,以减少血栓事件的发生。
7 未来展望
接受TAVI的患者多为高龄、合并症多的患者,出血和栓塞风险较高,如何制定出个体化和精准化以及平衡好出血和血栓栓塞风险的抗栓方案仍是目前临床面临的难题。比如:对于有OAC适应证,合并房颤且存在如风湿性二尖瓣疾病的患者应使用NOAC还是VKA治疗?合并肝肾功能不全的患者如何进行抗栓治疗?对于合并静脉血栓栓塞、高凝状态或严重左心室功能障碍(左室射血分数<35%)的患者应如何抗栓治疗?未来仍需更多进一步针对特殊患者人群的研究来帮助制定出个体化和精准化的抗栓方案。
冠状动脉血运重建术对伴有主动脉瓣狭窄的无症状冠状动脉疾病患者的影响尚不清楚,未来有必要在这方面进一步研究。另外评估PCI对于合并冠状动脉疾病行TAVI患者的临床价值也是目前正在进行的随机对照试验的目标,期待未来更有效力的研究成果产生。
尽管GALILEO-4D亚组研究得出了阳性的影像学结果,但目前对于SLT的危害仍缺乏明确证据,暂无证据支持对接受TAVI后患者行常规CT检查,以明确有无SLT形成,需大样本量进一步研究,未来术后影像学介导的个体化抗栓策略是否会成为更新的方向仍在探索中。
