炎症细胞参与腹主动脉瘤的研究进展
2022-08-08蔡一帆董倩俞坤武曾秋棠
蔡一帆 董倩 俞坤武 曾秋棠
(华中科技大学附属协和医院,湖北 武汉 430000)
腹主动脉瘤(abdominal aortic aneurysm,AAA)是指腹主动脉局部节段永久性扩张且直径超过正常50%或>3 cm[1]。流行病学研究显示,随着人口老龄化,吸烟人口增加,AAA的发病率逐年攀升。然而,大多数AAA患者在动脉瘤体积增大前并无症状,因此许多AAA患者是在常规体检或X射线检查时偶然发现,当动脉瘤无法承受内部压力时,就会发生主动脉夹层甚至破裂,死亡率为80%~90%。AAA的主要治疗方法是外科修复,但90%以上的动脉瘤为小动脉瘤(3.0 cm<直径<5.5 cm),对于这部分患者,手术治疗是不合适的,因此药物治疗引起极大的关注,但至今其药物治疗仍十分有限,进一步探索AAA的潜在机制迫在眉睫。AAA较胸主动脉瘤更常见[2],且二者机制不尽相同。AAA的特征包括炎症细胞浸润、细胞外基质(extracellular matrix,ECM)降解和血管平滑肌细胞(smooth muscle cell,SMC)功能障碍,这些都与血管外膜和内膜的炎症细胞浸润有关,以上因素共同促进了血管重塑和主动脉壁的弱化。AAA的血管炎症涉及炎症细胞的趋化、促炎因子的释放,从而启动一系列炎性反应[3]。参与AAA的炎症细胞主要包括巨噬细胞、中性粒细胞、胸腺依赖淋巴细胞(T细胞)和B细胞等免疫细胞,但作为血管壁主要细胞成分的内皮细胞和SMC也发挥着一定的促炎功能,内皮细胞作为最大的内分泌器官是释放炎症因子的重要来源;SMC可以多潜能分化为合成型,甚至免疫细胞样细胞,与免疫密切相关,同样参与炎症。简而言之,炎症细胞是参与AAA炎症反应的基本和始发元素。
1 免疫细胞
先天性和适应性免疫细胞,包括巨噬细胞、中性粒细胞、肥大细胞、自然杀伤细胞(NK细胞)、树突状细胞、B细胞和T细胞等,都已被证实参与了AAA的发生和发展。其中,巨噬细胞和淋巴细胞的作用最为突出。AAA中免疫细胞的相互作用见图1。
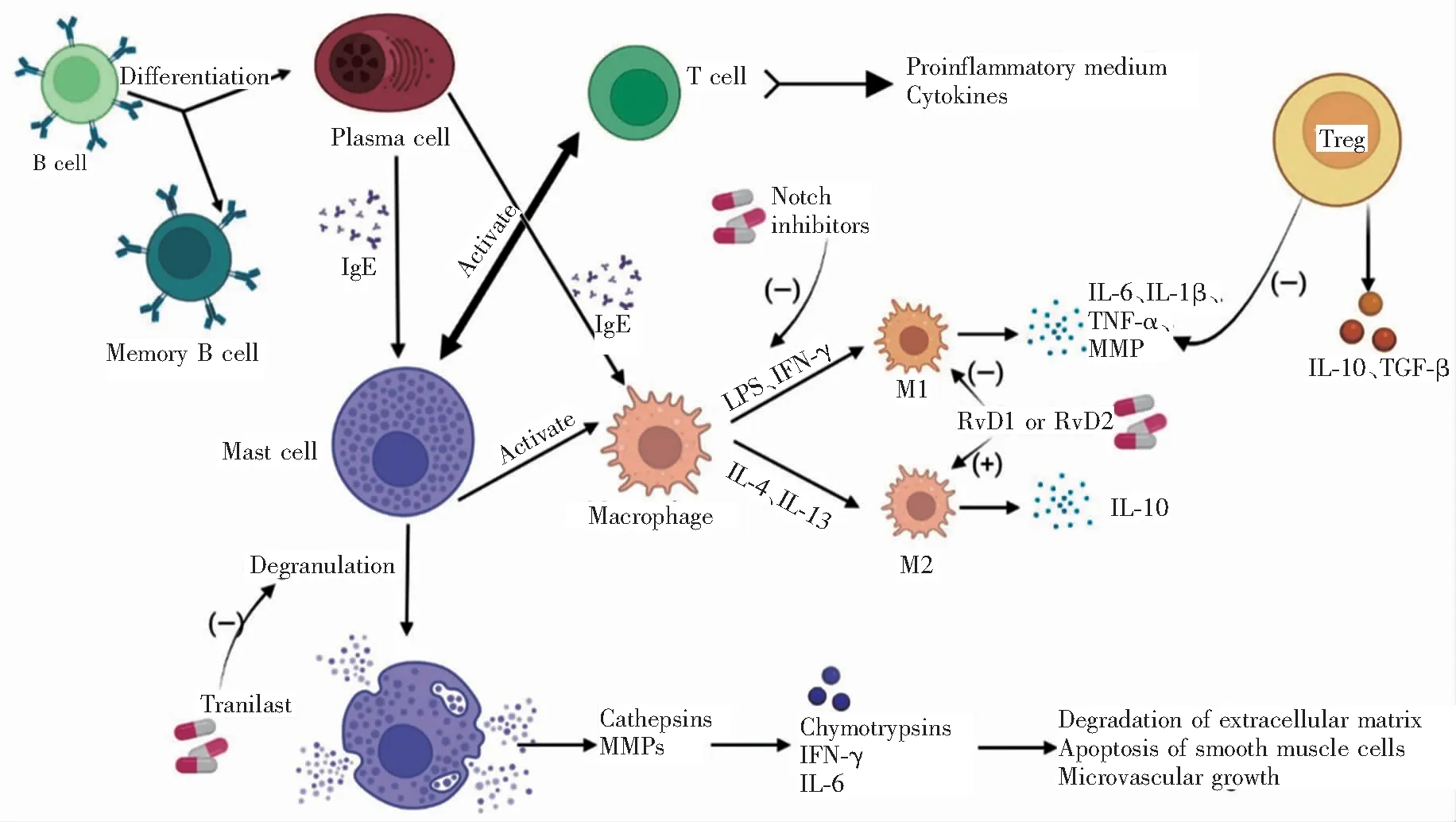
注:B cell,B细胞;Differentiation,分化;Plasma cell,浆细胞;Memory B cell,记忆性B细胞;IgE,IgE型抗体;Mast cell,肥大细胞;Degranulation,降解;Activate,激活;T cell,T细胞;Proinflammatory medium,促炎介质;Cytokines,细胞因子;Notch inhibitors,Notch通路抑制剂;Macrophage,巨噬细胞;LPS,脂多糖;IFN-γ,γ干扰素;M1,M1型巨噬细胞;M2,M2型巨噬细胞;IL,白介素;TNF-α,肿瘤坏死因子-α;TGF-β,转化生长因子-β;MMP,基质金属蛋白酶;Treg,调节性T细胞;RvD,D系列分解素;Tranilast,曲尼司特;Ca-thepsins,组织蛋白酶;Chymotrypsins,糜蛋白酶;Degradation of extracellular matrix,细胞外基质的降解;Apoptosis of smooth muscle cells,平滑肌细胞凋亡;Microvascular growth,微血管生长。
1.1 巨噬细胞
AAA组织中检测到的多种炎症细胞中,数量最多的当属巨噬细胞[4]。在血管紧张素(angiotensin,Ang)Ⅱ诱导的AAA模型中,巨噬细胞聚集是最早发生的事件之一。研究发现,AAA早期的巨噬细胞聚集仅限于内膜,可诱发弹性蛋白断裂、降解,进一步为单核细胞的招募提供了一个趋化梯度;最终,单核细胞的募集和特定基质金属蛋白酶(matrix metalloproteinase,MMP)的激活可导致降解后的弹性蛋白聚集于中膜和外膜。参与AAA的巨噬细胞有两类,包括源于胚胎前体的组织内巨噬细胞和外周血中由单核细胞分化而来的巨噬细胞。Mellak等[5]研究发现,AAA病变部位聚集的主要是单核细胞分化的巨噬细胞。单核细胞迁移到腹主动脉后可分化为两种不同的巨噬细胞亚群,包括促炎性巨噬细胞(M1)和抑炎性巨噬细胞(M2),前者先出现在主动脉外膜,由脂多糖、γ干扰素(interferon-γ,IFN-γ)等促炎介质诱导,分泌白介素(interleukin,IL)-6、IL-1β、肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)等促炎因子和蛋白水解酶,从而加重炎症,介导主动脉的扩张和血管重塑;后者则由抗炎介质IL-4、IL-13诱导,分泌高水平的抗炎因子IL-10,与肥大细胞和NK细胞共同参与ECM重塑、血管生成、胶原蛋白沉积和组织修复。在AAA的进展过程中,沉积在主动脉壁的优势细胞从M1逐渐转为M2,体现了M2促进组织修复和抗炎的代偿作用[6]。
研究发现,直接靶向单核巨噬细胞可有效治疗AAA。例如,依维莫司是一种主要用于制作药物洗脱支架的免疫抑制剂,将其应用于AngⅡ诱导的AAA模型,则可通过减少骨髓单核细胞和循环CC趋化因子受体2+单核细胞而抑制动脉瘤的形成[7]。
M1/M2失衡促进了AAA的发展[8],而重塑M1/M2平衡则可治疗AAA。Pope等[9]发现由n-3二十二碳五烯酸衍生的D系列resolvins(n-3 docosapentaenoic acid-derived D-series resolvins,RvDn-3DPA)可通过增加M2、减少M1而减轻AAA。此外,Cheng等[10]研究发现,AngⅡ诱导的AAA小鼠给予Notch通路抑制剂,可显著阻止AAA的进展,其主要机制为Notch通路抑制剂能下调诱导M1分化的细胞因子和趋化因子,从而促进M2分化(图1)。
1.2 T细胞
随着血管壁的逐渐扩张,越来越多的淋巴细胞、巨噬细胞、中性粒细胞浸润到外膜。从AAA组织中发现,超过50%的淋巴细胞都是CD3+T细胞,包括CD4+和CD8+T细胞[11]。
1.2.1 CD4+T细胞
Xiong等[12]发现在CD4+T细胞缺陷的小鼠中CaCl2无法诱导AAA形成,这说明CD4+T细胞在AAA的进展中起着不可或缺的作用。然而迄今为止,辅助性T细胞(helper T cell,Th cell)亚群1(Th1)或2(Th2)及其分泌的细胞因子对AAA的促进或抑制作用尚未完全阐明,且其中的机制十分复杂,图2对Th1和Th2细胞在AAA形成中的作用机制进行了详细的描述。
CD4+T细胞可在不同的炎症微环境中分化成不同的亚群,包括Th1细胞、Th2细胞、Th17细胞、调节性T细胞(regulatory T cell,Treg)等。通过流式细胞术发现,人AAA组织中最常见的T细胞是Th2,而Th1细胞很少,因此认为Th2细胞在人类AAA进展期发挥主导作用。然而AAA形成早期多与动脉粥样硬化相关,而动脉粥样硬化中起主导作用的则是Th1细胞。据此推测,AAA的形成是Th1、Th2细胞分阶段共同作用的结果[11]。具体而言,在动脉粥样硬化形成的早期,炎症细胞募集和脂质积累一方面可促进内膜增生,另一方面将作为第一个触发因素激活Th1细胞,后者分泌IL-2、IFN-γ等细胞因子,再作用于内皮细胞、SMC、局部浸润的巨噬细胞和血小板,促使它们分泌趋化因子、黏附分子、共刺激分子、血小板源生长因子和转化生长因子-β等炎症介质,且SMC的募集、增殖和ECM合成使纤维帽增厚,最终内膜进一步增厚,管腔狭窄。接下来,吸烟或遗传等因素作为第二个触发点,诱导Th2型细胞因子IL-4、IL-5、IL-9和IL-10等表达,伴有IFN-γ信号通路下调,导致巨噬细胞分泌MMP增多,如MMP-9和MMP-12,这些蛋白酶降解主动脉的弹性层,导致血管扩张,最终形成AAA。见图2。
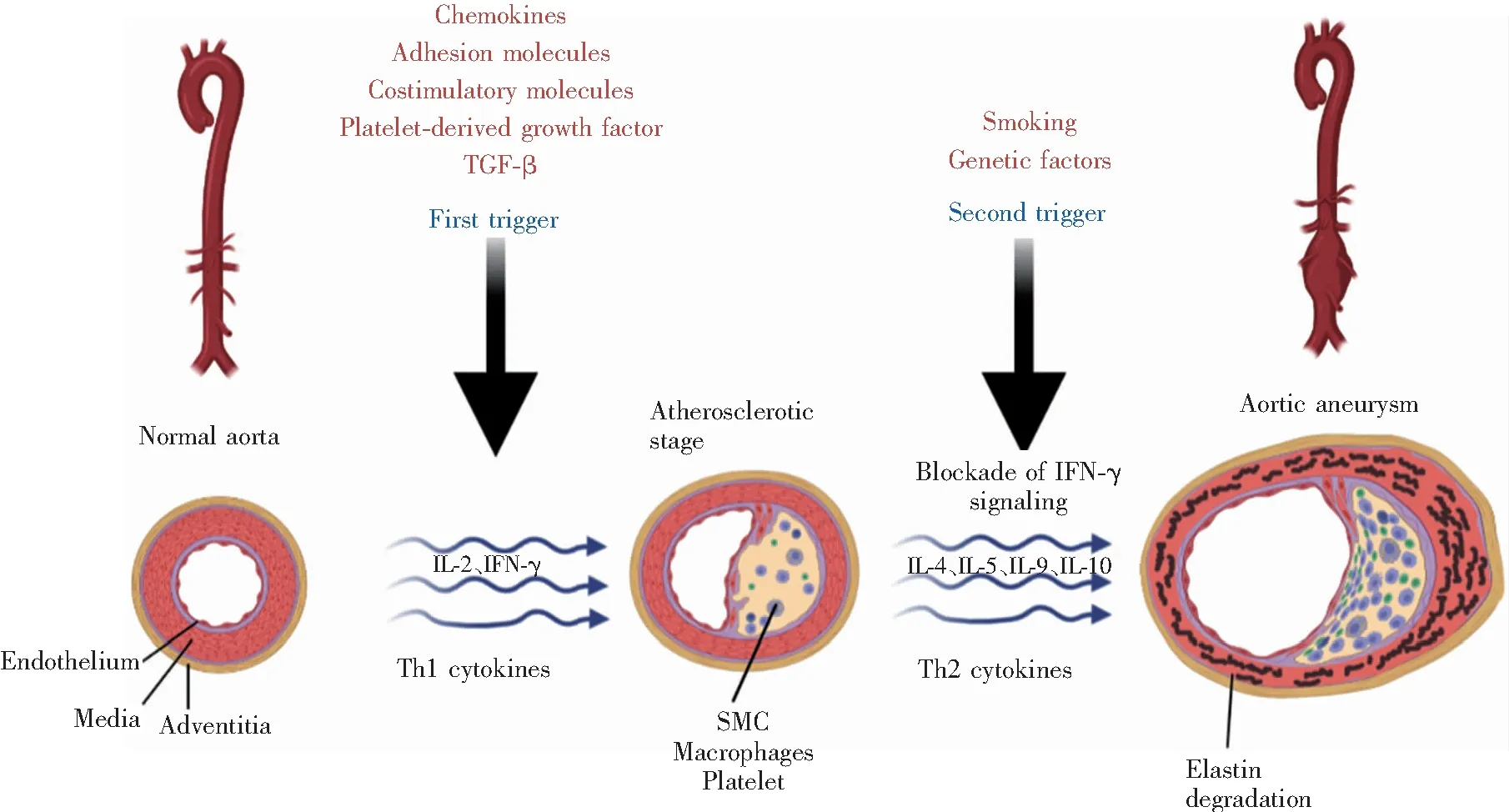
注:Normal aorta,正常主动脉;Chemokines,趋化因子;Adhesion molecules,黏附分子;Costimulatory molecules,共刺激分子;Platelet-derived growth factor,血小板源生长因子;TGF-β,转化生长因子-β;Smoking,吸烟;Genetic factors,基因因素;First trigger,第一个触发点;Second trigger,第二个触发点;Atherosclerotic stage,动脉粥样硬化阶段;Blockade of IFN-γ signaling,γ干扰素信号通路阻断;Aortic aneurysm,主动脉瘤;Endothelium,内膜;Media,中膜;Adventitia,外膜;Th1 cytokines,Th1型细胞因子;Th2 cytokines,Th2型细胞因子;Macrophages,巨噬细胞;Platelet,血小板;Elastin degradation,弹力蛋白的降解。
治疗方面,有研究[13]发现抗IL-4或先天性缺乏IL-4可延缓AAA的形成,并伴有巨噬细胞MMP-9和MMP-12的表达降低,这表明阻断IL-4有望成为预防和治疗AAA的新策略。
1.2.2 CD8+T细胞
针对CD8+T细胞对AAA的直接作用的研究相对较少。Zhou等[14]通过构建弹性蛋白酶诱导的小鼠AAA模型,首次证明CD43+CD8+T细胞在AAA中的致病作用,该研究揭示了CD8+T细胞膜表面CD43+可诱导IFN-γ生成,IFN-γ又反过来参与炎症级联反应,最终促进动脉瘤的发展。
1.2.3 Treg细胞
AAA患者CD4+CD25+Treg细胞数量和功能是缺陷的,Yodoi等[15]发现Foxp3+Treg可通过抑制炎症反应来减轻动脉瘤,其机制可能涉及促炎细胞因子表达和MMP-2、MMP-9水平下降,以及抗炎细胞因子表达增强。
进一步的研究揭示了Treg细胞调控AAA可能的方式及机制。Meng等[16]发现,外源性Treg治疗可显著减少动脉瘤内巨噬细胞和CD4+T细胞浸润,以及减轻SMC凋亡。同时,Treg细胞还能降低上述细胞促炎细胞因子、MMP-2和MMP-9的水平,增加抗炎细胞因子IL-10和转化生长因子-β的表达,抑制氧化应激和SMC凋亡。此外,Treg细胞的抑制功能与Foxp3的乙酰化水平密切相关,沉默信息调节因子1又可特异性地调节Foxp3的乙酰化。Jiang等[17]研究发现沉默信息调节因子1抑制剂EX-527可恢复Foxp3的乙酰化,增加活性Treg细胞数量,从而恢复Treg细胞对AAA的抑制能力。再者,Treg细胞可通过直接产生多种细胞因子来发挥作用。Zhou等[18]发现Treg细胞可通过释放IL-10而抑制炎症细胞趋化性、动脉壁重塑和动脉瘤生成。
当前,过继转输Treg细胞在治疗动物的AAA模型中已取得重大成功,AAA患者Treg细胞的离体扩增能确切减少人源化小鼠动脉瘤的大小[19]。
1.3 B细胞
B细胞可分为B1和B2细胞,尤其是B2细胞在AAA中含量丰富,刺激后主要被特异性募集到主动脉壁的外膜。Schaheen等[20]使用弹性蛋白酶灌注或AngⅡ输注ApoE-/-小鼠的两种AAA模型,证明了抗CD20抗体介导的B细胞耗竭可增加Treg细胞和表达吲哚胺2,3-双加氧酶的浆细胞样树突状细胞(plasmacytoid dendritic cell,pDC)的数量,并创造一种免疫抑制环境,从而减弱炎症基因的表达,最终抑制AAA的生长。然而,Meher等[21]发现在无其他B细胞亚群的情况下,B2细胞可通过上调Treg细胞和减少单核细胞的数量来抑制成熟B细胞缺陷的小鼠AAA的形成。上述结果的差异可能是AAA中的B细胞功能受损,此时B细胞分泌的免疫球蛋白是病理性的,失去了正常功能,而B2细胞的移植可能会产生健康的保护性抗体。目前B细胞在AAA中作用的相关研究很少,但B细胞和免疫球蛋白数量的调节可能为AAA的治疗带来新的机遇。
1.4 肥大细胞
有研究[22]发现,AAA组织的外膜和中膜分布有大量肥大细胞,且数量与动脉瘤的最大直径成正比。功能上,肥大细胞可激活T细胞和巨噬细胞[23],从而产生一系列促炎介质和细胞因子,反过来,肥大细胞又可通过直接接触被T细胞所激活。有研究[24]发现肥大细胞活化、脱颗粒后释放组织蛋白酶和MMP,激活糜蛋白酶以及IFN-γ和IL-6等细胞因子,进一步降解ECM,介导中层SMC凋亡和微血管生长,促进AAA的发展。基于此,可应用肥大细胞稳定化合物阻止肥大细胞产物的释放,从而治疗AAA。例如曲尼司特,一种肥大细胞脱颗粒抑制剂,能延缓AAA的进展。
1.5 NK细胞
AAA患者外周血中的NK细胞显著增加,从而导致细胞毒活性增加并促进AAA的形成。最新研究表明,NK细胞显著增加的原因包括抗原刺激的持续存在和促炎细胞因子的增加。首先,许多与AAA发展有关的抗原或风险因素,如肺炎衣原体,由组织缺氧诱导产生的脂质或蛋白质,可促进NK细胞的活化,随后IFN-γ产生并驱动血管组织中细胞介导的Th1反应,进一步促进NK细胞活化。其次,AAA组织内炎症细胞的存在可作为持续全身免疫系统激活的病灶。由主动脉组织内的白细胞产生的促炎细胞因子如TNF-α、IL-6和IL-1β将驱动骨髓前体产生NK细胞以及NK细胞的活化[25]。
1.6 树突状细胞
树突状细胞(dendritic cell,DC)负责摄取、加工抗原,并将抗原呈递给T细胞和B细胞。一般来说,DC表达CD11c和主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类,但一旦被激活,它们会增加表面MHC-肽复合物和共刺激分子的表达。Dubis等[25]通过白喉毒素的注射耗竭了全身的CD11c+细胞,发现耗竭后Ang诱导的AAA模型小鼠主动脉的最大直径显著减少,这为AAA的治疗研究提供了新的靶点。
DC分为经典树突状细胞(conventional dendritic cell,cDC)、单核细胞衍生的DC、pDC和朗格汉斯细胞。由于朗格汉斯细胞的主要驻留部位是表皮和黏膜,因此参与AAA的主要是前三者。
pDC是一个独特的DC谱系,主要用于细胞因子的产生,而不是抗原呈递,它能产生Ⅰ型干扰素,例如IFN-α和IFN-β,通过激活效应T细胞、细胞毒性T细胞和NK细胞来促进炎症,这些炎症细胞可进一步促进AAA的发展。cDC1通过MHCⅠ类分子促进Th1细胞激活,还可产生IL-12来激活自然杀伤反应。cDC2则通过MHCⅡ类分子交叉呈递抗原来促进Th1细胞的增殖。单核细胞衍生的DC具有转化为cDC的潜力,体内试验表明它们可诱导Th1和Th17细胞极化。然而,关于DC亚群在AAA中具体作用的研究甚少。
2 SMC
SMC的凋亡和主动脉中膜的退化被认为是AAA病理学的标志,炎症、活性氧的产生都与AAA中的SMC凋亡有关。事实上,SMC在AAA中扮演的角色是多面的,其既可直接影响AAA的进展,又可通过调节炎症反应发挥间接作用,此处主要概述其间接调节的方式。
首先,SMC与巨噬细胞有着密切联系。巨噬细胞可产生IL-1、TNF-α等细胞因子,这些细胞因子是SMC的有丝分裂原[26],且巨噬细胞可通过其自身衍生的神经素1来调节血管SMC中的细胞内钙通量,从而特异性诱导SMC中的MMP-3活性,影响SMC的功能;SMC产生的MMP-3有助于增强巨噬细胞诱导的ECM降解[27]。最近,Gurung等[28]应用谱系追踪技术证实,在人类AAA组织中,SMC能分化为巨噬细胞样细胞,具体来说是SMC向巨噬细胞样LGALS3+和CD68+细胞的表型转换。
其次,SMC亦可产生IL-1、IL-6等细胞因子,上述细胞因子是SMC调节AAA炎症反应的主要手段。例如正常情况下,IL-6主要在巨噬细胞和T细胞等免疫细胞中表达,但在主动脉壁张力升高时主要由SMC表达。一项大型病例对照研究揭示,IL-6启动子中的单核苷酸多态性(rs1800796,-572G>C)是AAA的独立危险因素[29],可见SMC可通过分泌IL-6来促进AAA的进展。
巴多昔芬已被美国食品和药物管理局批准用于临床治疗骨质疏松症,但在AAA中尚无应用。Yan等[30]发现巴多昔芬可抑制IL-6与其受体结合,减少p-STAT3、MMP-2和MMP-9的表达,降低IL-6/GP130/STAT3信号通路的活性,从而减轻ApoE-/-小鼠AAA的严重程度。作为美国食品和药物管理局批准的具有已知药代动力学和安全性的药物,巴多昔芬在临床上用于治疗AAA具有很大的潜力。
3 内皮细胞
内皮细胞是衬在血管腔内的单层鳞状上皮细胞,参与许多生理活动以维持血管壁的正常结构和功能。在动脉壁内,内皮细胞分泌多种影响包括SMC、白细胞等其他细胞功能的物质,从而对中膜层和外膜层的炎症反应造成影响。在AAA的发生和发展中,内皮细胞可通过多方面来调节炎症。
首先,内皮细胞可合成多种炎症相关介质。例如内皮白细胞黏附分子、E选择素、细胞间黏附分子-1等。激活的内皮细胞上血管细胞黏附分子-1表达上调可促进内皮细胞-白细胞的相互作用,促进白细胞和巨噬细胞的黏附,从而促进AAA的进展[31]。
其次,有证据表明,核因子κB介导了多种与主动脉壁炎症和氧化反应相关的基因。当内皮细胞的核因子κB通路被阻断时,动脉中膜和外膜的炎症细胞浸润,炎症因子表达和氧化应激反应均减少,从而抑制了动脉瘤的形成,这表明内皮细胞能通过其自身的转录因子核因子κB来促进炎症,从而促进动脉瘤的发展[32]。基于上述研究,阻断内皮细胞-白细胞作用的黏附分子或关键转录因子将为AAA的防治提供全新的思路。
4 小结与展望
本文总结了各种炎症细胞在AAA中的动物和临床研究证据。实际上,各类炎症细胞之间以及炎症细胞与炎症因子之间相互作用、错综复杂,共同构成了特定的炎症微环境,促进或延缓AAA的进展。当前,关于抗IL-β特异性抗体治疗冠心病的CANTOS研究和关于秋水仙碱治疗急性心肌梗死的COLCOT研究取得了积极的结果,具有心血管疾病抗炎治疗的里程碑意义[33-34]。尽管有关IL-1β抗体治疗AAA的临床试验正在进行,但大多数有关炎症反应在AAA中的研究仍停留在动物模型或体外试验中,许多治疗药物在动物方面取得巨大成功,但在临床上效果不好甚至反作用。其有多方面原因,例如与人类不同,小鼠经常出现的是肾上性AAA,经典的三种动物模型还是不足以精确地模拟人类慢性AAA的形成过程,在体内和体外的细胞和分子机制也不同,且许多治疗方案应用于临床可能带来的并发症都是未知的,理想中更好的生物利用度和更少的副作用还有很长一段路要走。因此,如何从炎症网络中筛选出合适且可能有效的靶点仍是主要难题之一。此外,新型抗炎因子和免疫细胞在AAA中的作用及机制有待阐明,新机制可能带来新靶点。未来,期望抗炎治疗成为AAA防治的破局之道。
