免疫检查点抑制剂相关性心肌炎的诊治
2022-08-08肖乾凤王斯刘燕扬魏欣
肖乾凤 王斯 刘燕扬 魏欣
(1.四川大学华西医院心脏内科,四川 成都 610041; 2.四川大学华西医院肺癌中心,四川 成都 610041)
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)是目前肿瘤治疗领域的热点。根据作用靶点,可将ICIs分为程序性细胞死亡蛋白(programmed cell death protein,PD)-1阻断剂、程序性细胞死亡蛋白配体-1(programmed cell death ligand-1,PD-L1)阻断剂和细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)阻断剂[1-2]。随着这些药物在临床上的广泛应用,越来越多的肿瘤患者可能表现出毒副作用,包括心血管系统的并发症。ICIs相关的心脏并发症最常见的为心肌炎,因死亡率相对较高,临床可危及生命,且ICIs对心脏的毒副作用使其在肿瘤治疗中受限,故ICIs相关性心肌炎最受关注[2-3]。
1 流行病学
总的说来,ICIs引起心血管系统并发症的发生率较低,ICIs相关性心肌炎发病率为0.09%~1.14%,而致死率较高,死亡率为39.7%~50.0%[2,4-6]。有研究[5-7]表明,单独使用PD-1阻断剂的患者心肌炎发病率为0.5%,单独使用PD-L1阻断剂的患者心肌炎发病率为2.4%,单独使用CTLA-4阻断剂的患者心肌炎发病率为3.3%,而联合PD-1和CTLA-4阻断剂的患者心肌炎发病率则为2.4%,联合PD-L1和CTLA-4阻断剂的患者心肌炎发病率为1.0%。由此可见,CTLA-4阻断剂引起心肌炎的风险最高,而ICIs联合治疗导致心肌炎较单独使用发病率更高。男性ICIs相关性心肌炎发病率大于女性,多中心注册研究[4]显示,71%的ICIs相关性心肌炎患者为男性。其他引起ICIs相关性心肌炎的危险因素包括:之前使用过其他类型的抗肿瘤药物(血管内皮生长因子抑制剂和蒽环类化学制剂等)或放疗,这些治疗可能诱导心脏抗原暴露,引起心脏特异性免疫反应而导致心肌炎[5]。肥胖和糖尿病也是ICIs相关性心肌炎的独立危险因素[3]。
2 ICIs相关性心肌炎的发病机制
ICIs引起心肌炎的病理生理机制尚不清楚。目前认为肿瘤本身及免疫治疗均可能激活T细胞群的克隆,T细胞群可迁移到心肌细胞中,因与心肌细胞主要组织相容性复合物Ⅰ呈现相同的抗原,从而可引起交叉反应导致心肌炎。这一证据来源于ICIs相关性心肌炎死亡患者尸检发现心脏中有大量炎性细胞浸润、细胞外间隙增大和心肌细胞死亡。这些炎性细胞包含CD4+、CD8+的T细胞和巨噬细胞,但不含B细胞。有研究证实两个T细胞亚群都需PD-1来维持其对心肌自身成分的耐受性。在黑色素瘤的病例中,心脏、骨骼肌和肿瘤的T细胞受体测序结果显示所有组织中的T细胞克隆相似。这些肿瘤的RNA测序显示有心脏特异性基因的表达[7-12]。在动物模型中,CTLA-4和PD-1都显示出对免疫介导性损伤的心脏保护作用。小鼠PD-1缺失可导致自发性心肌炎,表现出炎症加重、心肌损伤标志物增加以及炎性细胞(包括CD8+T细胞)浸润增多,而在CTLA-4基因敲除小鼠中观察到CD8+T细胞介导的快速致死性自身免疫性心肌炎。还有研究[3,8,11-13]发现,PD-1及配体PD-L1基因缺失,以及PD-L1阻断剂的治疗,均可导致短暂性心肌炎并发展为致命疾病,这些均证实PD-1信号在保护心肌免受自身反应性T淋巴细胞伤害方面起到关键作用。此外,ICIs或其他药物可能会引起超敏反应,引发嗜酸性粒细胞性心肌炎,这可能解释了ICIs引起急性心肌炎的另一种机制[8,10]。酪氨酸激酶抑制剂可导致非靶向心脏毒性,可能增加心肌细胞对ICIs介导的炎症的敏感性。因此,酪氨酸激酶抑制剂也可能增加ICIs相关性心肌炎的发生[14]。
3 ICIs相关性心肌炎的临床表现
从ICIs治疗开始到出现心肌炎的时间范围较广。发病通常发生在ICIs治疗开始后1~2个月内[5],有研究[6]发现,从开始ICIs治疗到临床心肌炎的中位发病时间为34 d(四分位区间21~75 d),比其他器官或系统(包括肾、肝、内分泌、肺和胃肠道)出现并发症的时间早。世界卫生组织的数据表明,在最初接受过两次ICIs治疗后的59例患者和ICIs治疗6周以内的33例患者中,分别有64%和76%报告有ICIs引发的心肌炎[15]。如联合使用PD-1/PD-L1和CTLA-4阻断剂,心肌炎可能会更早发生,联合治疗后心肌炎的发生时间中位数为17 d(发病时间为13~64 d)[5]。从发病平均年龄上看,ICIs相关性心肌炎通常比普通心肌炎发病年龄更大,为64~65岁[8,16]。
ICIs相关性心肌炎患者的临床表现千差万别,可表现为轻微的非特异性症状,如疲劳、乏力、胸痛和呼吸困难或心悸等,严重者可表现为晕厥、心源性休克甚至心脏性猝死,ICIs相关性心肌炎患者也可出现各种快速心律失常(心房或心室)或心脏传导阻滞[6,11,16-17]。ICIs相关性心肌炎患者临床症状以呼吸困难最多见,胸痛和心悸其次,分别占49%~76%、14%~34%和14%,而70%的患者以上症状合并存在,此外多数患者(约83%)表现为心力衰竭[8,16]。另外,ICIs相关性心肌炎临床表现可能不典型,如恶心或常伴有其他系统的损害,如肌炎、重症肌无力和肝功能损害等[18-20]。
4 ICIs相关性心肌炎的诊断检查
ICIs相关性心肌炎常伴有心肌标志物水平升高、心电图改变以及心脏彩超或心脏磁共振(cardiac magnetic resonance,CMR)等影像学的改变。
4.1 心肌标志物水平
有研究[8]表明,ICIs相关性心肌炎患者有94%~97%伴有心肌标志物水平的升高,心肌标志物水平的升高程度反映了心肌损害的程度,通常暴发性心肌炎患者心肌标志物水平升高明显[11]。此外,心肌标志物水平一定程度上反映预后,有研究[5-6]表明肌钙蛋白T>1.5 ng/mL时发生主要心血管事件的风险增加4倍。在伴发肌炎时,肌酸激酶、肌酸激酶同工酶甚至肌钙蛋白T水平均显著升高,此时,肌钙蛋白I为心肌损伤的特异性标志物[21]。除有心肌标志物水平的升高外,几乎所有的ICIs相关性心肌炎患者伴有脑钠肽水平的升高[16]。脑钠肽水平虽然在ICIs相关性心肌炎中常升高,但对心肌炎的诊断无特异性[21]。
4.2 心电图
心电图变化可用于支持或确定心肌炎的诊断,它是一种快速、方便且廉价的检测手段,90%以上的ICIs相关性心肌炎有心电图的改变[5,8,16],包括ST段抬高、ST段压低、T波倒置、QT间期延长、房性期前收缩、室性期前收缩、心房颤动、室性心动过速以及不同程度的房室传导阻滞[8,16-18,22-26]。心电图的改变应是动态的,ICIs相关性心肌炎最常见的是新发的心律失常(包括室性心动过速及传导阻滞)和ST-T的改变[21,27]。因此每次ICIs给药前或患者有症状时,建议进行心电图检查。心电图诊断ICIs相关性心肌炎灵敏度高但特异性低[5,21]。
4.3 心脏彩超
ICIs相关性心肌炎患者心脏彩超检查可伴有左室射血分数(left ventricular ejection fraction,LVEF)明显下降或轻度下降[6,8,16-17],少数患者可表现为左心室收缩功能正常[23],但心脏收缩功能正常并不能反映ICIs相关性心肌炎病情的严重性[11]。此外,超声心动图可显示心腔扩大,节段性或弥漫性搏动减弱,也可呈现室壁厚度增加、舒张功能减退以及心包积液[5,22]。室壁节段性运动异常是超声心动图最重要的参数,对ICIs相关性心肌炎有诊断价值[5,21,27]。但与肌钙蛋白和心电图相比,LVEF对于发现心肌损伤不敏感且延迟[5]。根据世界卫生组织的队列研究[6]显示,在症状出现时有49%的病例出现LVEF下降。
4.4 CMR
CMR是一种无创的金标准诊断方法,与超声心动图相比有许多明显的优点。约80%的ICIs相关性心肌炎患者伴有CMR的异常[17],有研究表明,33%的患者CMR出现心肌水肿,而23%的患者表现为心肌延迟强化(late gadolinium enhancement,LGE)[16],ICIs相关性心肌炎的LGE部位可在心外膜下和心肌中层,也可呈现弥漫性[6]。CMR伴有T2加权水肿、T2和T1标记成像异常、LGE和细胞外体积分数异常,可为ICIs相关性心肌炎提供确诊信息[27-29]。CMR显示心包积液,LGE、T1或T2成像发现心包异常伴局部或整体室壁运动异常提示疑似诊断ICIs相关性心肌炎[29]。还有报道[30]表明,LGE区域与组织学上的T淋巴细胞浸润直接相关。CMR对ICIs相关性心肌炎的诊断和判断预后具有重要价值,可指导肿瘤医师的治疗策略[5]。
4.5 心肌活检
心内膜心肌活检(endocardial myocardial biopsy,EMB)是诊断ICIs相关性心肌炎的金标准[5,21]。ICIs相关性心肌炎的病理表现为炎症浸润和心肌细胞坏死,免疫组化染色显示以CD8+T细胞为主,伴有CD4+T细胞和巨噬细胞分布[29]。有31%~52%的ICIs相关性心肌炎患者EMB或尸检的组织学显示炎性细胞浸润[8],主要表现为T淋巴细胞浸润[6,11,28,31]。然而,心肌活检为侵入性操作,若病灶较局限可能取不到病变组织。另外,对危重患者风险较大,在临床实践中并不适合作为常规推荐。
4.6 冠状动脉造影
冠心病是引起临床表现、生物标志物水平升高或影像学异常的常见原因,冠状动脉造影可排除冠心病而有助于心肌炎的诊断。
综上,ICIs相关性心肌炎的诊断需结合患者病史(特别是ICIs用药史及使用ICIs到发病时间)、临床症状及体征、心肌标志物、心电图、超声心动图、CMR、EMB以及冠状动脉造影进行综合评估和危险分层[21,32]。诊断标准和风险分级如下表(表1和表2)。

表1 ICIs相关性心肌炎诊断标准[29]

表2 ICIs相关性心肌炎的危险分级[29]
5 ICIs相关性心肌炎的治疗
如怀疑ICIs相关性心肌炎,目前的共识建议停用ICIs,即使是轻症患者,也不推荐ICIs相关性心肌炎患者再次启用ICIs治疗。
绝大多数ICIs相关性心肌炎需考虑糖皮质激素治疗,可选择口服强的松或静脉使用甲基强的松龙,推荐剂量建议为1 mg/(kg·d)[5,33]。如24 h内无改善或患者血流动力学不稳定,可考虑予甲基强的松龙1 000 mg/d冲击治疗,若临床情况趋于稳定时,通常在3~5 d后逐渐减量至1 mg/(kg·d),对于持续使用多长时间及多久可减少糖皮质激素剂量,目前尚不统一,建议至少持续4~6周。对于大剂量糖皮质激素治疗无反应或肌钙蛋白持续升高的患者,可考虑静脉注射免疫球蛋白、霉酚酸酯、英夫利昔单抗、抗胸腺细胞球蛋白、阿伦单抗和阿巴西普等药物[5-7,13,34-35]。血浆置换术可能用于某些ICIs相关性心肌炎患者[36-37]。此外,在ICIs相关性心肌炎慢性期,需予标准的抗心力衰竭和抗心肌重构治疗,如可耐受,则可考虑使用β受体阻滞剂和血管紧张素转化酶抑制剂或血管紧张素Ⅱ受体阻滞剂并滴定至目标剂量,但无证据表明使用血管紧张素转化酶抑制剂/血管紧张素Ⅱ受体阻滞剂或β受体阻滞剂可预防ICIs相关性心肌炎[5]。此外,ICIs相关性心肌炎应予以对症支持治疗,包括纠正心力衰竭、控制心律失常和稳定患者血流动力学状态。对于心源性休克患者,可考虑使用体外膜氧合等器械循环支持。
6 结论
ICIs在肿瘤领域的广泛应用使其心血管副作用日益凸显,ICIs相关性心脏毒性以心肌炎最常见,死亡风险高。因此,在临床实践中,需结合患者病史、临床表现及检查来评估该类患者的诊断及治疗(表3和图1)。

表3 ICIs相关性心肌炎的诊断评估
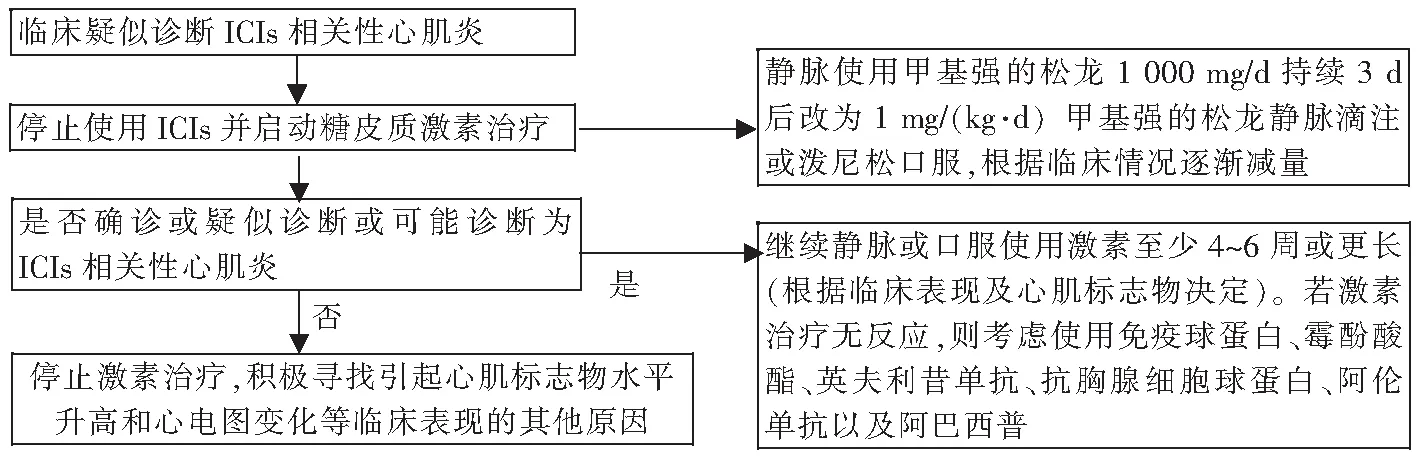
图1 ICIs相关性心肌炎的诊治流程[29]
