牛蒡多糖特性分析及对脂多糖诱导巨噬细胞炎症的调节作用
2022-08-06朱姗姗朱文卿张超杰郑振佳
朱姗姗,张 斌,朱文卿,陈 锵,张超杰,郑振佳,
(1.山东农业大学食品科学与工程学院,山东省高校食品加工技术与质量控制重点实验室,山东泰安 271018;2.山东博德医药研究院有限公司,山东德州 253084)
牛蒡(Arctium lappaL.)为药食同源的两年生菊科植物,作为食用蔬菜被广泛种植[1−2]。目前种植的主要品种有:东京理想、东京白肌、柳川理想、白肌大长以及地皇早生等,牛蒡中含有多糖、萜酸、酚类、蛋白质以及黄酮类等多种活性成分[3−5],具有抗炎、抗氧化、免疫调节和抗肿瘤等多种生物学和药理学活性[6−8]。多糖是牛蒡中含量较高的成分,具有多种生物活性如抗炎、抗氧化以及降血糖等[9]。
炎症是由多种促炎细胞因子和介质诱导的复杂病理现象,是机体对于组织损伤或致病因子侵入做出的一种防御反应[10]。研究表明,炎症因子异常激活将引发各种疾病[11],其中,NO、TNF-α、IL-1β和NFкB2 等作为重要的炎症因子,在调节多种生理功能方面起到重要作用[12]。合成的抗炎药物通常具有一定的副作用,因此,开发基于食物来源的低副作用抗炎药物十分必要,牛蒡多糖具有一定的抗炎效果,但其特性及体外消化情况研究较少。
本实验以柳川理想牛蒡为研究对象,采用热水回流法提取多糖,通过紫外光谱、红外光谱以及离子色谱进行分析,研究了其单糖组成及体外消化特性并利用细胞抗炎模型对牛蒡多糖的抗炎活性进行评价,以期为牛蒡资源的合理开发提供依据。
1 材料与方法
1.1 材料与仪器
牛蒡干切片 江苏沛县轶伟有限公司,品种为柳川理想牛蒡;胎牛血清 美国Sigma 公司;双抗索莱宝科技有限公司;DMEM 高糖培养基、PBS 大连美仑生物技术有限公司;一氧化氮(NO)试剂盒中国南京建成生物工程研究所(A012-1-2);脂多糖(LPS) 北京索莱宝科技有限公司;胃液、肠液、葡聚糖(180、342、1000、2000、3000、5000、7000、9000 Da)以及单糖标准品(岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、木糖、果糖、半乳糖醛酸以及葡萄糖醛酸) 上海源叶生物科技有限公司;RAW.264.7 细胞 美国模式培养物集存库;氯化钠(NaCl) 天津市凯通化学试剂有限公司;氢氧化钠(NaOH) 天津市巴斯夫化工有限公司;盐酸(HCl)莱阳市康德化工有限公司。
IE204E 型电子分析天平 梅特勒-托利多仪器有限公司;ICS-5000 离子色谱仪、CO2恒温培养箱美国赛默飞世尔科技有限公司;酶标仪 美国伯腾仪器有限公司;SCIENTZ-18ND 真空冷冻干燥机宁波新芝生物科技股份有限公司;水浴锅 江苏金怡仪器科技有限公司;Zetasizer-Nano-ZS 激光纳米粒度分析仪 英国Malvern 公司;LC-20A 高效液相色谱仪 日本岛津仪器有限公司;ST 2100 酸度计常州奥豪斯仪器有限公司。
1.2 实验方法
1.2.1 牛蒡多糖的提取与纯化
1.2.1.1 牛蒡多糖的提取 采用热水回流法从牛蒡中提取多糖[13−14]。牛蒡粉碎后过60 目筛,80 ℃水提(10:1,v/w)两次,每次1.5 h,将合并的上清液于55 ℃下用旋转蒸发仪浓缩至体积的1/3。
1.2.1.2 牛蒡多糖的纯化 多糖提取液经等体积的石油醚萃取脱脂,水相再经乙酸乙酯对多酚等组分进行脱除,最后采用Sevag 法脱除水相中的蛋白质,以糖溶液:氯仿-正丁醇(4:1)为1:4 混合,充分振摇后离心(3000 r/min,15 min),弃去下层不溶性物质,重复萃取5~7 次,直至无变性蛋白层,将上清液浓缩至1/3 体积,加入4 倍体积的无水乙醇沉淀24 h,将沉淀部分复溶,浓缩至1/3 体积后进行透析(截取30 cm长度透析袋,用蒸馏水煮沸5 min 后,用60 ℃蒸馏水洗冲2 min,置4 ℃蒸馏水中待用,将浓缩后的多糖样品溶液放入截留分子量为500 Da 的透析袋中,透析48 h,每4 h 更换一次蒸馏水),将透析后溶液放于−18 ℃保存后冷冻干燥48 h,得牛蒡多糖(苯酚硫酸法[15]测得糖含量为83.07%)。
1.2.2 紫外光谱分析 配制牛蒡多糖(1 mg/mL)溶液,进行紫外-可见全波长扫描[16]。
1.2.3 多糖分子量的测定 采用高效液相色谱法分析消化过程中多糖分子量,色谱柱为Shodex OHpak SB-802 HQ、802.5 HQ 和803 HQ 串联,以0.3 mol/L NaNO3为流动相,0.3 mL/min 为流速,进样量20 μL,柱温为30 ℃,以系列葡聚糖标准品进行校准。配制5 mg/mL 的牛蒡多糖样品,用0.22 μm 的水系滤头过滤,实验重复三次。
1.2.4 红外光谱分析 采用傅里叶红外光谱(FTIR)对多糖进行分析[11]。扫描范围为4000~500 cm−1,分辨率为4 cm−1,重复三次。
1.2.5 单糖组成的测定 采用高效阴离子交换色谱-脉冲安培法对牛蒡多糖进行测定,分别用不同浓度的单糖标准品绘制标准曲线,对牛蒡多糖中单糖组成进行定性及定量分析[17]。在含有2 mL 三氟乙酸(TFA)的试管中在80 ℃下水解10 mg 多糖粉末6 h,然后旋转蒸发用于去除残留的TFA。用超纯水将样品体积调节至10 mL 后,在Supelclean™ ENVI-18 SPE管(30 mg/mL)和0.22 μm 微孔过滤器上进行纯化。使 用Dionex™ AminoPac™ PA10 IC 柱(Dionex,3 mm×250 mm)进行分析,使用0.20 mol/L NaOH 溶液和1.00 mol/L 醋酸钠溶液作为流动相,柱温设置为30 °C,最小流量设置为0.25 mL。
1.2.6 牛蒡多糖的物理稳定性
1.2.6.1 pH 对多糖稳定性的影响 通过添加不同量的0.5 mol/L HCl 或NaOH 将制备的多糖溶液调节至所需的pH(2.0、3.0、4.0、5.0、6.0、7.0、8.0 和9.0),4 ℃条件下储存24 h 后对其粒径进行测量[18]。
1.2.6.2 NaCl 浓度对多糖稳定性的影响 通过添加不同质量的NaCl 以获得具有不同浓度(0、50、100、150 和200 mmol/L)的多糖溶液。4 ℃条件下储存24 h 后对其粒径进行测量[18]。
1.2.6.3 温度对多糖稳定性的影响 将新制备的多糖溶液分别放置于30、40、50、60、70、80 和90 ℃环境条件中1 h 后取出放凉至室温,分别取1 mL 溶液放入马尔文激光粒度仪进行粒径的测定[18]。
1.2.7 体外模拟胃肠道消化 参考文献[19]报道的体外消化方法稍作修改。
胃液消化:将牛蒡多糖(10 mg/mL)的浓度和模拟人工胃液以1:1(v/v)的比例加入离心管中,使用0.5 mol/L 的HCl 和NaOH 将混合物 的pH 调节至2.0。在37 ℃的恒温水浴摇床中孵育(150 r/min),模拟胃部消化;随后分别在1、2、6 h 时取样2 mL,将混合物pH 调至7.0,沸水浴5 min 终止反应。
肠道消化:将胃部消化的混合物和模拟人工肠液以10:3(v/v)的比例加入离心管中,使用0.5 mol/L的HCl 和NaCl 将混合物的pH 调节至7.0。在37 ℃的恒温水浴摇床中孵育(150 r/min),模拟肠部消化;分别在1、2、6 h 时取样2 mL,沸水浴5 min 终止反应。
对体外消化过程中不同阶段取得的样本的还原糖含量进行检测并计算牛蒡多糖在胃肠道内的水解度。采用苯酚硫酸法测定总糖含量,使用2,5-二硝基水杨酸测定还原糖含量。多糖水解度计算公式为:

公式中:Rt—样品溶液在各测试时间点的还原糖含量(mg/mL,t=1、2、6 h);Ro—样品溶液的初始还原糖含量(mg/mL);Ts—样品溶液中的总糖含量(mg/mL)。
1.2.8 细胞模型抗炎活性评价
1.2.8.1 RAW264.7 细胞培养 将巨噬细胞RAW 264.7 接种在含有10%FBS 胎牛血清、1%双抗(链霉素100 mg/mL、青霉素100 U/mL)和90% DMEM完全培养基的25 cm2培养瓶中,于恒温培养箱(37 ℃、5% CO2)中培养,24~36 h 后对细胞进行换液。当细胞生长到培养瓶的70%~80%时,对细胞进行传代培养。
1.2.8.2 RAW264.7 细胞活力测试 在96 孔板中加入8×104个/mL 的对数生长期的RAW264.7 细胞于培养箱中孵育24 h,设置实验组和正常对照组,于培养箱处理12 h,实验组即加入不同浓度的多糖溶液(以PBS 溶液配制200 mg/mL 的母液,用培养基稀释成50、100、250、500、1000 μg/mL)。随后每孔加入100 μL CCK-8(Cell Counting Kit-8 细胞计数试剂),培养箱内避光孵育2 h 后,于450 nm 测定吸光度(A),实验进行三次重复,细胞活力计算如下:
1.2.8.3 RAW264.7 细胞炎症模型的建立 收集对数生长期的RAW 264.7 细胞沉淀,并将细胞沉淀制成含8×104个/mL 的单细胞悬液,接种于96 孔细胞培养板。空白组加入100 μL DMEM 高糖培养基;对照组中每孔加入100 μL 细胞悬液和100 μL 完全培养基,在培养箱中孵育24 h 后,弃去培养基,用PBS洗两遍,再加入100 μL 完全培养基;实验组中每孔加入100 μL 细胞悬液和100 μL 完全培养基,在培养箱中孵育24 h 后,弃去培养基,加入100 μL 不同浓度的LPS 溶液(0.1、0.2、0.5、1、2 μg/mL)。最后各组均在培养箱中孵育24 h 后,收集细胞上清液测定NO 含量,以此来筛选LPS 浓度进行后续实验。
1.2.8.4 多糖对LPS 诱导的RAW264.7 细胞NO 含量的影响 在96 孔板中加入100 μL 8×104个/mL 对数期生长的RAW 264.7 细胞和100 μL 完全培养基,培养箱中孵育24 h 后去除培养基,然后加入不同浓度(50、100、250、500 μg/mL)的多糖溶液100 μL孵育12 h,再加入筛选后的LPS 溶液(LPS,1 μg/mL)100 μL 处理24 h,同时设置空白组(只加培养基)和对照组(不加样品干预处理)。培养结束后收集上清液,参照NO 试剂盒说明书推算各组细胞培养液中NO 的含量。
1.3 数据处理
实验采用Origin 9.1 和GraphPad Prism 8 软件作图,结果以平均值±标准差表示,重复三次,通过SPSS 软件进行t 检验分析。
2 结果与分析
2.1 紫外光谱分析
牛蒡粗多糖的紫外光谱图如图1 所示,在波长260、280 nm 下没有明显吸收峰,说明该牛蒡粗多糖组分中几乎不含核酸和蛋白质。
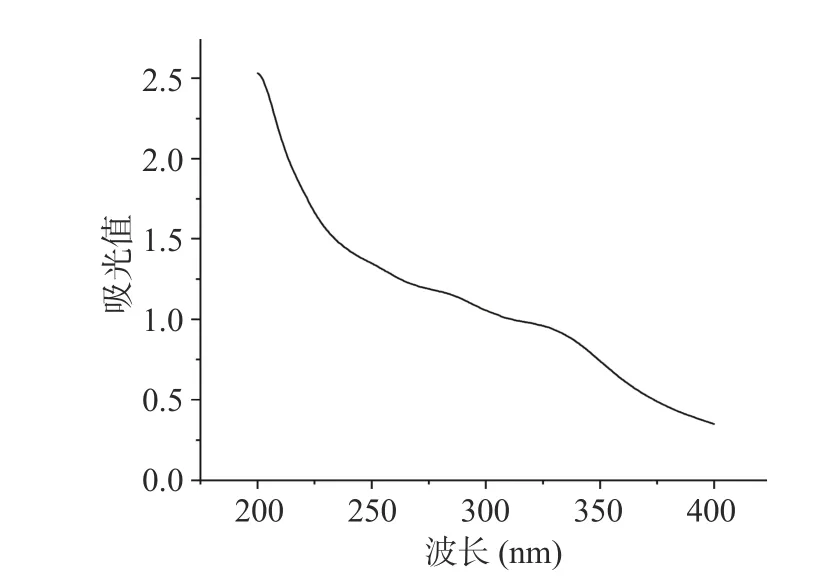
图1 牛蒡多糖的紫外光谱分析Fig.1 Ultraviolet spectrum analysis of burdock polysaccharide
2.2 分子量测定
采用高效液相色谱法对牛蒡多糖进行分子量测定(如图2),以标准品相对分子质量对数值为纵坐标,保留时间为横坐标,进行标准曲线的拟合,标准曲线为:Y=−3.145826e−005X3+0.007674452X2−0.6716573X+23.53052,R2=0.9900413。通过标准曲线计算多糖样品的分子量,结果显示其重均分子量为2902 Da,占比98.68%,通过分析图可以发现牛蒡多糖中杂质较少。
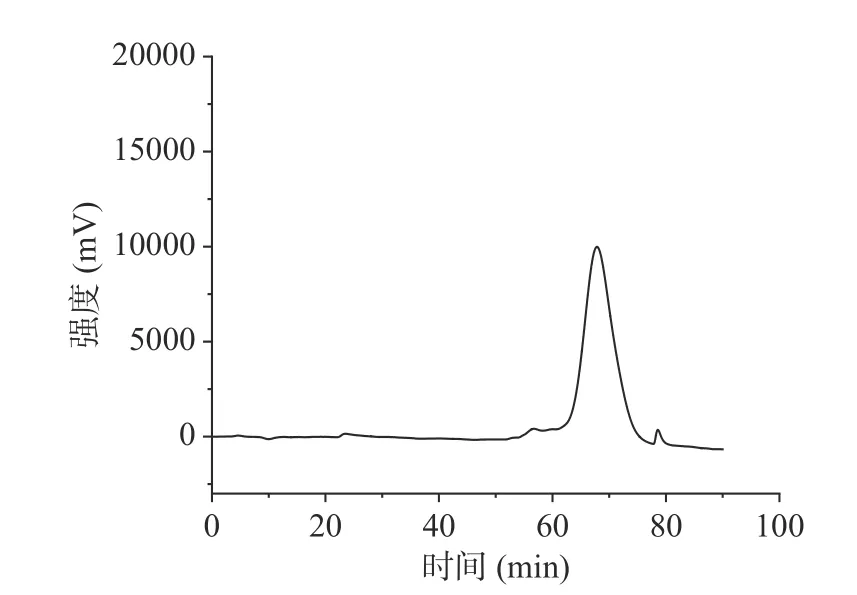
图2 牛蒡多糖的分子量测定图Fig.2 Diagram of molecular weight determination of burdock polysaccharide
2.3 红外光谱分析
图3 显示了牛蒡多糖的典型红外谱图:其中,3290 cm−1处的峰属于O-H 的伸缩振动,2930 cm−1处的吸收峰属于包括-CH、-CH2和-CH3基团在内的C-H 的伸缩振动,1630 cm−1和1420 cm−1的峰分别对应于对称的C=O 伸缩振动以及不对称的C=O 的伸缩振动和C-H 的弯曲振动[20]。C-O-H 和C-O-C 的伸缩振动引起从1200 cm−1到1000 cm−1处的吸收[21],1000~800 cm−1处的吸收带为呋喃糖残留物的特征峰,其中,933 cm−1处的吸收峰对应于呋喃糖环对称伸缩振动,819 cm−1处的吸收峰为糖分子中呋喃环的C-H 键的变角振动吸收,说明该牛蒡多糖为含有呋喃环的糖[22−24]。该研究结果与李丹丹[25]所制备的牛蒡菊糖红外光谱结果相一致,均为含有呋喃环的多糖。

图3 牛蒡多糖的红外光谱分析图Fig.3 Infrared spectrum analysis chart of burdock polysaccharide
2.4 单糖组成测定
从图4 中可以看出牛蒡粗多糖中果糖含量最高,且果糖:葡萄糖:阿拉伯糖:半乳糖=13.6:2.5:1.6:1,不含有糖醛酸,该结果与红外光谱中不含糖醛酸特征峰结果一致。此外,单糖结果显示果糖为牛蒡多糖中的主要单糖。Jiang 等[26]对牛蒡多糖进行分析发现,其单糖组成主要由甘露糖、葡萄糖、果糖和半乳糖组成,但三种纯化多糖组分(对应分子量分别为218、178 和60 kDa)之间单糖所占比例不同。图中保留时间为6 min 附近的峰在岩藻糖、鼠李糖、甘露糖、木糖、半乳糖醛酸以及葡萄糖醛酸6 种单糖标准品中均未有对应,有待进一步分析验证。
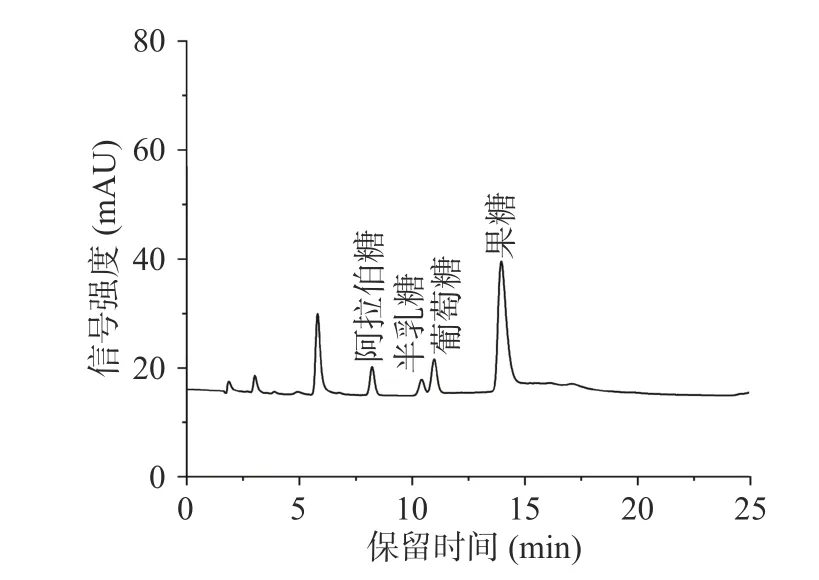
图4 牛蒡多糖的单糖组成Fig.4 The monosaccharide composition of burdock polysaccharide
2.5 物理稳定性评价
粒径是依据Stoke’s 定律评估体系稳定性的常用方法,体系中颗粒的平均粒径越大,体系越不稳定[27]。由图可知,不同的温度条件(30、40、50、60、70、80、90 ℃)对多糖的粒径及聚合物分散性指数(PDI)影响结果见图5,均在277~343 nm 及0.374~0.425 范围内。多糖在pH 为2 时,粒径极大,此时多糖溶液处于不稳定状态。当pH 为3~9 时,粒径范围在174~319 nm 之间,PDI 在0.353~0.473 之间,变化较小。多糖在NaCl 浓度为0~50 mmol/L 时,粒径变化不大;而当NaCl 浓度高于100 mmol/L 时粒径达到1200 nm 以上,PDI 值大于0.6,该结果可能是因为NaCl 的加入减弱了静电斥力,导致粒径增加[28]。
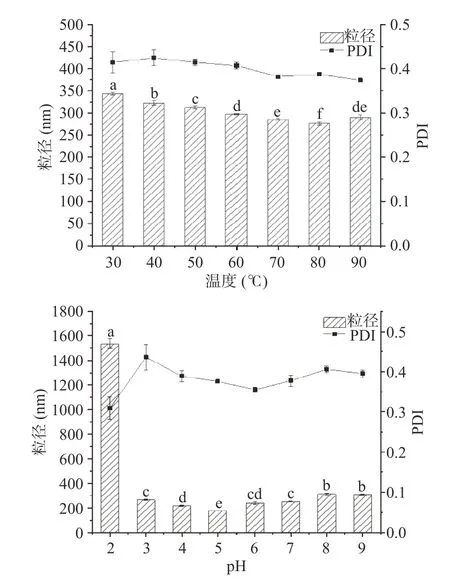

图5 牛蒡多糖物理稳定性评价Fig.5 Physical stability evaluation of burdock polysaccharide
2.6 体外消化
由图6 可知,牛蒡多糖经胃肠道消化后随着消化时间增加其水解度在逐步增加,其中,整个胃部消化(6 h)水解度为11.66%,还原糖含量增加,这可能与胃液的酸性环境使糖苷键断裂或共价键的破坏导致还原末端的形成有关[29−32]。肠道消化阶段多糖水解度继续增加可能与小肠液中含有胰腺和肝脏分泌的胰酶和胆汁酸以及糖苷酶将多糖水解成单糖有关,但肠消化较胃消化阶段水解度下降,肠消化水解度为9.12%,可能与肠液的稀释有关[33]。

图6 牛蒡多糖体外消化水解度变化Fig.6 Changes in the degree of digestion and hydrolysis of burdock polysaccharides in vitro
2.7 体外抗炎活性评价
2.7.1 细胞活力实验 由图7 可知,不同浓度(50、100、250、500、1000 μg/mL)的多糖作用于RAW264.7 细胞后,对照组和不同浓度的多糖组细胞存活率分别为:100%、100.22%、95.26%、89.41%、85.85%以及78.36%,与对照组相比不同浓度的多糖组对细胞存活率没有明显的抑制效果,表明牛蒡多糖对细胞几乎没有毒性。其中,多糖浓度为1000 μg/mL 时细胞存活率低于80%,不适合作为评价浓度,因此,选取50~500 μg/mL 无毒浓度作为后续实验的浓度梯度。

图7 不同浓度的多糖细胞活力Fig.7 Cell viability of different concentrations of polysaccharides
2.7.2 LPS 诱导RAW264.7 细胞炎症模型 LPS 浓度对NO 含量的影响如图8 所示,经过不同实验浓度(0.1、0.2、0.5、1、2 μg/mL)LPS 处理后,均导致了NO 含量增加,且在0.1~1 μg/mL 范围内NO 含量随LPS 诱导浓度的上升而增加,该结果表明在0.1~1 μg/mL 范围内LPS 浓度越高对细胞造成的炎症越明显。其中,LPS 浓度在0.1 和0.2 μg/mL 时,NO 含量与对照组无显著性差异(P>0.05);而当浓度高于0.5 μg/mL 时,模型组NO 的含量与对照组表现出显著性差异(P<0.05),在高浓度(1 μg/mL)时,实验组NO 的含量高于对照组88.72%,但当LPS 的浓度为2 μg/mL 时NO 的含量与1 μg/mL 时无显著性差异(P>0.05),因此选择LPS 终浓度为1 μg/mL 进行后续实验。
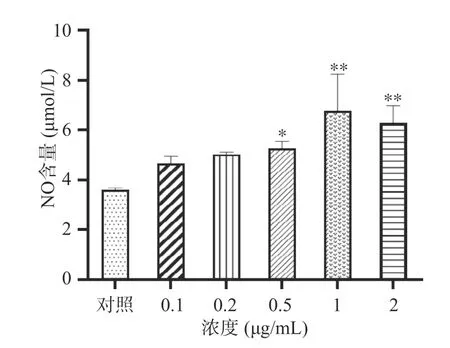
图8 LPS 诱导RAW264.7 细胞炎症模型Fig.8 LPS-induced inflammation model of RAW264.7 cells
2.7.3 多糖对LPS 诱导的RAW264.7 细胞NO 的影响 NO 含量的升高是RAW 264.7 细胞出现炎症反应的标志之一,因此研究不同浓度的多糖溶液对LPS 诱导的RAW 264.7 细胞上清液中NO 含量的影响,可以作为评价药物抗炎活性的指标。由图9 可知,与对照组相比,LPS(1 μg/mL)可以显著增加RAW 264.7 细胞中的NO 含量(P<0.0001),NO 含量从3.75 μmol/L 增加至12.70 μmol/L,而与模型组相比,不同浓度的多糖可以显著降低NO 的产生(P<0.05),使NO 的含量下降19.37%~48.66%,于250 μg/mL 时NO 的含量达到最低为6.52 μmol/L,效果明显,而500 μg/mL 时NO 的含量出现轻微上升,可能是由于化合物活性与剂量的作用关系一般是抛物线型,因此高浓度(500 μg/mL)的多糖溶液的抗炎作用减弱,以上结果均证明了牛蒡多糖的抗炎效果。
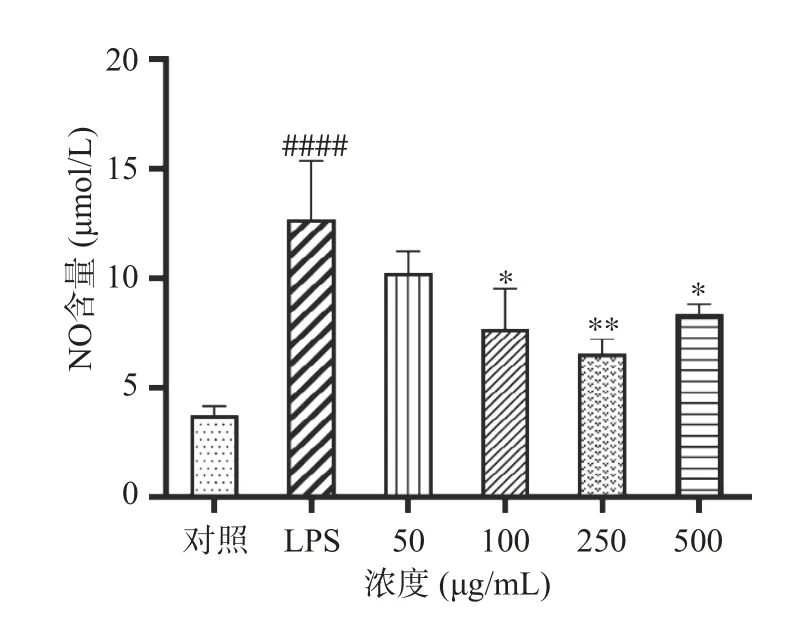
图9 多糖对LPS 诱导的RAW264.7 细胞NO 的影响Fig.9 The effect of polysaccharides on NO in RAW264.7 cells induced by LPS
3 结论
牛蒡多糖的总糖含量为83.07%,分子量为2902 Da,单糖组成为果糖:葡萄糖:阿拉伯糖:半乳糖=13.6:2.5:1.6:1,结合红外光谱分析牛蒡多糖为含有呋喃环的多糖。该多糖受温度及pH(3~9)影响较小,但高盐离子浓度会破坏其稳定性。消化过程中还原糖含量增加,经胃肠各消化6 h 后水解度为20.78%。由LPS 诱导RAW264.7 细胞炎症模型中可以看出牛蒡多糖可以显著降低NO 的水平(P<0.05),250 μg/mL 时NO 的含量达到最低为6.52 μmol/L,较模型组下降48.66%。综上所述,本研究基于体内外两种模型同时证明了牛蒡多糖的抗炎效果,为天然抗炎产品的开发提供理论依据,有利于牛蒡资源的进一步开发和利用。
