超声和碳酸氢钠处理对绿豆浸泡特性的影响
2022-08-06李丹丹张荣广韩永斌
刘 阳,李丹丹, ,陶 阳,张荣广,韩永斌,
(1.南京农业大学食品科技学院全谷物食品工程研究中心,江苏南京 210095;2.南京粮食集团,江苏南京 210095)
绿豆(Vigna radiata(Linn.) Wilczek.)是全球最重要的豆类作物之一,因其耐旱性好、种植成本低和生长周期短的特点,全球的种植面积超过600 万公顷,占全球豆类种植面积的8.5%[1]。绿豆具有均衡的营养成分,含有碳水化合物、蛋白质、膳食纤维、矿物质、维生素和众多生物活性物质。绿豆中的必需氨基酸——赖氨酸含量高,而大米缺乏赖氨酸,绿豆、大米搭配食用营养丰富,也是家庭烹饪中的常见做法,如大米绿豆粥、绿豆米饭。但是,绿豆等杂粮种皮渗透性低、质地坚硬的特点导致其蒸煮时间长,难以与大米同煮同熟。浸泡可以改变豆类的质地,缩短蒸煮时间。然而,传统浸泡法存在耗时长、吸水速率慢等缺陷。
超声是一种绿色的食品加工技术,可产生机械效应、空化效应以及热效应[2],从而加快鹰嘴豆[3]、普通豆[4]、藏青色豆[5]等豆类的水合过程。碳酸氢钠俗称小苏打,是家庭烹饪中常用的膨松剂,在碳酸氢钠溶液中浸泡杂粮,可有效减少杂粮豆的烹饪时间[6]。因此,理论上,超声和碳酸氢钠辅助浸泡均可改变传统浸泡烹饪绿豆耗时耗力的状况,提高绿豆的浸泡、烹饪加工效率。然而,目前关于超声和碳酸氢钠处理对绿豆浸泡过程中吸水特性以及营养成分变化规律的研究还较少,其作用机制也有待进一步研究。因此,本文以提高绿豆浸泡效率为目的,以超声和碳酸氢钠处理为对照,首先从吸水动力学和水分分布角度研究超声和碳酸氢钠对绿豆吸水特性的影响;然后,通过质构和表皮结构探究超声和碳酸氢钠影响绿豆浸泡特性的原因;最后,分析浸泡过程中绿豆营养成分总酚和抗营养因子植酸含量的变化,研究结果可为绿豆的浸泡加工提供一定的理论指导。
1 材料与方法
1.1 材料与仪器
绿豆(品种:明光,2020 年秋季收获,含水量:10.00%) 南京粮食集团;碳酸氢钠 分析纯,广东光华科技股份有限公司;福林酚试剂 上海瑞永生物科技股份有限公司;硫酸铁铵、2,2-联吡啶 分析纯,国药集团化学试剂有限公司;植酸钠 分析纯,上海源叶生物科技有限公司;巯基乙酸溶液 国药集团化学试剂有限公司;其他常规试剂均为国产分析纯。
HH-4 数显恒温水浴锅 中国国华电气有限公司;JA1003 电子天平 中国上海浦春计量仪器有限公司;NMI20-040H-I 低场核磁共振成像仪 苏州纽迈分析仪器股份有限公司;ZX-01 扫描电子显微镜德国蔡司股份公司;XOWX-100 冷冻干燥机 南京先欧仪器制造有限公司;THC-1000SF 超声清洗机济宁天华超声电子仪器有限公司;UV-5100B 型紫外可见分光光度计 上海元析仪器有限公司;DSHZ-300A 台式水浴恒温振荡器 太仓市强乐实验设备有限公司。
1.2 实验方法
1.2.1 样品处理 挑选大小均一、颗粒饱满的绿豆,称量三份5.0 g 绿豆分别在400、600 W 超声条件下或1.5%、3.0%(m/v)的碳酸氢钠溶液中浸泡480 min,浸泡料液比1:10 g/mL,浸泡温度30 ℃,其中,超声处理不控温,60 min 间歇处理,超声期间用热电偶温度记录仪测定水浴温度,非超声期间更换超声清洗机中的水,在30、60、90、120、180、240、300、360、420、480 min 取样,沥干表面水分后称重,分析绿豆在浸泡过程中的吸水动力学。总酚和植酸测定中的绿豆在0、240 和480 min 取样,然后冷冻干燥后磨粉,过60 目筛处理,−20 ℃冰箱存样。
1.2.2 水分含量测定 水分含量测定参照国标GB 5009.3-2016《食品安全国家标准 食品中水分的测定》。
1.2.3 Sigmoid 模型拟合吸水过程 Sigmoid 模型是Kaptso 等[7]于2008 年提出的谷物种子吸水模型,如公式1 所示:

其中:Mt 是t 时间绿豆的含水量,%;,M ∞是绿豆的饱和含水量,%;k 表示种子的水合速率,min−1;τ 表示滞后时间,min;绿豆的初始含水量为10.00%±0.30%。
1.2.4 低场核磁共振水分分布测定 将3 颗大小均一、颗粒饱满的绿豆在15 mL 水中浸泡0、120、240、480 min 后擦干表面水分,保鲜膜包裹待测样并放入核磁管磁体线圈的中心位置。在测定之前将油样放进核磁管,FID 序列校准中心频率和射频频率。利用CPMG 序列测定样品横向自旋弛豫时间T2,每颗绿豆重复测三次。CPMG 序列参数:主频SF=40 MHz,偏移频率O1=662001.40 Hz,采样频率SW=200 kHz,重复采样等待时间TW=3000 ms,重复采样次数NS=8,回波个数NECH=5000,反演时的迭代次数为1000000。
1.2.5 核磁共振成像 核磁共振成像采用自旋回波SE 脉冲序列。成像参数为:重复采样时间TR=300 ms,扫描次数NS=2,回波时间TE=20 ms,切片厚度ST=3.15 mm。
1.2.6 硬度测定 利用质构仪P-2N 型探头测定不同浸泡时间下绿豆的硬度。参数设定为:力量感应元量程50 N,触发力0.2 N,检测速度和回程速度为60 mm/min,穿刺距离3 mm。
1.2.7 扫描电镜观察 经清水、1.5%碳酸氢钠溶液、400 W 超声浸泡3 h 的绿豆,真空冷冻干燥24 h,单颗绿豆经离子溅射仪喷金后,在10 kV 的加速电压、700×放大倍数下观察种皮的表面结构。
1.2.8 总酚的提取与测定 总酚的提取参照魏美霞等[8]的方法。准确称量1.0 g 绿豆粉至50 mL 离心管中,按1:30 g/mL 料液比加入70%的乙醇,120 r/min的转速在35 ℃的水浴恒温振荡箱中提取1 h,4618 ×g 离心10 min,取上清液,沉淀物重复上述操作,合并两次上清液。
总酚的测定采用福林酚法[9]。吸取200 μL 提取液至5 mL 塑料管中,分别加入1.5 mL 福林酚试剂和7.5%的Na2CO3溶液1.5 mL,振摇5 min 后室温避光静置2 h,紫外分光光度计于765 nm 处测定样液的吸光度。系列浓度梯度没食子酸的吸光度以相同的步骤操作,标准曲线方程为y=0.0052x+0.0196(y 代表吸光度值,x 为没食子酸浓度),拟合度R²=0.9983。
1.2.9 植酸的提取与测定 参考郭嘉[10]的方法并略作修改。称取0.5 g 绿豆粉于50 mL 离心管中,加入50 mL 0.2 mol/L 盐酸溶液,25 ℃水浴恒温振荡箱提取3 h,4618 g 离心10 min。取提取液0.5 mL于10 mL 离心管中,加入2 mL 硫酸铁铵溶液,沸水浴反应30 min,自来水冷却5 min,再次离心5 min,取上清液1 mL,加入1 mL 的双吡啶溶液,在519 nm处测定吸光度。按照此方法绘制的标准曲线方程为y=−15.183x+0.4042(y 代表吸光度值,x 代表铁离子浓度),拟合度R2=0.9970。
1.3 数据处理
每组实验三次重复,结果以平均值±标准差的形式表示。使用SPSS 26.0 显著性分析,利用Origin 2021b 软件绘图,Matlab 软件进行线性拟合。
2 结果与分析
2.1 吸水动力学
2.1.1 Sigmoid 模型拟合绿豆吸水过程 从图1 可知对照组、碳酸氢钠组和超声组的绿豆吸水曲线都呈现出“S”型曲线的变化趋势,即:慢 —快 —慢的变化规律。这是因为在浸泡的过程中绿豆处于发芽前的萌发阶段,伴随着酶活性、种皮渗透性和绿豆体积的变化。在0~2 h 浸泡初期,绿豆种皮的低渗透性导致其吸水通道主要存在于种脐,绿豆体积未充分膨胀,吸水速率较慢,水分含量从0 h 的10.00%增加到2 h 的20.22%~49.22%;2~6 h 浸泡中期为快速吸水阶段,一方面绿豆中主要营养物质碳水化合物和蛋白质的亲水性导致其体积膨胀、表面积增加,另一方面绿豆种皮和核心的水分含量差异大,由水分梯度提供动力加速了绿豆的吸水,水分含量大约增加到76.70%~122.22%;到6~8 h 的浸泡后期,绿豆内外的水分梯度值降低、可溶性固形物和色素发生损失,这些因素均导致吸水速率下降,从而绿豆缓慢吸水最终到达饱和状态,饱和含水量大约在91.90%~132.34%。因此,整体上绿豆的吸水曲线呈“S”型。Miano 等[11]研究水合安第斯羽扇豆也发现了类似的吸水曲线。
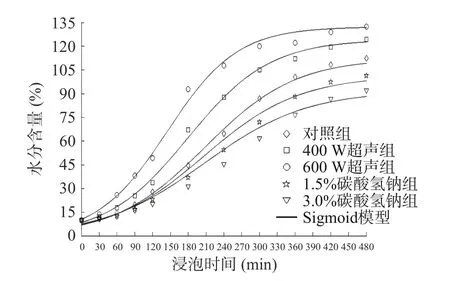
图1 不同处理方式对绿豆浸泡过程中水分含量的影响Fig.1 The effect of different treatment methods on the moisture content of mung bean during soaking
2.1.2 吸水速率k 和延滞时间τ 的变化 将绿豆水分含量随时间变化的数据代入Sigmoid 模型中得到参数吸水速率k、延滞时间τ 以及模型评价指标拟合度R2和均方根误差RMSE 的值。由表1 可知,Sigmoid 模型R2在0.9758~0.9974 之间,RMSE 在2.213%~5.245%之间。R2越接近1,RMSE 越小说明模型的拟合效果越好。因此,Sigmoid 模型可有效拟合超声和碳酸氢钠辅助绿豆吸水的过程。

表1 不同处理方式Sigmoid 模型评价Table 1 Sigmoid model evaluation of different treatment methods
随着超声功率的增大,吸水速率k 从0.0131 min−1增加到0.0169 min−1,延滞时间τ 从214.0 min 降低到153.7 min,饱和含水量M∞从112.3%增加到132.3%。与对照组和碳酸氢钠组相比,超声处理组绿豆的吸水速率k 值更大,“S”型吸水曲线也在其上方(图1)。超声可通过直接效应和间接效应来增强绿豆在浸泡过程中的传质[12]:一方面导致绿豆浸泡液的交替压缩和膨胀,使得水分泵入绿豆的表皮孔隙(直接效应)[13];另一方面超声的机械、空化和热效应会破坏绿豆的组织结构,使绿豆表皮和子叶形成更多的微孔通道,从而提高吸水速率(间接效应)。其中,超声温度的变化可以间接体现出热效应对绿豆的作用,图2 表明在60 min 超声间隔处理绿豆的过程中,超声的水浴温度随超声功率和超声时间的变化,400 W 超声处理60 min 的超声温度上升至40 ℃,600 W 超声处理温度上升至46 ℃。Ulloa 等[14]利用超声水合干豆发现,超声可使水分扩散速率提高45 倍,到达平衡含水量的时间缩短17.6%~58.8%。

图2 不同超声功率下绿豆浸泡液温度的变化Fig.2 The change of mung bean soaking liquid temperature under different ultrasonic power
随着碳酸氢钠浓度的增加,吸水速率k 从0.0131 min−1降低到0.0116 min−1,同时延滞时间τ从214.0 min 增加到228.6 min,饱和含水量M∞从112.3%降低到91.9%。与对照组相比,碳酸氢钠组“S”型吸水曲线在其下方。碳酸氢钠可通过改变浸泡水的酸碱度影响水合速率,碱性的浸泡水可以改变种皮和子叶的组成,并改变细胞扩散机制。通过测定发现,碳酸氢钠浓度分别为1.5%和3.0%时,pH 约为8.20 与8.32。此外,碳酸氢钠颗粒还可能会吸附在种皮表面,阻碍水分的扩散,从而使吸水变慢。Oladele 等[15]将一种巴西豆浸泡在不同pH 的盐溶液中,发现巴西豆的平衡含水量和吸水速率随着pH(6~12)的增加而上升。这与本文研究结果不一致,可能是由于不同来源豆子的结构存在差异,从而在不同酸碱度的盐溶液中吸水速率变化不同。
为了节约绿豆产品的生产时间、缩短其生产周期,需要将吸水速率高、延滞时间短的浸泡条件作为优先级。虽然超声功率的增加会大幅提高吸水速率、缩短延滞时间,但是在实验过程中发现600 W 超声条件增加了绿豆破损率。碳酸氢钠的加入会抑制水分吸收,并且3.0%的浓度将导致绿豆种皮变褐。因此,后续实验将研究对照浸泡、1.5%碳酸氢钠和400 W 超声辅助浸泡对绿豆表皮结构、质构和营养特性等的影响。
2.2 水分分布、不同状态水分含量变化以及核磁成像
2.2.1 水分分布以及不同状态水分含量变化 为明确绿豆在浸泡过程中质子团的迁移与变化,超声和碳酸氢钠辅助浸泡绿豆的弛豫时间曲线如图3 所示。由图可知,绿豆中存在两种主要的质子团T21和T22。T21为结合水,弛豫时间在0.01~10 ms 之间,它是与淀粉、非淀粉聚合物、蛋白质结合的质子;而T22为自由水,其弛豫时间在10~1000 ms 之间,指可移动的CH−质子和大量水的OH−[16]。

图3 不同处理方式的T2 水分弛豫时间分布Fig.3 T2 distribution of moisture relaxation time in different treatments
在0 h 时,T21占总信号量的99%,而T22占总信号量的1%。在浸泡过程中,绿豆内部发生着由水参与的复杂的生化反应。对照组、碳酸氢钠组和超声组的T2弛豫时间发生右移,由表2 可知自由水、结合水的弛豫时间在不同时间点存在一定差异。可能是种子内部各组分与水分发生着质子交换,交换过程中各营养物质的官能团与质子结合不稳定,因而随着浸泡时间的延长,不同状态水分的弛豫时间增加,各组分与水分结合的稳定性下降。
T2水分弛豫曲线中T21与T22的峰面积可以代表其水分含量,A 为总水分含量,A21为结合水含量,A22为自由水含量,则A=A21+A22。由表2 可知,三组处理A21含量随着浸泡时间的延长缓慢上升,同时A22上升的幅度更为显著(P<0.05)。对照组在0~8 h的浸泡过程中,A21从8.47 增加到14.13,A22从0.33增加到38.50,A 从8.81 增加到52.63;碳酸氢钠组A21从8.62 增加到12.93,A22从0.33 增加到34.53,A从8.95 增加到47.45;而超声组A21从8.82 增加到16.92,A22从0.32 增加到57.83,A 从9.13 增加到74.75。这说明浸泡过程中总水分含量A 的增加主要在于自由水含量的升高,与前人研究结果一致[17]。同时超声组8 h 的总水分含量分别是对照组和碳酸氢钠处理组的1.42 和1.58 倍,与图3 结果一致。

表2 不同组弛豫时间以及单位质量峰面积对比统计表Table 2 Comparison statistics table of relaxation time and unit mass peak area of different groups
在浸泡过程中绿豆种子处于发芽前的萌发阶段。该阶段可分为两个过程:吸胀和萌动。吸胀时种子内部亲水性的碳水化合物和蛋白质吸收大量水分,导致水合加速,绿豆体积膨胀,此时绿豆中自由水较多。在萌动阶段,种子内部生理代谢活动旺盛,而自由水又是大多数生化活动的介质,伴随着酶的合成以及营养物质的分解、转化与合成,结合水的含量也在缓慢上升[18]。碳酸氢钠通过改变浸泡液的pH 对此过程产生影响,超声则促进绿豆种皮的破裂和子叶的溶胀,通过改变绿豆种子结构影响结合水和自由水含量。因此,不同组的A21、A22和A 存在一定的差异。
2.2.2 核磁成像分析 低场核磁成像可通过绿豆的质子密度梯度来反映浸泡过程中水分随时间和空间的变化(图4)。绿色代表低质子密度区,而红色代表高质子密度区。在0~2 h 浸泡初期,三个处理组的含水量总体较低,约在22.86%~33.71%之间(图1),且水分主要集中于种皮,内部含水量较低;但与对照组、1.5%碳酸氢钠组相比,400 W 超声处理加速了种皮的破裂和水分的吸收,从而红色区域面积更大、绿豆体积也更大。随着浸泡时间增加到4 h,绿豆中主要营养物质碳水化合物和蛋白质的快速吸水,绿豆体积膨胀,并且由于种皮与子叶之间水分梯度的存在,使得水分开始由种皮向内部流动,高质子密度的红色区域逐渐向绿豆中心区域扩散;其中,400 W 超声处理后的绿豆核心已基本完全呈红色,说明水分已进入绿豆的中心,而另外两组的中心区域依然有部分绿色,说明此时绿豆中心区域依然保持较为干燥的状态。当浸泡时间为6 h 时,绿豆的吸水动力学曲线基本达到饱和状态,即绿豆吸水量近乎最大值,因而三个处理组绿豆的体积均进一步膨胀,红色进一步加深[19]。

图4 不同处理方式的绿豆核磁成像分析Fig.4 NMR imaging analysis of mung bean with different treatment methods
2.3 硬度变化
硬度是表征绿豆浸泡程度的重要指标。从图5可以看出,随着浸泡时间的延长,绿豆的硬度在逐步下降。绿豆中的主要营养物质是淀粉和蛋白质,子叶是保持绿豆硬度的主要结构。浸泡过程中子叶中的淀粉会吸水溶胀、蛋白质的结构也会发生变化,从而破坏了绿豆原本坚硬的结构。与对照组相比,在浸泡过程中400 W 超声不仅可以使种皮形成微孔通道促进吸水,同时热效应也破坏了子叶的内部结构,在4 h即达到了最低硬度值;而对照组浸泡时间在4~6 h时,绿豆的硬度值迅速降低,在7 h 时硬度值最低(1.41 N)。虽然图1 和表1 结果表明碳酸氢钠会抑制绿豆在浸泡过程中吸水,但值得注意的是,1.5%碳酸氢钠处理组绿豆的硬度值下降速率却比对照组稍快。一方面,由图1 可知,1.5%碳酸氢钠对绿豆的吸水动力学影响较小;另一方面,有研究表明果胶溶解为大豆软化过程的限速步骤之一,而碳酸氢钠中的钠离子可能在烹饪过程中置换出交联果胶的二价矿物质,提高可溶性果胶的含量,从而降低硬度[20],碳酸氢钠的这一效应可能在绿豆的烹饪过程中更为明显,而在浸泡过程中影响不大。从而,与对照组相比,1.5%碳酸氢钠处理组绿豆的硬度值下降速率略有增加。若以最低硬度为评价指标,则对照组和1.5%碳酸氢钠组的最佳浸泡时间为7 h,而400 W 超声组最佳浸泡时间为4 h。

图5 不同处理方式对绿豆硬度的影响Fig.5 The effect of different treatment methods on the hardness of mung bean
2.4 表皮结构变化
绿豆表皮结构的完整性是决定其吸水动力学的关键因素。本实验通过扫描电镜观测不同浸泡处理后绿豆的表观形貌,如图6 所示。未处理组(图6A)与对照组(图6B)绿豆种皮表面完整无损,说明在3 h的浸泡过程中,水分含量的升高对其种皮的表面结构无影响。从图6C 发现,有许多细小颗粒吸附在绿豆种皮表面,与对照组相比,可判定这些颗粒是碳酸氢钠。碳酸氢钠颗粒的吸附将阻碍水分通过种皮屏障,从而降低了吸水速率。从图6D 发现,经过400 W超声3 h 处理的绿豆,种皮表面形成了微孔通道,这可能是由于超声的空化作用、机械效应和热效应的共同作用导致的。绿豆浸泡液在超声作用下,首先会产生小的空化气泡,这些气泡生长到一定程度会破裂,同时伴随着瞬时的高温高压,正是由于超声的作用,气泡不断经过产生-生长-破裂的循环,使得绿豆种皮表面产生了微孔通道,提高了水合速率。此外,通过监控超声过程中浸泡液温度的变化发现,超声也会导致浸泡液温度的增加(图2)。李鹏[19]将黑豆分别在50 ℃热超声和50 ℃恒温处理发现,与50 ℃恒温处理相比,50 ℃热超声的黑豆种皮表面的微孔通道更多,则本实验的微孔通道是超声的各种效应共同作用的结果。

图6 不同处理方式对绿豆种皮的影响Fig.6 The effect of different treatment methods on the seed coat of mung bean
2.5 总酚含量变化
浸泡可改善绿豆的加工特性,然而长时间浸泡可能导致水溶性营养素的损耗。图7 反映了不同浸泡条件下总酚的含量变化。在8 h 的浸泡过程中,对照组、1.5%碳酸氢钠组和400 W 超声组的总酚含量是逐步下降的,且不同浸泡时间下总酚含量具有显著性差异(P<0.05)。原始绿豆中总酚含量为2.7 mg/g,经浸泡4 和8 h 后,对照组绿豆的总酚含量降低24.1%与35.9%,1.5%碳酸氢钠组降低27.7%与49.5%,400 W 超声组降低44.7%与60.1%。浸泡导致总酚含量降低的原因有三:a.水溶性多酚直接浸提到绿豆浸泡液中;b.浸泡过程中多酚与碳水化合物或蛋白质等其他有机物质的结合;c.浸泡激活多酚氧化酶的活性,从而降解多酚[21]。但是,刘婷婷等[22]研究了浸泡和发芽对六种杂豆中酚类物质的影响,结果表明绿豆总酚在浸泡过程中增加了23.2%,与本研究结果相反,原因是本实验中绿豆的浸泡时间只有8 h,而上述实验绿豆浸泡18 h,绿豆萌芽提高总酚含量。超声可以显著提高酚类物质的提取效率,因为其机械和空化效应可以破坏细胞壁、释放出细胞内容物、增加固形物损失[23],同时热效应也可以直接降解多酚,从而在绿豆浸泡过程中,总酚含量降低更多。另外,有研究表明豆类种皮的颜色主要是叶绿素以及多酚类(类黄酮)引起的[24]。实验过程中发现碳酸氢钠处理组浸泡液的颜色在8 h 变成了浅绿色,说明碳酸氢钠可能导致种皮中色素、酚类物质的流失,而对照组绿豆浸泡液的颜色变化不明显。
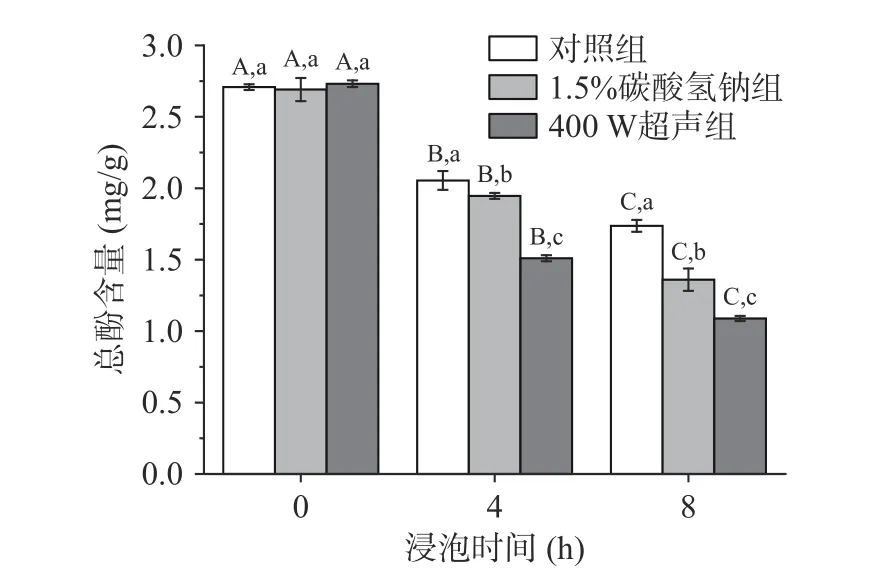
图7 不同处理方式对绿豆总酚含量的影响Fig.7 The effect of different treatment methods on the total phenol content of mung bean
2.6 植酸含量变化
植酸是谷物、豆类中的抗营养因子,可以螯合多种矿物质,降低生物利用率。脱皮、浸泡、发芽、发酵、高压灭菌、微波蒸煮等方法都可以降低谷物中抗营养因子的含量[25]。从图8 可看出,绿豆中植酸含量约3.0 mg/g,植酸在浸泡过程中含量显著降低(P<0.05)。与原始豆相比,在浸泡4、8 h 后,对照组的植酸含量分别降低20.5%与43.4%,1.5%碳酸氢钠组分别减少12.4%与32.2%,400 W 超声组分别下降44.1%与66.1%。由此可知,与对照组相比,1.5%碳酸氢钠组抑制了植酸的降低,超声组促进了植酸的降低,且不同处理组之间植酸含量存在显著性差异(P<0.05)。浸泡过程中植酸含量降低主要与植酸酶活性、热效应以及绿豆的水分含量有关。碳酸氢钠处理抑制植酸降低是因为浸泡介质的pH 对植酸酶的活性有显著影响。碳酸氢钠溶液呈碱性,而研究表明大多数植物中的植酸酶为酸性植酸酶,其最适pH 在4.5~5.6 之间,当pH>7.5 时,植酸酶稳定性急剧下降[26],水解植酸的能力下降,从而植酸降低速率变缓。仲磊等[27]将大豆浸泡在不同浓度的碳酸氢钠溶液中,发现高浓度碳酸氢钠会抑制植酸降低。超声使植酸含量下降更快的原因可能是超声产生的热效应是激活植酸酶的最佳温度区间(25~80 ℃)[28],在一定的浸泡温度下,内源植酸酶被激活,因此水解大量植酸。Lestienne 等[29]研究发现在浸泡谷物和豆类的过程中,植酸含量的降低主要是植酸酶的作用。

图8 不同处理方式对绿豆植酸含量的影响Fig.8 The effect of different treatment methods on the phytic acid content of mung bean
3 结论
本文研究了超声和碳酸氢钠对绿豆浸泡特性的影响。吸水动力学结果表明超声可有效提高绿豆的吸水速率,碳酸氢钠会抑制绿豆的吸水速率;且Sigmoid 模型可有效拟合绿豆的吸水过程(R2=0.9758~0.9974)。低场核磁结果表明绿豆在浸泡过程中结合水自由水含量均上升;且与碳酸氢钠组、对照组相比,超声组自由水上升更快。核磁成像结果说明绿豆浸泡过程中水分由表皮向内逐步扩散,同时伴随体积的增大。质构结果表明绿豆的硬度在浸泡过程中逐渐降低,400 W 超声组对硬度的降低较1.5%碳酸氢钠组更为明显,若以最低硬度为评价指标,则对照组和1.5%碳酸氢钠组的最佳浸泡时间为7 h,而400 W超声组最佳浸泡时间为4 h。扫描电镜则证实超声和碳酸氢钠处理对绿豆吸水速率及质构的影响与其表皮结构的变化有关:400 W 超声可使绿豆表皮形成微孔通道,促进吸水;而1.5%碳酸氢钠可吸附在种皮表面,抑制吸水。总酚和植酸测定结果表明在浸泡过程中这两种成分逐渐损失,总酚降低程度为:400 W 超声组>1.5%碳酸氢钠组>对照组,植酸降低程度为:400 W 超声组>对照组>1.5%碳酸氢钠组。本文的研究结果证实了超声技术对绿豆浸泡特性的改善作用,可为其在绿豆产品开发领域的应用提供理论指导。
