传统发酵与接种发酵酸肉安全品质特性的分析
2022-08-06李廷任赵金山臧金红彭传涛赵佳怡
李廷任,赵金山 ,臧金红, ,彭传涛,张 鹏,赵佳怡
(1.青岛农业大学食品科学与工程学院,山东青岛 266109;2.青岛特种食品研究院,山东青岛 266109;3.青岛农业大学动物科技学院,山东青岛 266109)
发酵是食品工业中最普遍的保藏方法之一,在发酵过程中主要利用有益微生物的作用以及过程中发生的物理、化学变化来赋予食品独特的品质,并能够延长食品保质期。发酵肉制品是其中一类重要的发酵食品,其营养丰富、风味浓郁,深受消费者喜爱[1]。目前,国外发酵肉制品主要有西班牙火腿、土耳其Sucuks 香肠和意大利萨米拉香肠等;国内发酵肉制品主要有金华火腿、四川腊肉以及酸肉等。由于地域、原料以及加工工艺的差异,不同发酵肉制品各具品质特色。
酸肉是我国西南地区普遍存在的发酵肉制品,距今已有两千多年的食用历史,其主要以新鲜猪肉为原料,加入大米、糯米、玉米粉、辣椒、盐和糖等调味品,利用肉表面以及发酵环境中存在的天然菌种进行厌氧发酵,利用微生物和内源酶产生的风味以及调味品的香气融合赋予酸肉独特风味[2]。目前,大多数传统酸肉依然是根据家庭传统和当地的地理条件小规模自然发酵生产,由于季节性限制以及发酵条件难以控制等问题,导致酸肉品质差异明显,质量不稳定,存在一定的安全隐患。目前,国内外对于酸肉的研究主要集中在微生物多样性、风味物质、生物活性等方面。Zhang 等[3]对传统发酵酸肉的微生物群落与风味进行研究,发现癸酸乙酯、丁酸乙酯等酯类物质含量在酸肉发酵过程中快速增加,Lactobacillus、Weissella、Staphylococcus等是酸肉发酵过程中的核心微生物,风味物质的变化与核心微生物有关。酸性蛋白酶能够降低真菌丰度,增加酸肉中游离氨基酸和部分挥发性风味物质含量[4]。另外,适宜的发酵温度(20、25 ℃)也可以增加挥发性化合物的数量和含量,并提高酸肉的可接受度[2]。
在安全性方面,国际癌症研究机构(IARC)在2016 年将加工肉制品列为“Ⅰ类”致癌物,发酵肉制品的安全性也成为限制产业发展的重要因素[5]。目前,对于发酵肉制品安全性研究主要集中在培根[6]、火腿[7]、香肠[8]等产品中,而对酸肉的安全性研究还鲜有报道。但研究发现,通过接种Lactobacillus curvatusLAB26 和Pediococcus pentosaceusSWU73571可以降低酸肉中的大肠菌群数、亚硝酸盐、生物胺、总挥发性碱性氮和丙二醛的含量[9],可以看出微生物接种发酵是提高产品安全性、稳定产品品质的有效手段[1]。采用优良发酵剂进行发酵,是保证发酵酸肉安全性和品质的关键。本实验前期以安全特性、发酵特性、营养特性为指标从传统酸鱼样品中筛选出了多种优良菌株,发现木糖葡萄球菌135(Staphylococcus xylosae135,Sx-135)、植物乳杆菌120(Lactobacillus plantarum120,Lp-120)和酿酒酵母2018(Saccharomyces cereviscerae2018,Sc-2018)三种菌株能有效缩短发酵周期,提高酸鱼安全性[10],可作为发酵肉制品的潜在发酵剂。但其在发酵酸肉中的应用以及对于酸肉安全性的影响尚不明确。因此,本研究选择三种发酵剂单一接种和混合接种两种方式发酵酸肉,通过高效液相色谱法、分光光度计法、滴定法对酸肉生物胺、亚硝酸盐、过氧化值进行测定,以及选择不同的培养基对有害微生物进行计数,并辅以理化指标的检测,将接种发酵酸肉与不同地区传统发酵酸肉进行安全性对比分析,以期为改善传统酸肉品质,提高酸肉安全性提供参考。
1 材料与方法
1.1 材料与仪器
新鲜五花肉、白砂糖、食用盐、五香粉、玉米粉购买于大润发超市,均为食品级;发酵菌株:木糖葡萄球菌135(Sx-135)、植物乳杆菌120(Lp-120)和酿酒酵母2018(Sc-2018) 江南大学食品学院保藏;传统发酵酸肉:贵州苗家老坛酸肉、湖南湘西包谷酸肉、贵州榕江酸肉、贵州黎平酸肉 均购于当地农户且均在保质期内检测。详细信息见表1。
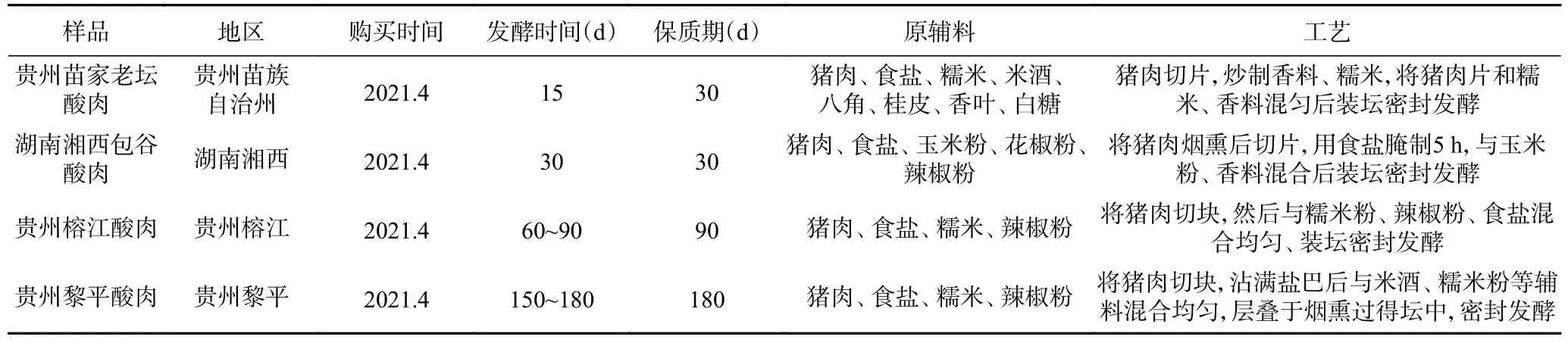
表1 四种传统发酵酸肉基本信息Table 1 Basic information of four traditional fermented sour meats
甘露醇氯化钠琼脂培养基(MSA)、酵母浸出粉葡萄糖琼脂培养基(YPD)、乳酸菌琼脂培养基(MRS)、平板计数琼脂培养基(PCA)、结晶紫中性红胆盐琼脂(VRBA)、假单胞CFC 选择性培养基、单核细胞增生李斯特氏菌显色培养基、沙门氏菌显色培养基、Baird-Parker 平板培养基、TCBS 平板培养基 青岛海博生物技术有限公司;色胺(Try)、腐胺(Put)、尸胺(Cad)、组胺(His)、酪胺(Tyr)、亚精胺(Spd)、精胺(Spm)标准品 Sigma 试剂有限公司。
TU-1810 型可见分光光度计 普析公司;Agilent 1100 型高效液相色谱仪 安捷伦公司;Centrifuge 5810R 型冷冻离心机 Eppendorf 公司;CLC111ECO型恒温培养箱 MMM Medcenter Einrichtungen GmbH 公司。
1.2 实验方法
1.2.1 发酵菌种活化 参考曾雪峰[11]的方法。将植物乳杆菌120(Lp-120)接种到MRS 液体培养基中,30 ℃培养24 h;酿酒酵母2018(Sc-2018)接种到YPD 液体培养基中,30 ℃培养24 h、木糖葡萄球菌135(Sx-135)接种到MSA 液体培养基中,25 ℃培养72 h。活化两次后将培养液冷冻离心(10000 r/min、15 min),所得菌体用生理盐水洗涤、离心,最后悬浮于生理盐水中。将Lp-120、Sc-2018 和Sx-135 微生物的活菌数分别控制在109、109、107cfu/mL。
1.2.2 酸肉的制备 参照李文杰等[4]的酸肉制备方法。将从超市购买的五花肉放入贮冰保温盒中,20 min 内带回实验室,立即用冰水将五花肉清洗干净,吸干表面水分,切成约3 cm×3 cm×5 cm 肥瘦相间的肉块;将肉块与腌料混合后置于4 ℃冰箱腌制48 h,猪肉与腌料的比例为猪肉:盐:糖:五香粉=100:3:2:0.5;腌制完成后,将腌猪肉平铺于培养箱内(温度50 ℃、湿度55%)干燥2.5 h;将市售玉米粉称重(猪肉:玉米粉=2:1)后放入锅中翻炒,直至玉米粉泛白出现香味,添加玉米粉重量2%的白砂糖、3%的食用盐搅拌均匀,放凉;以猪肉重量为基准,分别接入1%的混合发酵剂Lp+Sx+Sc(1:1:1,v/v/v)以及纯种发酵剂Sx-135、Lp-120、Sc-2018,以自然发酵(不接种发酵剂,其他条件均与接种发酵组一致)为对照组,装罐时按一层玉米粉一层猪肉的原则装满整个发酵罐,压实后水封,恒温24 ℃,发酵30 d,每天观察水位并及时补水。将自然发酵组、混合发酵组、Lp-120 组、Sc-2018 组、Sx-135 组样品分别标为A、B、C、D、E,当地购买的贵州苗家老坛酸肉、湘西包谷酸肉、贵州榕江酸肉、贵州黎平酸肉分别标记为F、G、H、I。
1.2.3 感官评定分析 将9 种酸肉去除表面米粉、调料后,蒸15 min。蒸熟后,分别装盘标记为A、B、C、D、E、F、G、H、I 组,请8 名经专业培训过的实验室人员对酸肉进行感官评价,如表2 所示,评价标准有外观、滋味、气味、口感4 个方面,满分40 分,分为3 个等级,最终得分以平均值的形式体现。

表2 酸肉感官评价评分标准Table 2 Evaluation criteria of sour meat
1.2.4 酸肉的水分含量测定 根据GB 5009.3-2016《食品中水分的测定》中的直接干燥法测定不同组酸肉的水分含量。
1.2.5 酸肉的pH 测定 根据GB 5009.237-2016《食品pH 的测定》测定不同组酸肉的pH。
1.2.6 酸肉的过氧化值测定 根据GB 5009.227-2016《食品中过氧化值的测定》中的滴定法测定不同组酸肉的过氧化值。
1.2.7 酸肉生物胺含量的测定 参照Kim 等[12]的生物胺测定方法:称取5 g 样品,向样品中加入10 mL、0.6 mol/L 的高氯酸溶液,均质匀浆后冷冻离心20 min(10000 r/min),重复两次离心后合并上清液,用0.6 mol/L 的高氯酸溶液定容至25 mL,吸取1 mL待测液于5 mL 棕色容量瓶中,向容量瓶中加入2 mol/L NaOH 溶液200 μL、300 μL 的饱和NaHCO3溶液、10 mg/mL 丹磺酰氯丙酮溶液1 mL,40 ℃下避光45 min,然后加入100 μL 浓氨水终止反应,静置30 min,反应结束后用乙腈定容至5 mL,过0.22 μm 的有机滤膜后取1 mL 于棕色液相瓶待测。
检测条件:高效液相色谱仪,反向色谱柱C18-Diamondsil(25 cm×4.6 mm,5 μm),柱温30 ℃,流速设为1 mL/min,进样量为20 μL;流动相为0.1 mol/L醋酸铵、乙腈;梯度洗脱程序如下:0~35 min,50%~90%乙腈,35~45 min,90%~50%乙腈,45~59 min,50%乙腈;检测波长为254 nm。在相同的色谱条件下测定生物胺标准品,绘制标准曲线。
1.2.8 酸肉中有害微生物的研究 参照孙颖瑛[13]的方法用假单胞菌CFC 选择性培养基测定假单胞菌;根据SB/T 10462-2008《肉与肉制品中肠出血性大肠杆菌O157:H7 检测方法》检测肠出血型大肠杆菌;根据GB 4789.10-2016《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》第二法检测金黄色葡萄球菌;根据GB 4789.4-2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》检测沙门氏菌;根据GB 4789.7-2013《食品安全国家标准 食品微生物学检验 副溶血性弧菌检验》检测副溶血性弧菌;根据GB 4789.30-2016《食品安全国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验》第一法检测单核细胞增生李斯特氏菌。
1.2.9 酸肉亚中硝酸盐含量测定 根据GB 5009.33-2016《食品中亚硝酸盐与硝酸盐的测定》中的分光光度法测定不同组酸肉的亚硝酸盐含量。
1.3 数据处理
每组样品做3 组平行实验,数据处理使用SPSS数据处理软件,作图使用Origin 2017 作图软件,使用Excel 2013 软件绘表,数据表现形式为“平均值±标准差”。
2 结果与分析
2.1 感官评定
对9 种酸肉进行感官评定,结果如图1所示,H 组酸肉感官评定总分分值相对较高达到7.19 分,自然发酵和接种发酵组(A、B、C、D、E)的总分在6.09~6.97 之间,而传统发酵F、G、I 组的总分在6.38~6.63 之间。在口感方面,所有组别的得分在5.75~7.13之间,其中,A、D 两组得分最高,达到7.13 分。气味方面,所有接种发酵组(B、C、D、E)的气味得分均在7.12 分以上,C 组得分最高,得分为7.38 分。滋味方面,接种发酵组在5.75~5.88 分之间,得分B=C>D=E;传统发酵中H、I 组滋味得分最高,得分为6.75分。外观方面,接种发酵D 组得分达到7.50 分,传统发酵H、I 组得分则为7.75 分。总体来看,接种发酵组与传统发酵组的大众接受度均较高。

图1 接种发酵和传统自然发酵酸肉的感官评定Fig.1 Sensory evaluation of sour meat by inoculation fermentation and traditional natural fermentation
2.2 酸肉中水分含量的测定分析
酸肉中的水分对酸肉的外观、口感、发酵剂活性等有很大影响。作为影响产品保藏的重要因素,水分含量高会降低产品的保质期。水分含量低,则有利于抑制腐败微生物的生长,但同时也增加了肉的硬度和咀嚼性,从而影响肉的口感。不同酸肉样品水分含量如图2 所示,结果表明,接种不同发酵剂的酸肉水分含量在38%~45%的范围内,属于半干肉制品(水分含量30%~50%)范畴,不同样品的水分差异不大。传统发酵酸肉F 组(贵州苗家酸肉),水分含量最低为30%,达到干肉的水分含量标准(水分含量<30%),可能的原因在于该地区酸肉原料处理时采用火烤猪肉的方式,使原料肉中水分含量下降,从而影响成品酸肉的水分含量,其他三种传统发酵酸肉水分含量较所有接种发酵的酸肉样品高,达到55%左右,可能是由于其采用不晾晒、不火烤而直接发酵的加工方式或晾晒、火烤时间较短导致的,干燥时间的差异是各样品水分含量差异的主要原因[14]。此外,较低的pH 可能会导致酸诱导的蛋白质变性,蛋白质的持水能力下降,从而导致水分含量的下降。这可能也是接种发酵酸肉水分更低的原因之一。中国传统发酵酸肉制品的水分含量(30%~54%)与发酵火腿(54%~55%)[15]和发酵香肠(30%~50%)[1]差别不大。
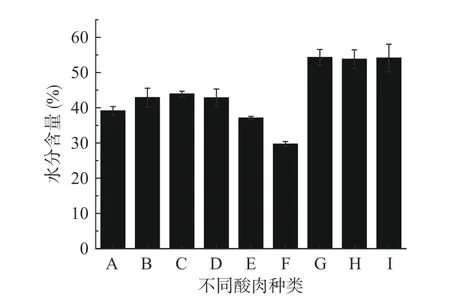
图2 接种发酵和传统自然发酵酸肉的水分含量Fig.2 Water content of sour meat by inoculation fermentation and traditional natural fermentation
2.3 接种发酵对酸肉pH 的影响
酸肉的口感偏酸是由于乳酸菌等微生物在发酵过程中产生有机酸[16],使酸肉的pH 下降。由图3 可知,不同接种发酵的酸肉(B、C、D、E 组)pH 无明显差异且均在4.5 以下。研究发现,pH 在4.6 以下时,能够抑制致病菌的生长[17−18],延缓食品腐败,食品更容易保藏[19]。pH 的降低与有机酸的积累有关,酸肉发酵过程中接种的植物乳杆菌数量在发酵过程中迅速增加,能够产生大量的有机酸,从而使发酵环境的pH 降低。发酵过程中产生的细菌素对腐败微生物也有抑制作用[20]。另外,之前研究发现接种的木糖葡萄球菌和酿酒酵母能够促进植物乳杆菌的生长,从而进一步促进pH 的降低[19]。但是传统发酵酸肉F~I 组的pH 在4.5~4.7 之间,比接种发酵组pH 高,证实了接种的发酵剂具有较强的酸化能力。另外,Chen等[21]研究发现,肌肉中存在的内源性脂肪酶在较低的pH 下更活跃,而且乳酸菌代谢引起的酸化也可以激活内源性蛋白酶,从而有助于风味前体物质的产生。因此,有机酸的积累可能是发酵过程中酸肉独特风味产生的重要原因[22−23]。

图3 接种发酵和传统自然发酵酸肉的pHFig.3 pH value of sour meat by inoculation fermentation and traditional natural fermentation
2.4 接种发酵对酸肉过氧化值的影响
由于肉制品在发酵过程中会受到光线、温度、湿度、微生物产物以及氧气的影响,肉中含有的脂肪成分会发生一系列复杂的化学变化,造成脂肪的过度水解和氧化,引发酸肉酸败[24]。过氧化值是评价脂质氧化程度的重要参数之一。如图4 所示,不同样品的过氧化值差异明显。C 和D 两组酸肉的过氧化值含量分别为0.0377、0.0433 g·(100 g)−1,与H 组传统发酵酸肉的数值相近,比传统发酵G、I 组降低70%左右,且明显低于自然发酵组和其他接种组,原因可能是植物乳杆菌和酿酒酵母在发酵过程中促进了蛋白质分解,而蛋白质分解产生的组氨酸有一定的生物活性,也会抑制脂质分解[25],从而降低酸肉的过氧化值。接种发酵组中E 组的过氧化值最高达到0.145 g·(100 g)−1,说明Sx-135 对酸肉脂肪的氧化水解抑制程度低;传统发酵组中G、I 组的过氧化值分别为0.181、0.158 g·(100 g)−1,其过氧化值较高的原因可能是由于发酵过程中采用了烟熏猪肉或将猪肉放在了烟熏过得坛子中,加速了脂质的氧化和分解[26],且I 组发酵时间很长(150~180 d),这可能也是I 组过氧化值较高的原因之一。另外,传统自然发酵酸肉的微生物种类复杂,微生物作用及其代谢产物酶促进了饱和脂肪酸和不饱和脂肪酸的氧化[27]。但接种发酵组和传统自然发酵组的过氧化值均在GB 2730-2015《食品安全国家标准腌腊肉制品》的限制范围内(≤0.5 g·(100 g)−1)。脂质氧化分解有利于风味物质的产生,但过度氧化就会产生腐臭味和哈喇味等异味,食用后可能造成中毒,引起身体不适[28]。总体来看,接种发酵可以降低酸肉的过氧化值,促进风味物质积累,抑制酸肉酸败。

图4 接种发酵和传统自然发酵酸肉的过氧化值Fig.4 Peroxidation value of sour meat by inoculation fermentation and traditional natural fermentation
2.5 接种发酵对酸肉生物胺的影响
生物胺是一种低分子量的含氮化合物,普遍存在于发酵食品中,人体中大量积累会产生中毒症状[19]。如表3 所示,不同酸肉样品中检测出的生物胺有7 种,包括腐胺、尸胺、组胺、色胺、酪胺、精胺和亚精胺。4 种传统发酵酸肉样品生物胺总量范围在961.20~4687.37 mg·kg−1之间。除了F 组外,其他3 组(G、H、I)样品的生物胺总量均超出了生物胺总量的限量要求(约1000 mg·kg−1)。接种发酵组(B、C、D、E)的生物胺总量在745.65~1592.84 mg·kg−1,较传统发酵酸肉生物胺降低了3~4 倍。表明接种发酵很好地抑制了酸肉中生物胺的积累。其中,D 组生物胺总含量最低,对生物胺积累的抑制效果最明显。C 组和B 组也能有效降低酸肉中的生物胺含量。但E 组生物胺含量较高,有研究发现木糖葡萄球菌对尸胺、腐胺的降解能力较弱[29],这可能是导致生物胺总量高的原因。另外研究发现,原料种类、发酵温度、以及不同微生物群落等因素均对生物胺的积累有影响[30]。接种发酵过程中可以严格控制发酵温度、时间等因素,而传统发酵随气候、温度等自然条件的变化不断改变发酵条件,也会导致生物胺含量增加[31]。
酪胺和组胺是发酵产品中最主要的生物胺,美国食品药品监督管理局(FDA)中对水产品中酪胺和组胺的最大限量值分别为100 和50 mg·kg−1[5],高于限量值将对人体产生毒性。实验结果如表3 所示,接种发酵组的组胺含量在5.10~7.59 mg·kg−1之间,酪胺含量在27.35~51.41 mg·kg−1之间,两种生物胺均在限量范围内(组胺≤50 mg·kg-1、酪胺≤100 mg·kg−1),且低于传统发酵G、H、I 组,说明接种发酵有抑制酪胺和组胺积累的作用。色胺、尸胺、腐胺、精胺、亚精胺也被有效抑制,可能是因为发酵菌株能够产生生物胺氧化酶,从而降低生物胺含量[32−33]。Dapkevicius等[34]也发现乳酸菌菌株对发酵鱼中的组胺有降解作用。

表3 接种发酵和传统自然发酵酸肉生物胺含量(mg/kg)Table 3 Content of biogenic amine in sour meat by inoculation fermentation and traditional natural fermentation (mg/kg)
传统发酵组中H、I 组的酪胺数值>100 mg·kg−1超过限量,说明传统发酵酸肉可能存在酪胺中毒的风险。F 组的酸肉酪胺数值为6.08 mg·kg−1在限定范围内且未检测出组胺。可能的原因在于发酵时间短,含有组氨酸脱羧酶和酪氨酸脱羧酶的微生物尚未发挥作用,或受到抑制,酪胺和组胺没有富集[8]。
与传统发酵酸肉相比,接种发酵组也显著(P<0.05)降低了尸胺、腐胺、精胺、亚精胺的积累。尸胺、腐胺含量比传统发酵组降低了2~3 倍,精胺含量也降低了3~5 倍,亚精胺含量降低了5~10 倍,目前虽然没有这几种生物胺的限定值,但有研究报道,尸胺、腐胺的积累能够抑制二级胺代谢酶(如胺氧化酶)的活性从而增强酪胺和组胺的毒性。
2.6 不同酸肉样品中有害微生物分析
有害微生物的生长繁殖是酸肉腐败变质的重要原因,发酵肉制品的保质期比普通肉制品的保质期长,一部分原因是发酵能够抑制肉制品中有害微生物的增长[35]。摄入有害微生物超标的食品会影响人体健康,医学发现:大肠杆菌和副溶血性弧菌超标会引起恶心呕吐等症状;沙门氏菌超标会导致食物中毒,诱发急性肠胃炎等;李斯特菌超标后,发病率为十万分之一但致死率高达12.5%;假单胞菌会产生外毒素A(PEA),这种物质可以阻碍蛋白合成,造成组织坏死;金黄色葡萄球菌感染会导致肺炎、败血症、脓毒症等。研究结果表明,六种致病菌在接种发酵组和保质期内的传统发酵组酸肉中均未检出,在pH<4.6的酸性环境中,致病菌的生长繁殖被有效抑制。Chen等[36]也研究发现,传统发酵酸肉中的植物乳杆菌和葡萄球菌能够抑制肠杆菌和单核增生李斯特菌的生长繁殖。通过发酵技术对肉制品进行加工后的一定时间内,酸肉具有良好的微生物安全性。
2.7 接种发酵对酸肉中亚硝酸盐含量的影响
发酵腌制产品中会出现亚硝酸盐含量超标现象,发酵过程中食物中部分硝酸盐会在微生物作用下还原为亚硝酸盐,亚硝酸盐在人体中在会转化成亚硝胺类化合物,这类化合物有强致癌性,食用过多含有亚硝酸盐的食物会严重影响人体健康。结果如图5所示,所有酸肉均明显低于GB 2760-2014《腌腊肉制品卫生标准》规定的食品中亚硝酸盐限量值(30 mg·kg−1)[37]。这表明传统发酵酸肉残留的亚硝酸盐没有食用安全风险。中国传统发酵酸肉样品中的亚硝酸盐含量在3.3~4.5 mg·kg−1之间,其中,G 组亚硝酸盐含量最高,F 组最低。与传统发酵酸肉相比可知,接种发酵能够抑制亚硝酸盐的积累,B、C、D、E 组的亚硝酸盐含量均小于3.5 mg·kg−1。接种的发酵剂可能抑制了还原型细菌的生长繁殖,降低了硝酸盐还原酶活性,从而减少了亚硝酸盐的形成且接种发酵组的水分含量偏低也不利于还原细菌的生长。另外,接种发酵过程中由于产生了足够的H+与NO2-反应,使亚硝酸盐还原,导致接种组的亚硝酸盐含量较低[38]。其中,接种酵母菌的D 组亚硝酸盐含量最低,达到2.129 mg·kg−1,可能是因为酿酒酵母发酵过程中更易产生被还原的醇,还原型微生物无法作用在硝酸盐上,从而使亚硝酸盐含量降低,并且也能抑制亚硝胺类化合物的累积[39]。总体来看,接种发酵酸肉有更好的亚硝酸盐安全性。

图5 接种发酵和传统自然发酵酸肉的亚硝酸盐含量Fig.5 Nitrite content of sour meat by inoculation fermentation and traditional natural fermentation
3 结论
4 种不同地区的传统发酵酸肉过氧化值、致病菌以及亚硝酸盐含量远远低于限量标准,但是湘西包谷酸肉、贵州榕江酸肉以及贵州黎平酸肉存在生物胺积累的问题。接种发酵酸肉(混合接种、Lp-120 和Sc-2018)在亚硝酸盐、生物胺、过氧化值等安全性方面均表现出一定的优越性,可以通过接种发酵提高酸肉的食用安全性,为后续酸肉的安全性研究提供理论依据,为工业化生产提供实践经验。考虑到单一接种发酵可能带来的风味和感官上的缺失,下一步可通过对其风味物质、营养指标等进行研究并辅以感官评定,进一步探究接种发酵酸肉品质的变化。
