槲皮素、芦丁与大豆分离蛋白非共价作用机制及其功能性和消化性研究
2022-08-06赵钜阳袁惠萍孙昕萌
赵钜阳,袁惠萍,孙昕萌,金 聪
(哈尔滨商业大学旅游烹饪学院,黑龙江哈尔滨 150030)
黄酮类多酚具有较强的抗氧化[1]、抑菌[2]、抗衰老[3]等功效,并参与癌症、炎症、糖尿病等疾病的治疗[4]。蛋白质是食物的重要组成成分,而多酚作为次级代谢产物大量存在于植物中。蛋白质和多酚是多种食品中共存的重要成分,食品系统的成分多种多样,成分之间的相互作用对食品的生产、加工和营养价值起着至关重要的作用。
蛋白质和多酚之间的相互作用可生成“蛋白质-多酚复合物”,在大多数食品系统中自发进行。多酚与蛋白质相互作用方式主要分为非共价和共价相互作用[5],其中,非共价相互作用具有作用方式简便,无副产物等优势,主要通过氢键、范德华力和疏水力等方式起作用。目前,已有相关学者研究发现,多酚/蛋白相互作用会影响蛋白质的部分功能性质,如蛋白质与多酚相互作用会导致蛋白质分子的净电荷发生变化,从而影响蛋白质的溶解性[6]。由于蛋白质的溶解性是其他功能性质的前提,研究也发现多酚与蛋白非共价相互作用还可提高蛋白的乳化能力及凝胶能力,如表没食子儿茶素没食子酸酯[7]与乳清蛋白互作可提高乳清蛋白的乳化活性,裘乐芸等[8]研究发现添加表没食子儿茶素没食子酸并微波加热后肌原纤维蛋白的凝胶强度可提高89.8%。但另一方面,研究也发现多酚/蛋白复合后,蛋白质消化特性会受到负面影响,如Petzke 等[9]研究发现绿原酸与乳清蛋白相互作用后会降低乳清蛋白的消化率,刘勤勤[10]研究表明茶多酚的添加不利于大豆分离蛋白在胃肠道里的消化吸收。然而诸如槲皮素、芦丁等此类黄酮多酚与SPI 互作后,对SPI 功能特性的影响及其机制研究还不明晰。
因此,本文通过构建两种黄酮(槲皮素、芦丁)与大豆分离蛋白(soybean protein isolate,SPI)复合物,分别考察槲皮素、芦丁对SPI 部分功能性与体外模拟胃肠道消化性的影响,以期开发新型多功能黄酮类多酚的蛋白型包合物,为SPI、槲皮素和芦丁的应用范围提供新思路和基础依据。
1 材料与方法
1.1 材料与仪器
大豆分离蛋白 纯度98.54%,实验室自制;脱脂豆粕 蛋白质含量49.60%,哈尔滨市宾县禹王植物蛋白有限公司;槲皮素 纯度>98%,酷尔化学科技有限公司;芦丁 纯度>98%,合肥博美生物科技有限公司;大豆油 特级,九三粮油工业集团有限公司;十二烷基磺酸钠(SDS) 分析纯,西陇科学股份有限公司;盐酸、氢氧化钠、磷酸二氢钠、磷酸氢二钠 分析纯,北京新光化工试剂厂;胃蛋白酶(酶活力1:3000)、胰脂肪酶(酶活力30000 U/g)、胰酶(1:4000)、胆盐(纯度≥60%) 上海源叶生物科技有限公司。
TMS-Touch 250N 质构仪 Food Technology Corporation;H1850R 高速离心机 湖南湘仪实验室仪器开发有限公司;UV-800 紫外可见分光光度计上海元析仪器有限公司;K9860 全自动凯氏定氮仪山东海能科学仪器有限公司。
1.2 实验方法
1.2.1 大豆分离蛋白提取 根据Speroni 等[11]的方法,采用碱溶酸沉法提取大豆分离蛋白。400 g 脱脂豆粕加入6 L 蒸馏水中,用2 mol/L NaOH 调节至pH7.8,搅拌2 h 后,将溶液于4000×g 离心15 min,取其上清液用2 mol/L 盐酸调节至pH4.5,于4 ℃环境静置2 h,倒去上清液,将剩余的沉淀于8000×g下离心10 min,离心后取底部沉淀,用5 倍体积蒸馏水水洗后,于4000×g 离心10 min,用2 mol/L NaOH溶液调节至蛋白溶液pH7 即可,溶液预先冷冻并真空干燥48 h 研磨备用,即可获得大豆分离蛋白。
1.2.2 SPI-槲皮素和SPI-芦丁复合物制备 SPI-槲皮素和SPI-芦丁复合物是通过非共价作用制备的[12],制备方法稍作修改如下:将1 g SPI 溶解在49 mL 0.01 mol/L 磷酸盐缓冲溶液(PBS,pH7.0)中,向该混合物中添加不同比例(0%、2%、4%、6%、8%、10%)的芦丁和槲皮素于25 ℃磁力搅拌器搅拌2 h。将反应样品透析48 h(分子量截止值:8000~14000 Da),每6 h 更换一次水以确保完全透析,使用紫外分光光度计记录透析液在槲皮素374 nm,芦丁266 nm 处有没有吸收峰,所有未反应的多酚被完全去除,透析液预先冷冻并真空干燥48 h 备用。
1.2.3 复合物功能性的测定
1.2.3.1 溶解性的测定 称取适量槲皮素、芦丁与SPI复合物溶于pH7.0 的0.01 mol/L PBS,保证SPI 浓度为10 mg/mL,于8000×g,15 min 离心,取0.1 mL离心后的上清液,加入5 mL 考马斯亮蓝试剂,充分混合,放置10 min,以试剂空白为对照,测定波长595 nm 处的吸光度,平行三次。根据上述所得标准蛋白浓度曲线公式(y=0.0788x−0.1063,R2=0.9930),求得添加不同浓度槲皮素或芦丁下SPI 的蛋白浓度[13]。
1.2.3.2 乳化性和乳化稳定性测定 根据Pan 等[14]的方法测定大豆蛋白乳化性和乳化稳定性。称取适量槲皮素、芦丁与SPI 复合物,保证SPI 浓度为10 mg/mL,取8 mL 配制好的样品加入2 mL 的大豆油,以12000 r/min 高速匀浆1 min 后,立刻在试管底部取50 μL 样品,然后加入到5 mL 0.1% SDS 溶液中,于500 nm 处测定其吸光值,后将取样后的样品于室温下静置10 min,再次取样,测定方法同上,实验平行三次。
乳化活性(EAI)及乳化稳定性(ESI)分别根据下式进行计算:

式中:EAI:1 g 蛋白质的乳化区域,m2/g,C:蛋白质浓度,g/mL;φ:油相体积分数(v/v),即油相占的比例,本实验中油相占1/4,故φ=0.25;D:稀释倍数为100;A0:500 nm处0 min 的吸光值;A10:500 nm 处10 min 的吸光值。
1.2.3.3 凝胶性测定 称取适量槲皮素、芦丁与SPI 复合物,保证SPI 浓度为120 mg/mL,每组样品90 ℃水浴加热30 min,冷却后放置于4 ℃冰箱中贮藏12 h。测量前将样品取出,室温下稳定恢复30 min,室温下用质构仪进行测量,选用P/0.5 的探头,以凝胶硬度进行测定,测前速度:60 mm/min,测试速度:120 mm/min,测后速度:300 mm/min,压缩型变量:40%,记录测试峰的顶点,即为测定凝胶的硬度(N)。重复三次平行实验,取平均值[15]。
1.2.4 消化特性测定 称取适量槲皮素、芦丁与SPI 复合物,保证SPI 浓度为10 mg/mL,采用模拟体外消化模型来测定大豆分离蛋白消化特性,参考Brodkorb 等[16]的消化模型,参考Mao 等[17]的方法制备模拟消化液,适当修改。胃液(包含2 g/L NaCl、7 mL/L HCl 和3.2 g/L 胃蛋白酶)用1 mol/L HCl 调节至pH1.2,预热至37 ℃后,与预热至37 ℃的样品以1:1 的体积比混合,采用1 mol/L NaOH 将混合体系pH 迅速调节至2.0,于37 ℃振荡(100 r/min)消化2 h。在胃消化0、30、60、90、120 min 处取消化样品,于8000×g,15 min 离心后分别测定其在520 nm 条件下的吸光值。取30.0 mL 胃消化后的食糜,用2 mol/L NaOH 迅速将混合后的体系调至pH6.8,分别与1.5 mL 电解质溶液(二水氯化钙36.70 mg/mL、氯化钠218.70 mg/mL),2.5 mL 胆盐溶液(胆盐0.08 mg/mL)和3.5 mL 酶溶液(胰酶0.02 mg/mL、胰脂肪酶0.02 mg/mL)混合均匀,采用1 mol/L NaOH 将混合体系pH 迅速调节至7.0,于37 ℃恒温振荡(100 r/min)消化2 h,分别在肠消化0、30、60、90、120 min 处分别取消化样品,测定其在520 nm 条件下的吸光值。
将各个时间点的样品离心后,已消化的蛋白质含量通过上清液的吸光值代入蛋白质含量标准曲线得出蛋白质含量。

1.2.5 紫外吸收光谱测定 用10 mmol/L,pH7.0 PBS 稀释至样品中蛋白质浓度为1 mg/mL,用紫外分光光度计扫描其紫外吸收谱图,扫描波长范围为200~400 nm,扫描间隔λ=1 nm,扫描速度:100 nm/min,其中,用磷酸盐缓冲溶液作为空白调零[18]。
1.2.6 荧光光谱测定 用10 mmol/L,pH7.0 PBS 稀释至样品中蛋白质浓度为0.1 mg/mL,测定样品的荧光光谱,设置激发波长295 nm,扫描范围为300~500 nm,激发和发射狭缝宽为5 nm,扫描速度为500 nm/min,分别在293 和310 K 的恒温条件下收集荧光光谱信息,每组样品重复测定三次[19]。

式中,F0为不添加槲皮素/芦丁时SPI 的荧光强度;F 为添加槲皮素/芦丁时SPI 荧光强度;kq为分子淬灭常数;kSV为Stern-Volmer 淬灭常数;τ0为不添加槲皮素/芦丁时荧光物质的平均寿命(对于蛋白质等生物大分子,荧光寿命一般为10−8s)。将Stern-Volmer 方程转化为公式(4)可进一步分析出儿茶素与SPI 相互作用的结合位点数和结合常数。

式中:Kb为SPI 与槲皮素/芦丁的结合常数;n 为二者结合的位点数,根据数据结果可绘制与log[Q]的关系,并确定截距Kb和斜率n。
根据热力学参数的评估槲皮素/芦丁与SPI 之间的相互作用力,由公式(5)、(6)和(7)推算槲皮素/芦丁与SPI 结合的吉布斯自由能(ΔG)、焓变(ΔH)和熵变(ΔS)。
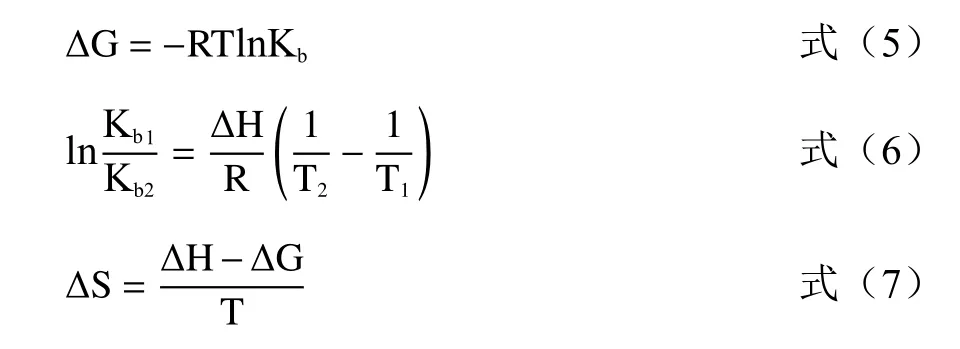
1.3 数据处理
使用Statistix 8.0 软件分析数据的显著性。使用Excel 和Sigmaplot 14.0 软件进行表与图的制作。
2 结果与分析
2.1 复合体系溶解性分析
溶解度是蛋白质在复杂食品系统中发挥功能性质(如乳化特性)的先决条件[20]。图1 表示了槲皮素-SPI 复合物和芦丁-SPI 复合物中蛋白的溶解度,随着槲皮素添加量的增加,SPI 溶解性呈现先增加后趋于平缓的趋势,不同添加量槲皮素的溶解性显著高于对照组(P<0.05),槲皮素添加量为4%时,SPI 溶解性比对照组可提高10.06%,这是由于槲皮素中含有羟基基团,通过氢键、疏水及静电吸附等方式与蛋白质结合[21],导致SPI 亲水性增加,增强了SPI 的水合作用,SPI 的溶解性有所提高。槲皮素添加量为4%、6%、8%和10%时溶解度未见显著性增加(P>0.05),可能是由于槲皮素的疏水基团数目有限,与SPI 结合程度已达最大。由图1 所示,随着芦丁添加量的增加,SPI 溶解性呈现先增加后减少的趋势,芦丁添加量为6%时,和对照组相比,SPI 溶解性可提高19.27%,这是由于芦丁含有羟基基团能与水分子形成氢键,从而增强了蛋白的水合作用,因而SPI 的溶解性有所提高,但SPI 溶解度的下降可能是由于芦丁浓度过高,导致其与部分蛋白发生稳定结合后,形成相对稳定的网状结构,进而形成絮状物沉淀[22],由此降低了SPI 在水中的溶解度。已有相关研究人员[23]发现,由于溶菌酶、核桃蛋白和马铃薯蛋白在内的蛋白质与酚类化合物的相互作用,其溶解度降低,这可能是由于蛋白质的诱导交联以及蛋白质分子的净电荷和亲水/疏水性质改变的原因。

图1 槲皮素-SPI 复合物和芦丁-SPI 复合物中蛋白的溶解度Fig.1 The solubility of SPI in quercetin-SPI complexes and rutin-SPI complexes
2.2 复合体系乳化性的分析
图2a、b 分别表示了槲皮素-SPI 复合物和芦丁-SPI复合物中蛋白的EAI 和ESI。由图2 可知,随着槲皮素添加量的增加,SPI 的EAI 和ESI 都呈现先增加后趋于平缓的趋势,添加槲皮素的SPI 其EAI 和ESI 显著高于对照组(P<0.05),并且槲皮素添加量为4%时,和对照组相比,SPI 的EAI 和ESI 分别提高20.84%及11.44%。蛋白质的乳化特性取决于其扩散到油/水界面的能力[24],SPI 可作为表面活性剂,吸附到油滴表面形成界面膜,稳定乳状液,EAI 的提高是由于暴露的芳香残基数量增加,从而导致蛋白质对油水界面的亲和力增加,且聚集的SPI 形成了更厚的蛋白膜,从而为液滴提供了更好的乳化稳定性[25]。槲皮素的添加量为6%、8%和10%时,此时SPI 的EAI无显著性差异(P>0.05),可能是由于SPI 暴露的芳香氨基酸数量不再增加。
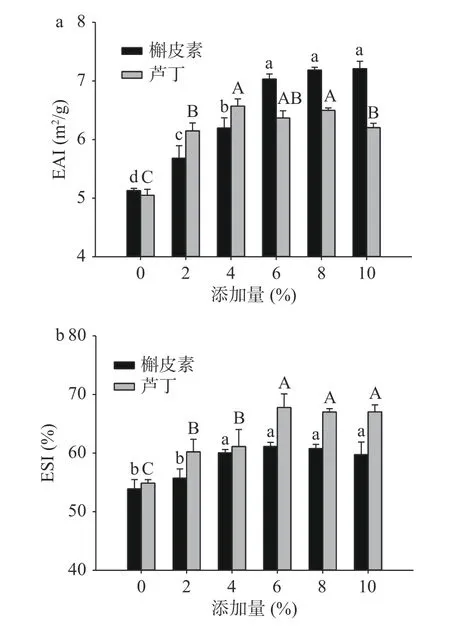
图2 槲皮素-SPI 复合物和芦丁-SPI 复合物中蛋白的乳化活性及乳化稳定性Fig.2 The emulsifying activity and emulsifying stability of SPI in quercetin-SPI complexes and rutin-SPI complexes
如图2 所示,随着芦丁添加量的增加,SPI 的EAI 和ESI 都呈现先增加后略有下降的趋势,添加芦丁的SPI 其EAI 和ESI 显著高于对照组(P<0.05),当芦丁添加量为4%时,和对照组相比,SPI 的EAI提高26.17%,当芦丁添加量为6%时,和对照组相比,SPI 的ESI 分别23.54%。SPI 与芦丁相互作用后的构象变化会影响其表面性质,从而形成稳定的乳液系统,因此,SPI-芦丁形成的乳液的稳定性优于SPI 形成的乳液。后续对结构的研究结果表明槲皮素和芦丁诱导的蛋白质构象发生变化。因此,SPI 表面性质的构象变化导致乳化性能的改善。Li 等[26]研究发现与花青素结合后,水稻蛋白的EAI 和ESI 得到了提高,原因可能是与花青素结合后蛋白质构象和界面行为改变有关。
2.3 复合体系凝胶性的分析
图3 表示槲皮素-SPI 复合物和芦丁-SPI 复合物中蛋白的凝胶硬度,槲皮素添加量(除添加量8%外)对SPI 凝胶性的影响无显著性差异(P>0.05),槲皮素的添加量为8%时,和对照组相比,SPI 凝胶硬度提高23.23%,此时SPI 的凝胶性显著高于其他组(P<0.05),这是由于槲皮素酚羟基的数量较少,氢键相互作用能力弱,但槲皮素添加量在8%时可能增加槲皮素与SPI 的氢键相互作用力,从而影响凝胶硬度。随着芦丁添加量的增加,SPI 凝胶硬度呈现先增加后减少的趋势,不同添加量芦丁的SPI 凝胶硬度显著高于对照组(P<0.05),芦丁添加量在8%时,和对照组相比,SPI 凝胶硬度可提高 187.18%。这是由于芦丁与蛋白质相互作用后,蛋白分子间碰撞的机会和结合程度增加,氢键作用能力增加,从而增强了凝胶的硬度。随着芦丁浓度的增加,与SPI 结合的羟基数量逐渐增加,慢慢趋于饱和,多余的羟基与氨基酸残基继续反应,会破坏已形成的凝胶网络结构的稳固性,因此,二者复合物的凝胶性降低[27]。Yan 等[28]研究表明芦丁和没食子酸可提高凝胶强度,其原因可能是没食子酸和芦丁分子在凝胶形成过程中主要与明胶分子的骨架和羧基相互作用。

图3 槲皮素-SPI 复合物和芦丁-SPI 复合物中蛋白的凝胶硬度Fig.3 The gel hardness of SPI in quercetin-SPI complexes and rutin-SPI complexes
2.4 复合体系消化特性的分析
图4 代表槲皮素-SPI 复合物和芦丁-SPI 复合物中蛋白的胃肠消化。添加槲皮素、芦丁的SPI 生物利用度明显高于对照样,这种现象可以归因于SPI经胰酶消化后可迅速被胆盐降解,槲皮素、芦丁的添加可以保护SPI 被胆盐降解,槲皮素、芦丁的添加可以提高SPI 的生物利用度。但是不同添加量的槲皮素、芦丁之间生物利用度无明显差异。SPI 生物利用度在消化30 min 时迅速增加,这是因为初始阶段,胃蛋白酶充足,满足SPI 消化的条件,随着消化时间的增加,胃蛋白酶被消化,从而SPI 生物利用度略有降低。肠道消化阶段,除肠道消化240 min 时,SPI的生物利用度无明显差异。目前已有大量研究发现多酚都能保护蛋白质免受胃蛋白酶消化的影响,从而导致蛋白质的肠道消化出现总体轻微延迟[29],也有部分学者发现多酚可减弱对消化酶的抑制作用,如Naz 等[30]研究发现EGCG 对消化酶的抑制作用被唾液中富含脯氨酸蛋白减轻了2~6 倍,从而影响生物利用度。
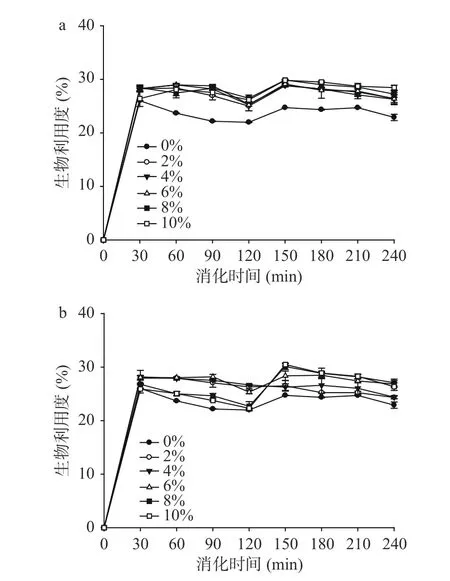
图4 槲皮素-SPI 复合物和芦丁-SPI 复合物中蛋白的胃肠消化Fig.4 The gastrointestinal digestion of SPI in quercetin-SPI complexes and rutin-SPI complexes
2.5 紫外-可见吸收光谱迁移分析
紫外-可见吸收光谱法是一种非常简单有效的方法,常被用于探索蛋白质的结构变化和研究配体-蛋白质复合物的形成。SPI 有两个吸收峰:由蛋白质肽键引起的强吸收峰(220 nm)和由芳香族氨基酸引起的弱吸收峰(280 nm)[31]。图5 表示了不同槲皮素、芦丁添加量对大豆分离蛋白紫外可见光谱的影响。随着槲皮素、芦丁的添加,SPI 在280 nm 附近的吸收峰强度逐渐减小,而SPI 在220 nm 附近的吸收峰强度逐渐增大,槲皮素、芦丁在200~300 nm 范围内没有吸收,因此,SPI 吸收强度的降低可能是槲皮素、芦丁与SPI 相互作用的结果。加入槲皮素、芦丁后,吸收峰在220 nm 附近增加,推测蛋白质肽键参与了槲皮素、芦丁与SPI 相互作用的过程,且说明槲皮素、芦丁与SPI 的结合引起了SPI 的构象变化。
图5 槲皮素、芦丁不同添加量对大豆分离蛋白紫外可见光谱的影响Fig.5 The effect of quercetin,rutin on the UV-Vis spectra of soy protein isolate
2.6 荧光淬灭机制分析
图6 代表不同槲皮素、芦丁添加量对大豆分离蛋白荧光光谱及Stern-Volmer 图的影响,在温度298、310 K 条件下,随着槲皮素、芦丁的加入,箭头表示槲皮素、芦丁添加量从0%~10%,SPI 的荧光强度有明显减弱,且各温度下都表现出不同程度的蓝移现象,表明槲皮素、芦丁和SPI 发生了相互作用使得部分色氨酸、酪氨酸和苯丙氨酸残基暴露,疏水环境的极性减弱,疏水性增加,肽链的伸展程度有所减弱[32],从而增加了蛋白分子间的碰撞机会、结合程度和氢键作用能力,凝胶硬度得到改善。槲皮素-SPI复合物、芦丁-SPI 复合物由于疏水性增加且结构发生改变,SPI 溶解性、乳化性和凝胶性得到了提高。
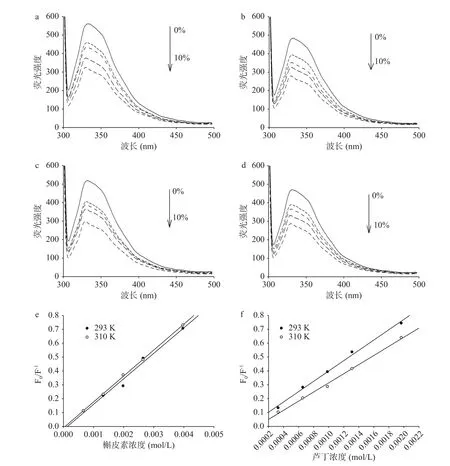
图6 槲皮素、芦丁不同添加量对大豆分离蛋白荧光光谱及Stern-Volmer 图的影响Fig.6 The effect of quercetin,rutin on the fluorescence spectrum and Stern-Volmer plot of soy protein isolate
表1 代表槲皮素、芦丁与SPI 反应过程淬灭常数及热力学参数信息,由表1 可知,根据不同添加量槲皮素、芦丁的Stern-Volmer 公式可得到线性回归拟合方程已知动力学机制的最大动态猝灭常数为2.0×1010L•mol−1s−1[33],槲皮素引起的SPI 淬灭速率常数小于动态猝灭的速率常数极限,因此,槲皮素引对SPI 的淬灭机制应为动态淬灭,且Ksv随温度的升高而升高,表明其机制为动态淬灭。而芦丁引起的SPI 淬灭速率常数远大于动态猝灭的速率常数极限,因此,芦丁对SPI 的淬灭机制应为静态淬灭,且Ksv随温度的升高而降低[34],表明其机制为静态淬灭。
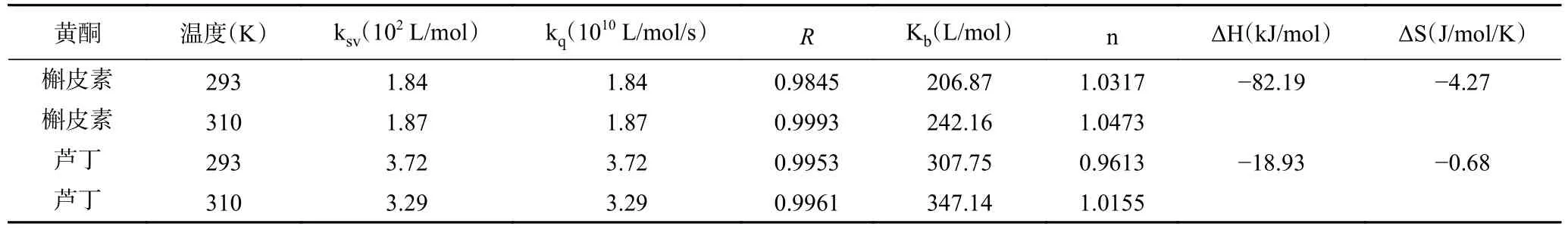
表1 槲皮素、芦丁与SPI 反应过程淬灭常数及热力学参数信息Table 1 The quenching constants and thermodynamic parameters of quercetin,rutin and SPI reaction
结合位点结果表明槲皮素、芦丁与SPI 之间形成比例约为1:1 的复合物。ΔH>0、ΔS>0 主要表现为疏水作用力;ΔH<0、ΔS<0 主要表现为氢键和范德华力;ΔH<0,ΔS>0 主要表现为静电作用力[35]。经计算ΔG<0,说明二者之间的相互作用为自发进行,槲皮素ΔH<0、ΔS<0,芦丁ΔH<0、ΔS<0,因此室温状态下槲皮素、芦丁与SPI 之间的相互作用方式以氢键和范德华力为主,表明槲皮素、芦丁与SPI 之间是非共价相互作用。由于氢键和范德华力的存在改变了蛋白质的三级结构,同时改变了蛋白质的二级结构[36],导致疏水性基团的掩埋,亲水性基团与水相互作用增强,进而影响蛋白质的溶解性等其他功能性质的变化。李楠等[37]也得出类似的结论,薰衣草花色苷与牛血清蛋白之间的作用力是氢键和范德华力。
3 结论
槲皮素、芦丁可提高SPI 的功能特性(溶解性、乳化性、凝胶性)。当槲皮素添加量分别为8%、6%、4%、4%时,可有效提高SPI 凝胶硬度、乳化活性、乳化稳定性、溶解性功能性质分别提高23.23%、20.84%、11.44%、10.06%。芦丁也具有类似的作用,当添加量为8%、4%、6%、6%时,可使SPI 凝胶硬度、乳化活性、乳化稳定性、溶解性提高187.18%、26.17%、23.54%、19.27%。此外槲皮素、芦丁还可提高SPI 的生物利用度,结合Stern-volmer 分析发现槲皮素、芦丁与SPI 淬灭机制属于动态淬灭及静态淬灭,且槲皮素-SPI、芦丁-SPI 复合物荧光光谱均发生蓝移现象,疏水环境的极性减弱,疏水性增加,肽链的伸展程度有所减弱。热力学分析表明,槲皮素、芦丁与SPI 结合是自发进行,两种互作复合物的主要作用力为氢键和范德华力为主。
