miR-152-3p通过调控DUSP1对激素性股骨头坏死BMSCs成骨分化的作用研究*
2022-08-06李双庆崔书伟武瑞臣
李双庆,崔书伟,武瑞臣
(1.沧州市中心医院骨三科,河北沧州 061000;2.冀中能源峰峰集团总医院邯郸院区骨四科,河北邯郸 056000;3.邯郸市中心医院急诊外一科,河北邯郸 056000)
激素性股骨头坏死主要是短期或长期应用糖皮质激素所致的代谢性疾病,临床特征包括股骨头结构坏死、股骨头塌陷、关节功能障碍等[1]。miRNA是一种非蛋白编码小RNA分子,可在转录后调节基因表达,参与调控细胞增殖、分化、凋亡等多种病理生理过程[2]。有研究发现[3],激素性股骨头坏死可能是因激素作用导致细胞内一些miRNA表达改变,调控相应靶基因表达,对正常骨髓间充质干细胞(bone marrow mesenhymal stem cells,BMSCs)成骨分化造成干扰,影响正常骨细胞修复。还有报道显示[4],miR-152-3p在地塞米松刺激的BMSCs中表达上调,但就其对激素性股骨头坏死BMSCs成骨分化作用及机制尚无明确定论。本研究重点分析miR-152-3p对激素性股骨头坏死BMSCs成骨分化的作用,探讨其机制。
1 材料与方法
1.1 病例选择
收集2019年1月至2020年1月沧州市中心医院10例确诊激素性股骨头坏死并行全髋关节置换术患者及10例健康志愿者骨髓组织各10 mL,患者及健康志愿者平均年龄相近[(50.63±7.15)岁vs.(51.87±8.09)岁]。本研究经医院伦理委员会批准(CZSZXYY20190006),研究对象均自愿签署知情同意书。
1.2 主要试剂和仪器
LipofectamineTM3000试剂、胎牛血清、DMEM培养基、胰蛋白酶(赛默飞世尔科技公司),miR-152-3p小干扰RNA(siRNA)、阴性对照NC-siRNA质粒(美国Applied Biosystems公司),实时荧光定量PCR(RT-PCR)试剂盒(德国Qiagen公司),兔抗人双特异性磷酸酶1(dual specificity phosphatase 1,DUSP1)、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)、磷酸化p38 MAPK(phosphorylated-p38 MAPK,p-p38 MAPK)、胞外信号调节激酶1/2(extracelluar signal-regulated kinase,ERK1/2)、磷酸化ERK1/2(phosphorylated-ERK1/2,p-ERK1/2)一抗及山羊抗兔IgG二抗(美国Abcam公司),DMIL-PH1型倒置相差显微镜(德国徕卡微系统有限公司)。
1.3 方法
1.3.1BMSCs分离、培养及鉴定
取健康人、激素性股骨头坏死患者骨髓组织,置于含5 mL PBS离心管,吹打混匀,制备细胞悬液。置于含1.073 g/mL淋巴细胞分离液离心管内,2 000 r/min离心30 min,离心半径8 cm,收集白膜层单个核细胞,置于含10%胎牛血清、低糖型DMEM培养基,细胞密度5×103/cm2。37 ℃、5% CO2培养箱培养,每隔3 d更换1次培养液。观察细胞生长融合率≥80%,培养瓶内加含0.25%胰蛋白、0.02% EDTA的细胞消化液1 mL,1∶2传代比例转移到新培养瓶,继续培养。实验取第3代细胞,镜下观察BMSCs细胞形态学。
1.3.2RT-PCR检测健康人与激素性股骨头坏死患者BMSCs中miR-152-3p、DUSP1 mRNA表达
取健康人、激素性股骨头坏死患者对数生长期BMSCs,Trizol法提取总RNA,纯化,逆转录获得互补链cDNA。反应体系:SYBR®Premix Ex TaqTM12.5 μL,cDNA模版2 μL,上下游引物各1 μL。反应条件:95 ℃预变性5 min;95 ℃变性5 s;60 ℃退火延伸20 s,40个循环。引物设计:miR-152-3p:上游引物5′-TCG TCG AAG TGT TTC AGC A-3′,下游引物5′-TGG CAC CTC TCA AGC GTC A-3′。DUSP1:上游引物5′-GAA CTT CAG TGT TCG TGC A-3′,下游引物5′-CTC GCA CTG TCC GTC AAG A-3′。GAPDH:上游引物5′-AAT CAC TAC GTC CAC TTC T-3′,下游引物5′-CTG GTT GTC ATC ACA CTC G-3′。凝胶电泳,观察电泳条带,以GAPDH为内参,计算miR-152-3p、DUSP1 mRNA相对表达情况(2-ΔΔCT)。
1.3.3细胞转染及分组
取人激素性股骨头坏死对数生长期BMSCs,以含10%胎牛血清DMEM培养基培养。细胞融合度达70%时,根据LipofectamineTM3000转染试剂说明书转染。以转染miR-152-3p-siRNA细胞作为转染组,转染NC-siRNA质粒细胞作为对照组,未经任何处理BMSCs为空白组。转染48 h后,经倒置显微镜观察转染效率(发绿色荧光细胞数/细胞总数×100%),重复5次,取平均值。
1.3.4转染后各组细胞miR-152-3p mRNA表达
取1.3.3 中细胞,接种于96孔板,各组设5个复孔。细胞贴壁后,以Trizol法提取总RNA,按照1.3.2步骤进行RT-PCR检测,反应体系、反应条件、引物设计保持一致,计算miR-152-3p mRNA相对表达水平(2-ΔΔCT)。
1.3.5成骨分化能力评估
取1.3.3中细胞,接种于96孔板,细胞密度2×104/cm2。细胞生长至70%~80%,将培养液更换成骨诱导培养液继续培养。每隔2 d更换1次培养液。诱导后第12天,RT-PCR检测成骨表型标志基因碱性磷酸酶(alkaline phosphatase,ALP)、骨形态发生蛋白 2(bone morphogenetic protein 2,BMP-2)mRNA相对表达水平,评估成骨分化能力。
1.3.6miR-152-3p与DUSP1的靶向关系验证
利用生物信息学软件TargetScan初步预测miR-152-3p与DUSP1 3′UTR的结合位点。含miRNA可能结合位点的DUSP1 mRNA的3′UTR质粒由上海生工生物工程股份有限公司合成并鉴定,转染前24 h,取对数生长期BMSCs,在96孔板内接种。观察细胞生长至70%,将DUSP1 mRNA 3′UTR野生型和突变型荧光素酶报告质粒与内参海肾荧光素酶质粒pRLTK转染至空白组、转染组、对照组,孵育48 h。检测荧光素酶强度,计算相对荧光素酶活性(萤火虫荧光素酶活性/海肾荧光素酶活性)。
1.3.7DUSP1、p-p38 MAPK/p38 MAPK、p-ERK1/ERK1、p-ERK2/ERK2蛋白表达
取1.3.3中细胞,PBS清洗2次,冰上裂解。4 ℃ 12 000 r/min离心10 min,离心半径8 cm,取上清液。二奎啉甲酸法行蛋白定量,加上样缓冲液,沸水浴10 min,变性。凝胶电泳,分离蛋白,转膜,加5%脱脂奶粉封闭1 h。加DUSP1、p-p38 MAPK、p38 MAPK、p-ERK1、ERK1、p-ERK2、ERK2一抗(1∶1 000),4 ℃摇床孵育过夜。TBST洗膜4次,每次10 min。加二抗(1∶2 500),室温孵育2 h。TBST洗膜4次,每次10 min。加ECL试剂,显影曝光。以目的蛋白条带灰度值与GAPDH条带灰度值比值表示目的蛋白相对表达。
1.4 统计学处理
2 结 果
2.1 BMSCs细胞形态学
BMSCs呈长梭形,表现为典型成纤维细胞生长;培养第8~10天,细胞生长达80%以上,见图1。
图1 BMSCs细胞形态(×200)
2.2 不同研究对象BMSCs中miR-152-3p、DUSP1 mRNA表达比较
与健康人比较,激素性股骨头坏死患者BMSCs中miR-152-3p mRNA表达升高,DUSP1 mRNA表达降低(P<0.05),见表1。

表1 各组miR-152-3p、DUSP1 mRNA表达比较
2.3 转染效率
镜下观察显示,转染组转染效率91.12%,对照组转染效率89.45%,可用于后续实验,见图2。
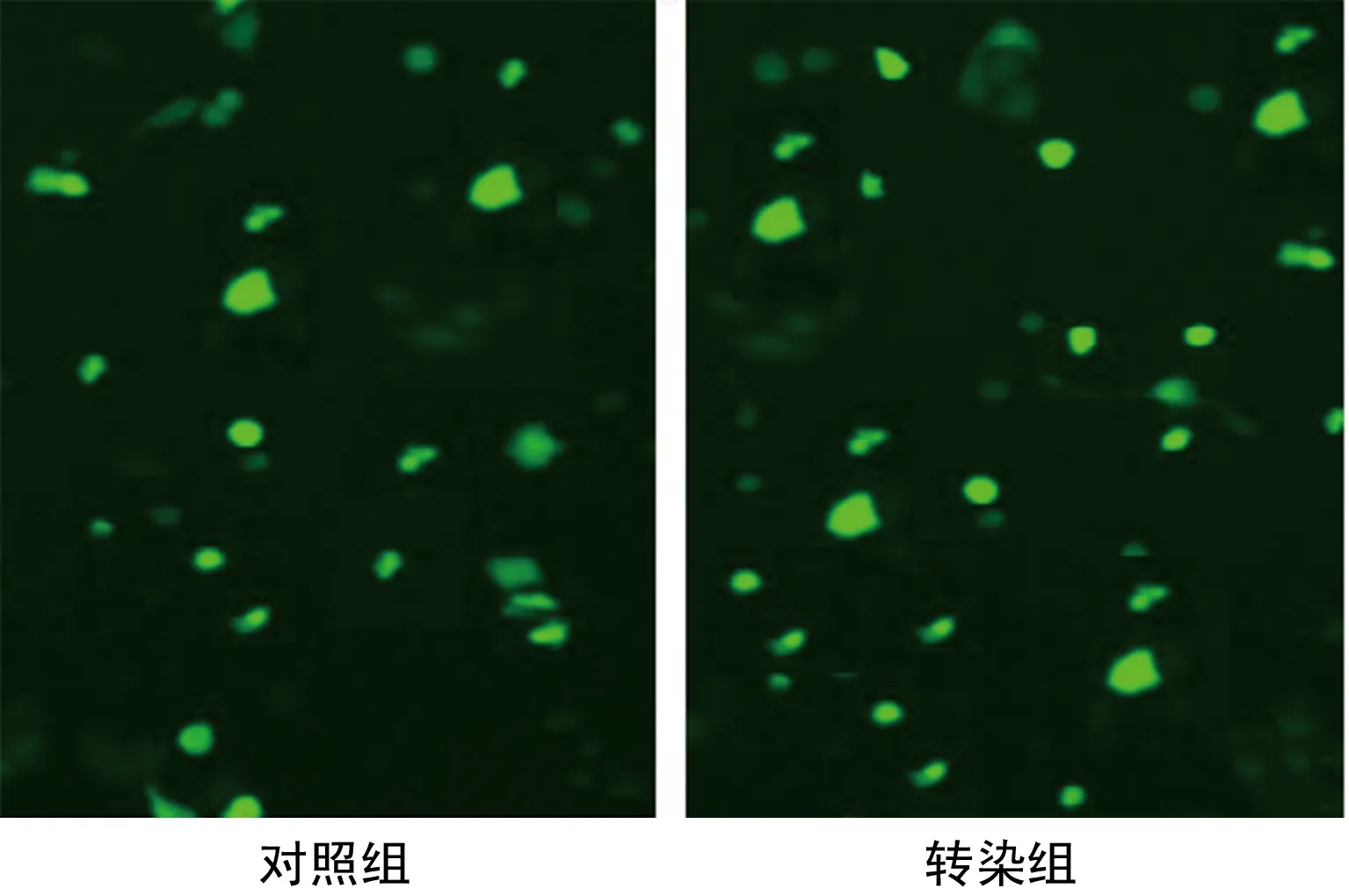
图2 BMSCs转染后显微镜下绿色荧光情况(×200)
2.4 各组细胞miR-152-3p mRNA表达比较
转染组miR-152-3p mRNA表达(0.48±0.17)与空白组(1.12±0.18)、对照组(1.13±0.21)比较,差异有统计学意义(P<0.05);空白组与对照组比较差异无统计学意义(P>0.05)。各组miR-152-3p mRNA表达比较,差异有统计学意义(P<0.05)。
2.5 各组细胞ALP、BMP-2 mRNA表达比较
各组ALP、BMP-2 mRNA表达比较,差异有统计学意义(P<0.05)。与空白组、对照组比较,转染组ALP、BMP-2 mRNA表达升高(P<0.05);空白组与对照组ALP、BMP-2 mRNA表达比较,差异无统计学意义(P>0.05),见表2。

表2 各组ALP、BMP-2 mRNA表达比较
2.6 验证结果
TargetScan软件分析发现,DUSP1 3′UTR含有miR-152-3p的结合位点,见图3。各组DUSP1 mRNA 3′UTR野生型荧光素酶报告质粒相对活性值比较,差异有统计学意义(P<0.05);各组DUSP1 mRNA 3′UTR突变型荧光素酶报告质粒相对活性值比较,差异无统计学意义(P>0.05)。与对照组和空白组比较,转染组DUSP1 mRNA 3′UTR野生型荧光素酶报告质粒相对活性值下降(P<0.001);对照组与空白组DUSP1 mRNA 3′UTR野生型荧光素酶报告质粒相对活性值比较,差异无统计学意义(P>0.05),见表3。
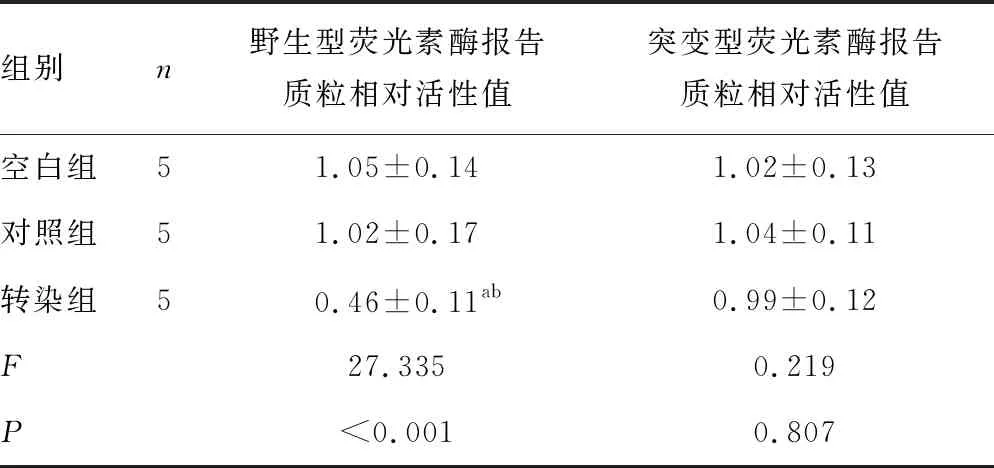
表3 双荧光素酶实验结果
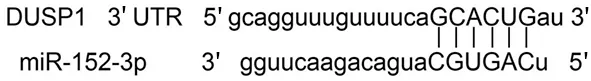
图3 miR-152-3p与DUSP1 3′UTR的结合位点预测结果
2.7 各组细胞相关蛋白表达比较
各组DUSP1、p-p38 MAPK/p38 MAPK、p-ERK1/ERK1、p-ERK2/ERK2蛋白表达比较,差异有统计学意义(P<0.05)。与空白组、对照组比较,转染组DUSP1蛋白表达升高,p-p38 MAPK/p38 MAPK、p-ERK1/ERK1、p-ERK2/ERK2蛋白表达降低(P<0.05);空白组和对照组DUSP1、p-p38 MAPK/p38 MAPK、p-ERK1/ERK1、p-ERK2/ERK2蛋白表达比较,差异无统计学意义(P>0.05),见图4、表4。

表4 各组相关蛋白表达比较
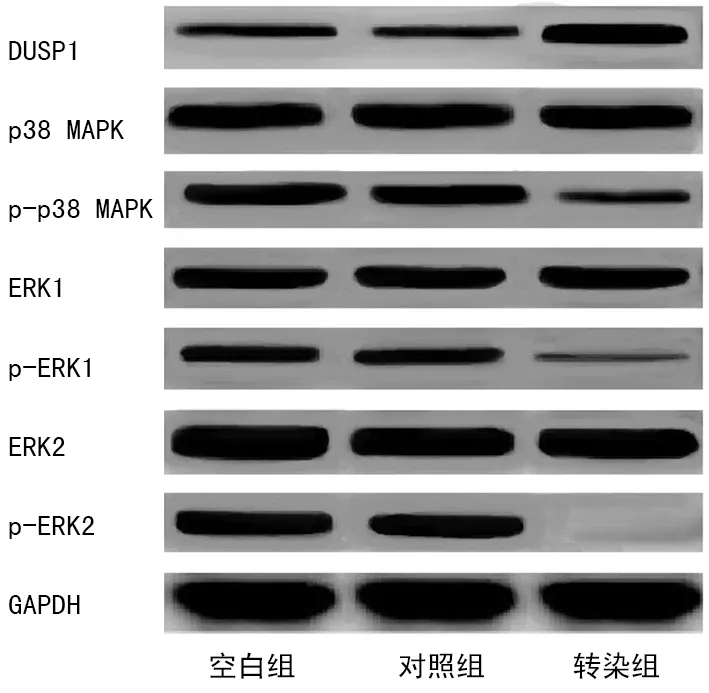
图4 各组相关蛋白蛋白印迹图
3 讨 论
激素性股骨头坏死为临床常见病、多发病,其发生、发展与激素应用剂量、疗程密切相关,目前尚无特效治疗方法[5]。BMSCs是一种多能干细胞,其自我更新及分化潜能在多种组织修复重建中发挥重要作用[6]。在较多非创伤性股骨头坏死发生中,股骨骨髓内BMSCs成骨分化能力改变发挥一定作用,逐渐引起广泛关注。研究发现[7],糖皮质激素大剂量应用可能引发BMSCs增殖、成骨能力减弱,但机制尚不明确。还有报道显示[8],激素性股骨头坏死患者存在BMSCs功能丢失现象,其近端BMSCs增殖能力较股骨颈骨折患者低。因此,临床研究影响激素性股骨头坏死患者BMSCs成骨转化的指标,以探寻新的诊断和治疗靶点,改善患者治疗效果,提升生命质量,具有重要意义。
miRNA是一类内源性非编码单链小分子RNA,可经结合靶向mRNA 3′UTR,降解mRNA转录或翻译,改变mRNA调控细胞信号通路,参与调控细胞增殖、分化、侵袭、凋亡等过程。有报道显示[9],在BMSCs增殖、分化、迁移等细胞生物学功能中,miRNA发挥一定作用,且有多种miRNA参与调控BMSCs成骨分化。miR-152-3p为miRNA家族成员之一,被证实可参与调控细胞增殖、分化、凋亡等过程,促进成骨分化,在绝经后骨质疏松发生中有一定作用,但就miR-152-3p对激素性股骨头坏死患者BMSCs分化影响尚无明确定论[10]。本研究结果显示,激素性股骨头坏死患者BMSCs中存在miR-152-3p高表达,且转染组ALP、BMP-2 mRNA表达升高,提示低表达miR-152-3p可促进激素性股骨头坏死BMSCs成骨分化。
哺乳动物细胞中氧化应激、生长因子可促使多种信号通路被激活,MAPK信号通路便是其中之一。研究发现[11],MAPK通路参与细胞增殖、凋亡、生长、分化等多种病理生理过程,其持续激活可引发细胞过度增殖或细胞非程序性死亡。DUSP1为双特异性蛋白磷酸酶家族成员之一,广泛存在于人体细胞内,可调控细胞生长、分化、凋亡及肿瘤形成过程。DUSP1属于MAPK特异性抑制剂,能抑制MAPK信号通路,减轻炎性反应、氧化应激反应,保护细胞[12]。有报道显示[13],MAPK信号通路激活可引发DUSP1 gDNA染色质重构,诱导DUSP1转录,参与细胞分化过程。但目前就DUSP1在激素性股骨头坏死BMSCs中表达研究较少,且就miR-152-3p是否通过调控DUSP1表达影响BMSCs分化、机制如何尚未可知。本研究发现,激素性股骨头坏死患者BMSCs中不仅存在miR-152-3p高表达,还存在DUSP1低表达。TargetScan软件分析发现DUSP1 3′UTR含有miR-152-3p的结合位点,荧光素酶强度显示miR-152-3p与DUSP1之间呈靶向关系,提示miR-152-3p可靶向作用于DUSP1。另外,转染组DUSP1蛋白表达升高,p-p38 MAPK/p38 MAPK、p-ERK1/ERK1、p-ERK2/ERK2蛋白表达降低,提示低表达miR-152-3p可靶向调控DUSP1表达,抑制MAPK信号通路,推测这是低表达miR-152-3p发挥促进激素性股骨头坏死BMSCs成骨分化作用的重要机制之一。但本研究未分析阻断DUSP1表达是否可产生相反作用,今后仍需就该问题进行深入研究。
综上所述,低表达miR-152-3p可促进激素性股骨头坏死BMSCs成骨分化,作用机制可能与调控DUSP1表达,抑制MAPK信号通路有关。本研究未就其他通路进行分析,而低表达miR-152-3p发挥作用是经多种途径进行的,今后仍需进一步深入分析。
