碱性蛋白酶酶解藜麦芽制备多肽工艺的研究
2022-08-06郝晓华郑凯南刘可心
郝晓华,郑凯南,刘可心
(忻州师范学院生物系,山西忻州 034300)
藜麦中完全蛋白含量达到了14%~ 22%(陈思雯,2020),而完全蛋白属于一类优质蛋白质,其所含氨基酸种类非常多,除了含有9 种必需氨基酸,还含有丰富的非必需氨基酸(李燕青等,2018)。在藜麦中最值得一提的是一般谷物中缺乏的赖氨酸含量非常高,赖氨酸可促进人体组织生长和修复(王培宇,2020)。作为必需营养元素蛋白质是不能被直接吸收的,需要经过胃肠道中多种消化酶的作用,将蛋白质分解为低分子的多肽或氨基酸后,在小肠内被吸收,沿着肝门静脉进入肝脏(邱友益,2011),并且小分子多肽与单个氨基酸相比,小分子多肽更容易被吸收(李佳,2016)。
研究表明,多肽几乎参与到人体所有的组织和细胞,从生长、发育、生殖、代谢甚至到人的情绪控制,因此将其称为传递生命信息的化学使者(尹乐斌等,2021)。小分子活性肽能促进人体激素分泌、促进吸收、调节人体免疫能力(高洋等,2017)。多肽如何通过外源性补充帮助人类预防和治疗疾病,改善生理机能,提高生命品质,是目前十分重视的课题(刘闪,2014)。张浩玉等(2020)对于酶法制备绿豆多肽的工艺取得了很好的成效,李伟民等(2020)通过寻找新型蛋白资源对于荷叶多肽的制备也有进一步的成果,李可心等(2020)通过改变藜麦培养条件,得到了制备多肽的极好条件,但是目前鲜见利用碱性蛋白酶酶解藜麦芽制备多肽工艺的报道,因此本研究利用碱性蛋白酶酶解藜麦芽制备多肽,确定藜麦多肽的最佳提取条件,为藜麦肽的制备提供理论基础(尹佳等,2020;姜东,2020;王培宇,2020)。
1 材料与方法
1.1 试验材料
1.1.1 主要仪器 培养皿、酶标仪、可见分光光度计、研钵、离心机、恒温水浴锅、电子天平、100 mL容量瓶、移液枪、玻璃棒、冰箱、电磁炉、试管、试管夹、烧杯、10 mL 量筒、锥形瓶、pH 计。
1.1.2 主要试剂 白藜麦芽、牛血清蛋白、考马斯亮蓝G-250、蒸馏水、氢氧化钠、氯化氢、碱性蛋白酶、乙醇、磷酸,以上试剂均为分析纯。
1.2 试验方法
1.2.1 酶解工艺 藜麦芽的培养:先选取50 g 颗粒均匀且饱满、完整度好的白藜麦种子,用蒸馏水清洗后置于培养皿中,加入清水使其覆盖过种子即可,等待12 h 后移至覆盖有一层滤纸和两层纱布的培养皿中继续培养等待种子发芽。
称取5 g 白藜麦芽,等分成5组,每组加入一定量的蒸馏水,研磨至粉碎获得白藜麦芽溶液,在溶液中加入氢氧化钠溶液调节溶液为碱性,室温下搅拌3 min,搅拌充分后通过添加氢氧化钠溶液或氯化氢溶液将溶液pH 微调至一个固定的pH。
在准备好的溶液中加入一定量的碱性蛋白酶,置于恒温水浴锅中,使其在恒定的温度下反应,酶解反应结束后将酶液迅速置于沸水中灭酶15 min。冷却至室温后将其在4200 r/min 下离心15 min,弃去沉淀物取上清液。
1.2.2 标准曲线的绘制 将100 mg 的牛血清蛋白溶于蒸馏水中,定容至100 mL,得1 mg/mL 的牛血清蛋白标准溶液,4 ℃下保存。取100 mg 考马斯亮蓝G-250 溶于50 mL 乙醇,加入100 mL 85%磷酸,用蒸馏水稀释至1000 mL,滤纸过滤(张浩玉等,2020)。取6 支干净干燥的试管,分别加入0、0.1、0.2、0.3、0.4、0.5、0.6 mL 和0.7 mL牛血清蛋白标准溶液,用蒸馏水补齐至1 mL,分别加入5 mL 考马斯亮蓝G-250,振荡使混合均匀,室温下反应3 min,在595 nm 处比色测定。以A595nm为纵坐标,标准蛋白含量为横坐标,在坐标轴上绘制标准曲线,利用标准曲线查出回归方程。
1.2.3 多肽含量的测定 将试验收集到的上清液定容到100 mL,摇匀后移取10 mL 溶液到离心管中,以4000 r/min 离心10 min,使上清液澄清,吸取1 mL 上清液,再加入5 mL 考马斯亮蓝G-250溶液混合,以蒸馏水为空白,室温下反应3 min,测定吸光度。根据标准曲线关系式,计算多肽含量。
1.2.4 单因素试验 在预试验的基础上,通过单因素试验研究底物浓度、酶添加量、酶解pH、酶解温度、酶解时间5 个因素对藜麦芽中多肽含量的影响。(1)在底物浓度10%、温度50 ℃、加酶量2000 U/g、pH 9.0 的条件下,分别酶解2、3、4、5、6 h,测定多肽含量。(2)在pH 9.0、温度50 ℃、加酶量2000 U/g、酶解3 h 条件下,调节底物浓度为6%、7%、8%、9%、10%,测定多肽含量。(3)在底物浓度8%、加酶量2000 U/g、pH 9.0,温度分别为40、45、50、55、60 ℃下酶解3 h,测定多肽含量。(4)在加酶量2000 U/g、底物浓度10%、酶解温度50 ℃条件下,调节pH 分别为7.0、8.0、9.0、10.0、11.0,酶解3 h,测定多肽含量。(5)在温度50 ℃、底物浓度9%、pH 9.0 的条件下,分别确定酶添加量为1000、1500、2000、2500、3000 U/g 反应3 h,测定多肽含量。
1.2.5 正交试验设计 在单因素试验的基础上,以多肽含量为指标,酶解pH、酶添加量、温度和时间为因素,设计四因素三水平的正交试验,优化制备藜麦芽多肽的最佳条件(常春等,2021)。
1.3 统计分析 采用SPSS 和Microsoft office 2010 处理和分析数据。
2 结果与分析
2.1 标准曲线 分别配制0.1、0.2、0.3、0.4、0.5、0.6、0.7 mg/mL 牛血清蛋白标准溶液,按1.2.2 的方法测定吸光度。横坐标为牛血清蛋白浓度x,纵坐标为吸光度y,制作标准曲线见图1,所得回归方程为y=0.3043x-0.0044(R2=0.9992)。
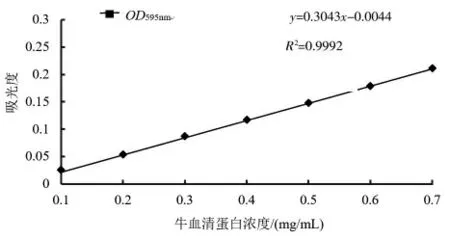
图1 牛血清蛋白标准曲线
2.2 单因素试验结果
2.2.1 酶解时间对多肽含量的影响 由图2 可知,藜麦芽多肽的含量呈现先上升后下降的趋势,随着时间的增加,多肽含量开始缓慢增加,在酶解时间为3 h 时多肽含量达到最大,随着酶解时间的继续增加,多肽含量开始下降,酶解时间6 h时,多肽含量达到最低。产生这个结果的原因可能是当碱性蛋白酶和底物刚接触时发生了快速的酶解反应,但是随酶解时间继续延长,多肽受环境影响分解增加,且随着酶解时间延长,酶活性逐渐降低,新产生的多肽少于分解的多肽,导致多肽含量整体呈下降趋势。
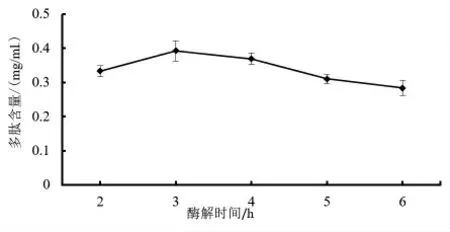
图2 酶解时间对多肽含量的影响
2.2.2 碱性蛋白酶添加量对多肽含量的影响 由图3 可知,藜麦芽多肽含量随着碱性蛋白酶添加量的增加呈现先上升后下降的趋势,随着碱性蛋白酶的增加,多肽含量增加,在酶添加量达到2000 U/g 的时候最大。可能是因为在有限的底物中酶的增加使反应充分发生,多肽含量增加。达到顶峰后多肽含量逐渐缓慢下降,可能是当酶添加量达到一定量时,在有限的底物中,继续增加酶用量不能形成更多的酶底中间复合物,而大分子之间的位阻效应形成了空间障碍抑制了酶促反应的进行,或是蛋白质的过度水解破坏了肽键使多肽含量降低。
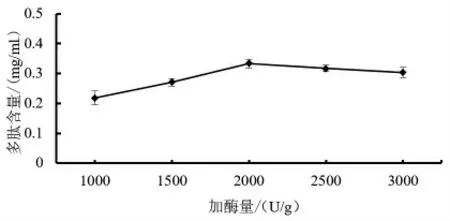
图3 酶添加量对多肽含量的影响
2.2.3 pH 对多肽含量的影响 由图4 可知,藜麦芽多肽含量随着pH 的增大依旧呈现出先增加后降低的趋势,pH 增加的同时反应速率也在增加,多肽含量也在增加,当pH 到达10.0 的时候,多肽含量达到了最大值,这是因为碱性蛋白酶促作用需要在碱性环境下进行,随着碱性的增加酶活性也达到最佳状态,而pH 较小不利于碱性蛋白酶的作用,达到峰值后随pH 的增加多肽含量开始逐渐下降,这是因为蛋白质在过酸或者过碱的环境中结构会受到很大的影响,过碱会导致酶的理化性质和内部结构发生改变,进一步使酶活性下降,从而影响酶与底物的结合,因此多肽含量会下降。
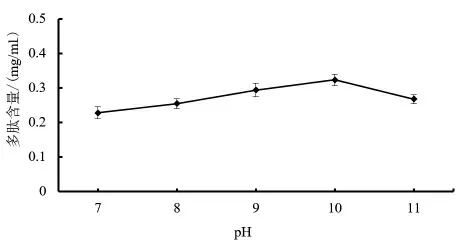
图4 pH 对多肽含量的影响
2.2.4 底物浓度对多肽含量的影响 由图5 可知,随着底物浓度的增加藜麦芽多肽含量呈现出先增后降的趋势,说明碱性蛋白酶在底物浓度较低时反应缓慢,随着底物浓度的增加多肽含量增加,底物浓度达到9%的时候,多肽含量达到了最大值,此时的酶解反应最为充分。当多肽含量达到最大值之后再继续增加底物浓度出现多肽含量降低的情况,可能是由于随着体系底物蛋白浓度的增加,水解体系中多肽浓度随之增加,多肽类产物对蛋白酶的反馈抑制作用增强,从而导致水解体系中有效酶活降低。
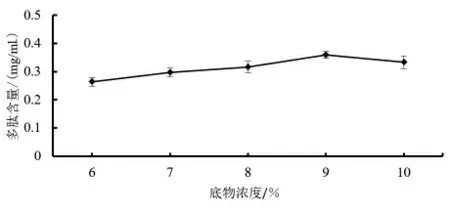
图5 底物浓度对多肽含量的影响
2.2.5 酶解温度对多肽含量的影响 由图6 可知,随着酶解温度的不断升高,多肽含量出现了先增加后减少的趋势。在40 ℃的时候含量最低,达到50 ℃后多肽含量达到了最大值,继续升高温度多肽含量开始缓慢下降。这原因可能是温度较低或较高会抑制酶的活性导致一部分酶失活影响了酶催化效率,每一种酶都有最适温度,达到最适温度时酶促反应速率最快。所以50 ℃就是碱性蛋白酶酶解藜麦芽制备多肽的最适温度。
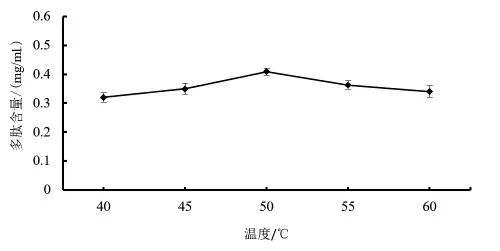
图6 温度对多肽含量的影响
2.3 正交试验优化酶解制备工艺 通过对各个单因素试验结果的分析,固定底物浓度为9%,选用酶解时间(A)、酶解温度(B)、酶解pH(C)、酶添加量(D)为自变量,多肽含量为响应值,如表1 采用四因素三水平的正交试验进行优化。在表2中,通过对极差R 的分析,极差R 越大表明影响越大,得出影响制备藜麦芽多肽含量的各个因素主次顺序为D>A>B>C。因此,酶添加量是对制备多肽影响最大的因素,酶解pH 是对制备多肽影响最小的因素。从正交试验结果得出酶解制备多肽的最佳提取方案为A1B2C2D2。

表1 正交试验因素水平
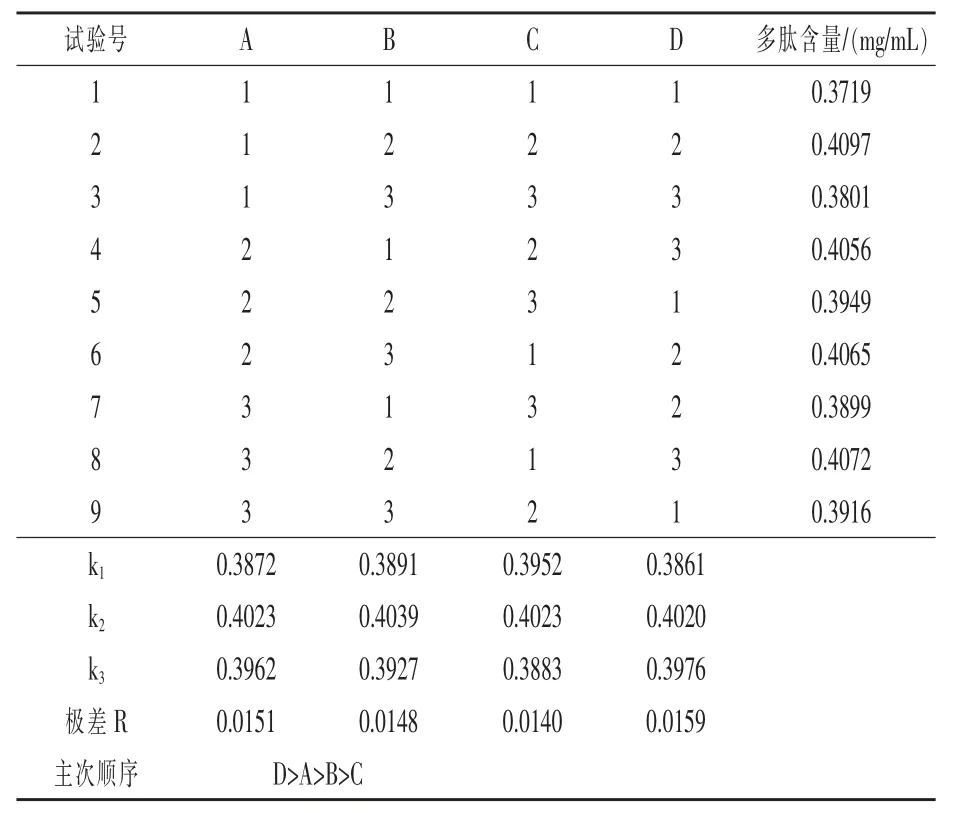
表2 正交试验结果
2.4 验证试验 如表3 所示,为验证正交试验所得的结果具有可行性,在上述最佳制备条件下进行3 次平行重复试验并测定藜麦芽中制备出来的多肽含量。经验证,藜麦芽中制备出来的多肽含量为(0.4105±0.0021)mg/mL,大于正交试验分析所得的最大值,表明该制备工艺合理可行。

表3 多肽含量验证试验结果mg/mL
3 结论
本试验结果表明,各单因素对多肽提取率影响的主次顺序为:酶添加量,酶解时间,酶解温度,酶解pH。结合正交试验优化碱性蛋白酶酶解法制备藜麦芽多肽的最优工艺条件为:酶添加量2000 U/g,酶解温度50 ℃,酶解时间3 h,酶解pH 10.0,底物浓度9%。在此条件下多肽含量达到了(0.4105±0.0021)mg/mL。表明该制备工艺稳定、可行。
