亚麻籽胶浓度对大豆分离蛋白功能特性的影响
2022-08-06赵荣敏
赵荣敏
(石家庄职业技术学院食品与药品工程系,河北石家庄 050081)
大豆分离蛋白(SPI)是大豆中重要的营养成分之一,在实际生产中具有广泛的应用(Wang等,2017)。SPI 本身具有比较高的乳化活性和抗氧化能力,在一定程度上可以用于改善乳状液的稳定性。然而,由于加热温度、酸碱度以及离子强度等因素,SPI 的稳定性受到影响(Wang等,2019)。水包油乳状液通常是一种热力学不稳定的多相体系,容易产生聚集、聚结以及絮凝等现象,因此通常可以通过添加稳定剂,例如两亲性聚合物和固体颗粒等,避免油相和水相之间发生相分离。
多糖是广泛应用于许多食品胶体和乳剂配方的功能性成分,为天然聚合物。由于其与蛋白可以产生纳米或微观结构(聚集和凝胶),因此通常可以改变食品胶体的流变性能,影响食品产品的纹理和稳定性(Porfiri 和Wagner,2018)。作为一种天然的阴离子多糖,亚麻籽胶(FG)是从亚麻籽或壳中提取出来的一种优质物质。因其良好的亲水效果对食品工业存在巨大应用潜力。研究发现,加入FG,在较高的pH 条件下,可以降低凝胶形成速度,有助于形成致密的三维凝胶网络结构,同时提高凝胶强度,在研究FG 吸附在乳清蛋白表面的电位变化时发现,FG 含负电荷的多糖部分与蛋白质发生相互作用,主要通过影响两者之间的静电相互作用来维持乳液的稳定性(Khalloufi等,2009)。目前,主要是通过油水界面层的吸附动力学和膨胀黏弹性特性来研究蛋白质与多糖之间的相互作用。然而,SPI/FG 溶液在不同多糖浓度下的交联聚集与乳液乳化性之间的关系尚不清楚。本研究的目的是评估FG 浓度对SPI/FG 溶液交联聚集及其乳状液稳定性的影响。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂 大豆油,购于河南荥阳阳光油脂集团有限公司。FG 为国产食品级,购于新疆绿旗企业有限公司。SPI,购自北京奥博克生物科技有限公司,其蛋白质含量为85%,水分含量为7%,灰分含量为3.2%。其他试剂均为分析纯。
1.1.2 主要仪器设备 FE20 pH计,梅特勒-托利仪器(上海)有限公司;AH-PILOT 型均质机,安拓思纳米有限公司;L9 紫外-可见光分光光度计,上海仪电分析仪器有限公司;Nano ZS-90 zeta 电位仪,英国马尔文公司;BT-9300Z 激光粒度分布仪,深圳市力达信仪器有限公司。
1.2 试验方法
1.2.1 SPI/FG 溶液的制备 溶液的制备参考Liu等(2013)的方法,并进行适当修改。在25 ℃下配制0.5%的SPI 溶液,4 ℃保存12 h 以上,以确保完全溶解。然后添加浓度为0%、0.1%、0.2%、0.3%、0.4%的FG,将SPI/FG 溶液混合搅拌30 min,用0.01 M NaOH 调节pH 至7.0,4 ℃保存过夜。
1.2.2 SPI/FG 溶液总巯基和二硫键的测定 总巯基含量的测定依据Simplicio 等(1991)的方法:取1 mL 混合溶液加入8 mL 的Tris-甘氨酸,均质后10000 r/min 离心15 min(4 ℃)。取上清液4.5 mL 加入0.5 mL 10 mM Ellman's 试剂,并以含有4.5mL Tris-甘氨酸和0.5 mL 10 mM Ellman's 试剂作为对照,避光反应30 min后,于412 nm 处利用紫外分光光度计测量吸光值。巯基含量的计算采用13600 M/cm 的摩尔吸光系数进行表示,蛋白含量使用双缩脲法测定。
二硫键的测定参考Pérez-mateos 等(1997)方法略作修改:取样品2 g,分别与10 mL 的0.6 mol/L NaCl+8 mol/L 尿素(SD)(原子比3:40)和0.5 mol/L β-巯基乙醇、0.6 mol/L NaCl 和8 mol/L 尿素混合,pH 值调至7.0(SE)。混合并均质,4 ℃静置1 h,10000 r/min 离心15 min。用SE 溶液中蛋白含量与SD 溶液中蛋白质含量之间表示二硫键含量。
1.2.3 乳液的制备 为了制备水包油乳液,将SPI溶液和FG(0%~0.4%)的样品溶解在0.01 mol/L磷酸盐溶液中(pH 7.0),室温下500 r/min 搅拌3 h。然后与大豆油按照9:1 的质量比进行混合,于15000 r/min 下均质2 min,得到待测乳液。
1.2.4 乳化活性(EAI)和乳化稳定性(ESI)的测定 将制备好的乳液立即从距离管底部0.5 cm处取50 μL 新鲜乳状液加入至含5 mL 0.1% SDS溶液的试管中,振荡混匀后在500 nm 处测定吸光值记作A0,取均质10 min 后的乳状液重复上述步骤记作A10。EAI(m2/g)及ESI(%)由以下公式计算得出:
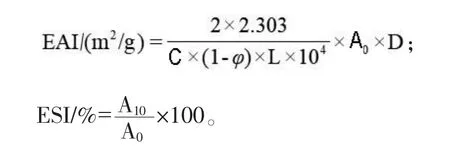
式中:2 为2 倍;2.303 为换算系数;C 为蛋白浓度;φ 为乳状液中油相的体积分数(V/V,本试验的油相体积分数为0.2);L 为比色皿光径(本试验选用光径为1 cm 的比色皿);D 为稀释倍数(本试验的稀释倍数为100);A0、A10分别为乳状液0 min和10 min 时在500 nm 处的吸光值。
1.2.5 乳液粒径的测定 调整蛋白质浓度为10 mg/mL 并进行测定。利用激光粒度仪测定乳液粒径的大小。测定具体参数设置如下:物质折射率为1.520,介质为水,介质折射率为1.333。
1.2.6 乳液Zeta 电位的测定 将待测样品放入样品池,采用Zeta 电位仪进行电位测试,以评估静电相互作用。测试参数为散射角90°,平衡时间60 s,测试温度25 ℃。
1.2.7 乳液光学显微镜的测定 从底部吸取新鲜乳液200 μL 置于载玻片上,选择光学显微镜观察,用4×镜头寻找视野,后于10×镜头下进行微观结构的观察。
2 结果分析
2.1 不同浓度FG 对SPI/FG 溶液总巯基的影响SPI 富含巯基,极易被外界自由基攻击并转化为分子间或分子内二硫键,导致蛋白质交联聚集。如图1 所示,与对照组相比,FG 添加可以显著降低巯基的含量(P <0.05),说明FG 的添加对SPI 结构的展开具有显著的抑制作用。而且,FG 为0.2%时巯基含量达到最低(P <0.05),原因可能是FG带负电荷的羧基与SPI 中的巯基基团相互作用,导致SPI/FG 溶液中巯基含量降低。然而,较高的FG 浓度(0.3%和0.4%)则又增加巯基的含量(P >0.05)。这可能是因为较高浓度的FG 促进了蛋白质链的展开,致使巯基含量呈现上升的趋势。
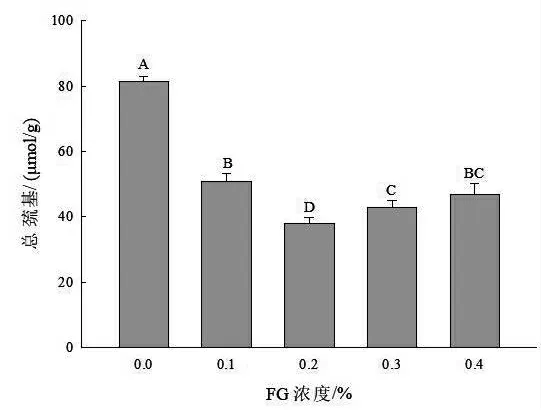
图1 不同浓度FG 对SPI/FG 溶液总巯基的影响
2.2 不同浓度FG 对SPI/FG 溶液二硫键的影响 二硫键的变化通常可以用来表征蛋白质交联的情况,从而可以得出蛋白质结构发生改变。图2 所示的是不同浓度FG 对SPI 二硫键含量的影响。当FG 浓度为0%~ 0.2%时,二硫键含量显著增加(P <0.05),这可能是由于FG 的添加可以增强体系间的疏水相互作用,使得蛋白分子间发生聚集,同时巯基之间彼此靠近,发生-SH/S-S 间交换反应,形成二硫键(Yongsawatdigul 和Sinsuwan,2007)。而在FG 含量为0.3%和0.4%时,二硫键含量均显著降低(P <0.05),这可能是因为在较高的FG 浓度下,FG 可以与大部分蛋白质发生一定的相互作用,因此蛋白质之间的巯基不能发生相互作用而产生二硫键,从而降低二硫键的含量。
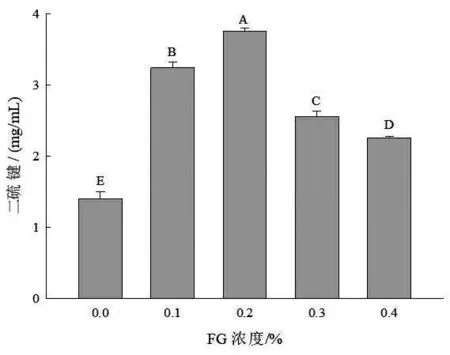
图2 不同浓度FG 对SPI/FG 溶液二硫键的影响
2.3 不同浓度FG 对SPI/FG 乳液EAI 和ESI 的影响 从表1 中可以看出,随着FG 浓度的增加,乳液EAI 显著增强(P <0.05)。这可能是FG 对乳液中的脂肪颗粒产生了很好的包裹作用并且阻止了脂肪颗粒之间的聚集。另一方面,FG 有良好的乳化性,能促进蛋白质和脂肪间的相互作用,形成稳定性良好的乳液。而且,FG 的添加有效的改善了乳液的乳化稳定性,FG 浓度为0.2%时效果更好。可能是因为FG 的添加增强了乳液的静电斥力,使更多的蛋白质聚集在油滴周围,可以抑制颗粒聚集(Liu等,2018),增强稳定性,另一个原因可能是FG 的添加增强了乳液的黏度,改变油滴的添加比例,使稳定性增强。从表中可以看出,低浓度的FG 使乳液稳定性增强,较高浓度的FG 则降低了乳液的稳定性。在添加量为0.4%时乳液稳定性最差。这可能是因为低浓度的FG 吸附在油滴表面,填充界面缝隙,增强了乳液的稳定性,而随着FG 浓度的增加,蛋白质开始与游离出来的FG 发生反应发生聚集,乳液变得不稳定。
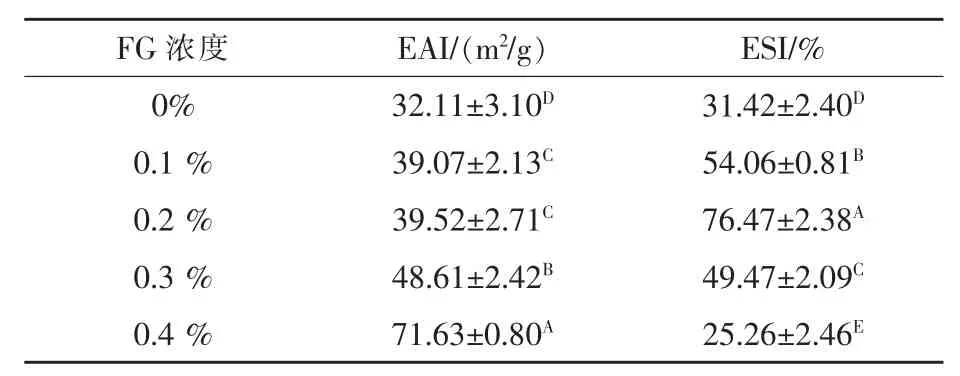
表1 不同浓度FG 对SPI/FG 乳液EAI 和ESI 的影响
2.4 不同浓度FG 对SPI/FG 乳液平均粒径的影响 蛋白质粒径的大小与蛋白质的水合特性有密切联系,直接影响着SPI 的加工品质。图3 表示为不同浓度下FG 对SPI 平均粒径的影响。从图中可以看出,随着FG 浓度的增加,SPI/FG 乳液体系的平均粒径呈下降的趋势。原因可能是适量的FG可以与SPI 发生相互作用,阻止了蛋白质和蛋白质之间的交联聚集,蛋白粒径较小。而在较高的FG 浓度下(0.3%和0.4%),SPI 的粒径显著增大(P <0.05)。通常SPI 粒度增大的主要原因是蛋白氧化以及二硫键水平的增加,与上文二硫键结果一致。但此处粒度增大还可能是因为SPI-FG 之间发生吸附作用而产生聚集,使蛋白质粒径变大。综上,在FG 浓度为0.2%时,体系粒径较小。
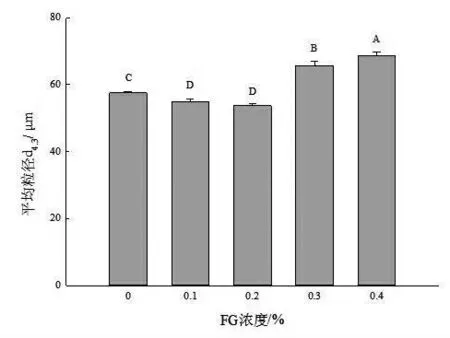
图3 不同浓度FG 对SPI/FG 乳液平均粒径的影响
2.5 不同浓度FG 对SPI/FG 乳液Zeta 电位的影响 Zeta 电位的测量可以用来描述胶体颗粒之间的静电相互作用。静电相互作用在蛋白交联聚集过程中表现斥力,蛋白质分子中几乎所有的带电基团都分布在蛋白质分子表面,Zeta 电位如果是负值,表明蛋白质呈负电荷。如图4 所示,随着FG浓度的增加,Zeta 电位的绝对值逐渐增加(P <0.05),表明蛋白质所带负电荷逐渐增加,蛋白质展开程度增加。这可能是因为FG 与SPI 发生相互作用使蛋白质结构展开,内部疏水基团暴露,这与本文表面疏水性结论一致。然而,随着FG 浓度的继续增加,Zeta 电位的绝对值又逐渐降低。此时可能是因为FG 浓度过大,导致于SPI 的负电荷不均衡,发生了静电斥力,反而促进了蛋白质之间发生聚集,导致表面电荷量反而降低。
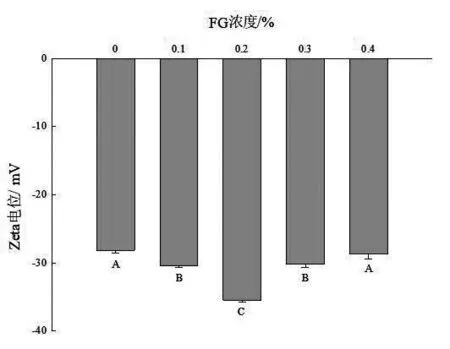
图4 不同浓度FG 对SPI/FG 乳液Zeta 电位的影响
2.6 不同浓度FG 对SPI/FG 乳液光学显微镜的影响 显微观察可以进一步显示乳液的液滴大小以及乳液聚集或絮凝的情况。图5 展示了添加不同浓度FG后,SPI/FG 乳液光学显微镜的变化。从图中可以看出,添加FG 使所有处理组液滴变得致密且均一,液滴直径均比对照组小。并随着FG 浓度的增加,液滴直径先显著减小后又略微增大,且在FG浓度为0.2%时液滴直径最小。这可能是因为FG 浓度为0.2%时,油滴被完全包裹并均匀分布以形成稳定的乳液;在FG 浓度增加至0.3%和0.4%时,液滴直径略微增大。说明高浓度的FG 会导致乳液发生絮凝。并且光学显微镜结果与粒径结果一致。

图5 不同浓度FG 对SPI/FG 乳液光学显微镜的影响
3 结论
适当浓度的FG 可以抑制蛋白之间的交联聚集并提高乳液的乳化特性。加入FG后,SPI 巯基含量先降低后增加,二硫键含量与之相反。在浓度为0%~0.2%时SH 能抑制蛋白质的展开,削弱蛋白质-水相互作用,并形成均匀一致的乳液,且在浓度为0.2%时效果最显著;但是,在浓度为0.3%和0.4%时,这些特性有所削弱。因此,适当控制FG 的浓度,可以得到乳化效果较好的SPI/FG 乳液。
