代谢改造黑曲霉合成乙酰氨基葡萄糖
2022-08-05张小茹闫荣媚曹威刘浩
张小茹,闫荣媚,曹威,3,刘浩,3*
(1.天津科技大学生物工程学院,天津 300457;2.天津市工业微生物重点实验室工业发酵微生物教育部重点实验室,天津 300457;3.代谢控制发酵技术国家地方联合工程实验室,天津 300457)
N-乙酰氨基葡萄糖(N-acetylglucosamine,Glc-NAc)是一种重要的功能性单糖[1]。作为生物体内透明质酸、肝素等重要生物大分子的结构单元之一,在生物体多项生理功能中发挥重要作用[2]。另外,GlcNAc在微生物中广泛存在,是几丁质和壳聚糖的主要成分之一[3-4]。近年来,GlcNAc被广泛应用于保健食品、医药、精细化工等众多领域,展现出极大的市场潜力和经济价值[1,4]。
目前生产GlcNAc的方法可分为3种:化学合成法、酶催化法和微生物发酵法[5-7]。化学合成法是氨基葡萄糖盐酸盐-乙酸银-无水甲醇-乙酸酐法,该方法反应时间长,反应过程中需要加热沸腾,同时催化剂乙酸银的使用使得生产成本高[8]。酶催化法是综合利用多种几丁质酶分解甲壳素获取GlcNAc[9]。然而,甲壳素原料供给不稳定,而且易诱发免疫反应,因此酶催化法应用受到限制[10-11]。微生物发酵法是对微生物进行遗传改造,以葡萄糖为底物直接发酵生产GlcNAc。由于底物来源广泛,发酵条件温和,产品无过敏反应等优点,受到越来越多的关注[12-14]。目前,主要对大肠杆菌、枯草芽孢杆菌和谷氨酸棒杆菌等细菌进行遗传工程改造用以生产GlcNAc。遗传改造的方法包括增加酶活性、增强合成途径中关键基因的表达,减少产物抑制等。Deng等[15]以大肠杆菌为底盘细胞,通过过表达GlcN6P乙酰转移酶、GlcN6P合成酶和GlcN1P乙酰基转移酶,弱化表达GlcN6P和GlcNAc1P尿苷酰转移酶增加GlcNAc的碳流通量。由于葡萄糖是GlcNAc的主要底物,在发酵过程中补充果糖以保持菌体生长,最终发酵60 h,GlcNAc的最终浓度达到120 g/L。由于安全性问题,越来越多的研究集中于食品安全菌株的遗传工程改造。王雅婷[16]以谷氨酸棒杆菌ATCC13032为底盘细胞,通过增强GlcNAc的合成途径、弱化降解途径、消除主要副产物乳酸的合成使GlcNAc的合成水平达到2.23 g/L。Niu等[17-18]以枯草芽孢杆菌BSGN6(N6)为研究对象,通过平衡GlcNAc合成代谢与其他碳源代谢、增强合成代谢和GlcNAc6P外泌水平,在30 L发酵罐中进行补料分批发酵,GlcNAc的浓度达到87.5 g/L。
黑曲霉是一种食品安全菌株,遗传背景清晰且具有很高的碳源转化效率,被广泛应用于有机酸和酶制剂的生产[19-20]。另外,发酵工业中产生的大量黑曲霉菌丝体的资源化利用受到越来越多研究人员的重视。本研究以黑曲霉ATCC 1015(编号:S469[19])为底盘细胞,通过深入分析黑曲霉中GlcNAc合成代谢途径,强化GlcNAc合成途径、阻断降解代谢、增加外泌水平、弱化支路代谢等手段,提高GlcNAc积累水平,为工业化黑曲霉发酵生产GlcNAc提供参考。
1 材料与方法
1.1 试验材料
1.1.1 质粒、菌株和引物
本文所用的菌株、质粒见表1和表2,本试验所用的聚合酶链式反应(polymerase chain reaction,PCR)引物见表3。引物合成和DNA测序等由北京六合华大基因科技有限公司完成。

表1 本研究所用菌株Table 1 Strain used in this study

表2 本研究所用质粒Table 2 Plasmids used in this study
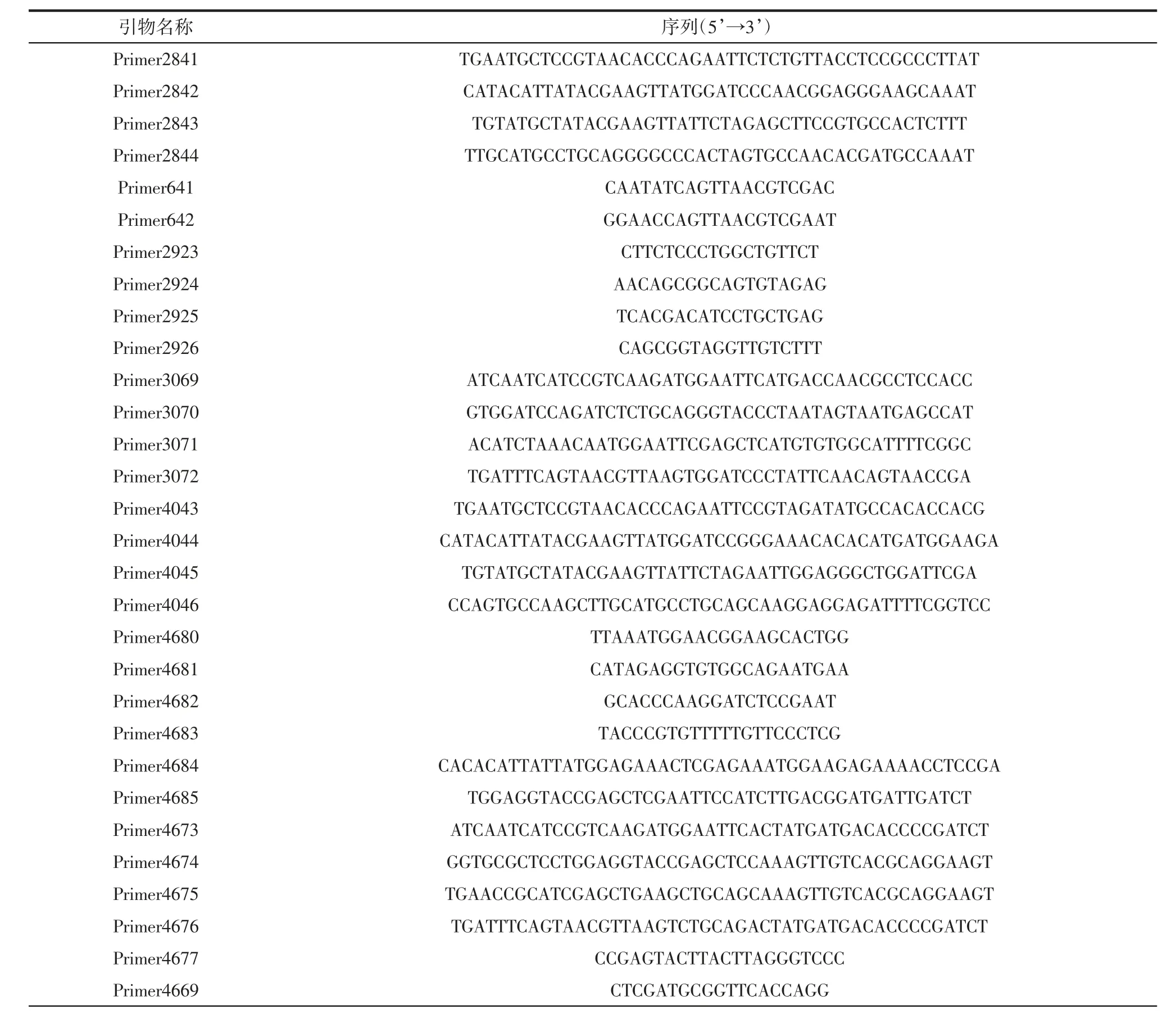
表3 本研究所用引物Table 3 Primer used in this study

续表3 本研究所用引物Continue table 3 Primer used in this study
1.1.2 培养基及试剂
LB培养基:氯化钠10 g/L、胰蛋白胨10 g/L、酵母浸出物5 g/L。LB固体培养基另加15%琼脂粉。
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)培养基:切成小块的去皮马铃薯1 kg,加入适量的蒸馏水煮沸约30 min,纱布过滤,取清液。加入100 g葡萄糖完全溶解,PDA固体培养基另加15%琼脂粉。
真菌生长完全培养基(complete medium,CM):葡萄糖10 g/L、硫酸镁0.5 g/L、酪蛋白水解物1 g/L、酵母浸出物5 g/L、CM微量元素母液1 mL/L、钠钾混合物母液20mL/L。其中CM微量元素母液:七水硫酸锌21 g/L、硼酸11 g/L、四水氯化锰5 g/L、七水硫酸亚铁5 g/L、六水氯化钴1.7 g/L、五水硫酸铜1.6 g/L、二水钼酸钠1.5 g/L、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)51 g/L;ASP+N 母液:硝酸钠 297.5 g/L、氯化钾26.1 g/L、磷酸二氢钾74.8 g/L,调节pH值为5.5。CM固体培养基另加15%琼脂粉。根据需要添加潮霉素250 μg/mL、氨苄青霉素 100 μg/mL、链霉素 100 μg/mL、头孢噻肟钠 100 μg/mL。
农杆菌诱导真菌培养基(induction medium,IM):葡萄糖2 g/L、七水硫酸镁0.6 g/L、二水氯化钙0.1 g/L、氯化钠0.3 g/L、七水硫酸亚铁1 mg/L、硝酸铵0.5 g/L、甘油5 mL/L、IM微量元素母液5 mL/L、pH值为4.8的磷酸钾缓冲液0.8 mL/L、pH值为5.5的吗啉乙磺酸[2-(N-morpholino)ethanesulfonic acid,MES]母液(浓度为1 mol/L)40 mL/L。其中IM微量元素母液:七水硫酸锌0.1 g/L、五水硫酸铜0.1 g/L、硼酸0.1 g/L、一水硫酸锰0.1 g/L、二水钼酸钠0.1 g/L。IM固体培养基中葡萄糖1 g/L、15%琼脂粉。根据需要添加卡那霉素100 μg/mL、乙酰丁香酮0.2 mol/L。
黑曲霉液体培养基:七水硫酸镁1 g/L、葡萄糖20 g/L、磷酸二氢钾1 g/L、酵母浸出物10 g/L,调节pH值为4.0。
基本培养基(minimal medium,MM):蔗糖 15 g/L、Vogel's Salts溶液20 mL/L。其中Vogel's Salts溶液:二水合柠檬酸钠3 g/L、磷酸二氢钾5 g/L、硝酸铵2 g/L、七水硫酸镁0.2 g/L、二水氯化钙0.1 g/L、MM微量元素溶液 100 μL/L、0.1 g/L 的生物素母液 50 μL/L。MM 微量元素溶液:六水硫酸亚铁铵10 g/L、七水硫酸锌50 g/L、五水硫酸铜2.5 g/L、一水硫酸锰0.5 g/L、一水柠檬酸50 g/L、硼酸0.5 g/L、二水钼酸钠0.5 g/L。MM固体培养基另加15%琼脂粉。根据需要补加多西环素10 μg/mL。
发酵培养基:葡萄糖100 g/L、酵母浸出物10 g/L、磷酸二氢钾1 g/L、七水硫酸镁1 g/L、胰蛋白胨9 g/L。
潮霉素:上海生工生物工程股份有限公司;氨苄青霉素、卡那霉素、链霉素、头孢噻肟钠:北京solarbio公司;酵母浸出物、胰蛋白胨:英国OXOID公司;其他试剂均为国产分析纯。DNA回收、纯化试剂盒、质粒提取试剂盒:北京天根生化科技有限公司;限制性内切酶:大连TaKaRa公司;Phanta Max高保真酶:北京全式金生物技术有限公司;PrimeSTAR HS(Premix)高保真酶:北京宝日医生物技术有限公司;ClonExpress II One Step Cloning Kit:南京诺唯赞生物科技有限公司;PCR引物及质粒测序由华大基因股份有限公司合成。
1.2 试验方法
1.2.1 ngtA基因敲除质粒构建方法
以A.niger ATCC 1015基因组为模板,设计引物Primer2841、Primer2842(分别带有 EcoR I和 BamH I酶切位点)和引物Primer2843、Primer2844(分别带有Xba I和Spe I酶切位点)聚合酶链式反应扩增ngtA基因上下游片段,依次连接至pLH594中,获得ngtA基因敲除质粒pLH813。
1.2.2 基因表达重组质粒构建方法
来源于E.coli K12的yqaB基因序列经密码子优化后由苏州金唯智生物科技有限公司合成[21],连接至经EcoR I和BamH I酶切的pLH454中,获得yqaB表达质粒pLH826。引物Primer3069和Primer3070扩增gnaA基因片段,连接至经EcoR I和Kpn I酶切的pLH509中,获得gnaA表达质粒pLH896。引物Primer3071和Primer3072扩增gfaA基因片段,连接至经Sac I和BamH I酶切的pLH454中,获得gfaA表达质粒pLH897。
1.2.3 RNA干扰质粒构建方法
以A.niger ATCC 1015 cDNA为模板,设计引物Primer4043、Primer4044(分别带有 EcoR I和 Sac I酶切位点)和引物Primer4045、Primer4046(分别带有Pst I酶切位点)PCR扩增nagB正义链和反义链片段,依次连接至pLH1453中,获得nagB弱化质粒pLH1216。nagA弱化质粒pLH1454和pfkA弱化质粒pLH1546与pLH1216的构建过程相似。扩增获得nagA正义链和反义链的引物为Primer4686/Primer4687和Primer4688/Primer4689。扩增获得pfkA正义链和反义链的引物为Primer4673/Primer4674和Primer4675/Primer4676。
1.2.4 黑曲霉转化方法
农杆菌介导的黑曲霉转化方法参照Xu等[19]和Chen等[22]的方法,将1.2.1~1.2.3获得的重组质粒电转至农杆菌AGL-1感受态细胞中。黑曲霉孢子液与农杆菌菌液共培养于IM固体培养基(含100 μg/mL卡那霉素、0.2 μmol/L乙酰丁香酮)上,25℃培养箱正置培养3 d。3 d后将菌体转移到CM固体培养基(含100 μg/mL 氨苄青霉素、80 μg/mL 链霉素、80 μg/mL 头孢噻肟钠、250 μg/mL潮霉素B)上,使用涂布器涂抹均匀。28℃培养箱中正置培养3 d~5 d,待转化子长出后进行基因组验证。
1.2.5 hgh筛选标记基因的消除
将1.2.1~1.2.3重组菌株的孢子液稀释至300个孢子涂布于含有10 μg/mL多西环素的MM培养基上。在28℃条件下培养5 d~7 d,挑取重组子分别接种于PDA和含有250 μg/mL潮霉素B的PDA平板上,选择潮霉素B敏感的重组子进行PCR检测,获得阳性重组子。
1.2.6 摇瓶发酵及发酵罐分批发酵方法
摇瓶发酵:将菌株接种在PDA平板上,28℃培养3 d~4 d,以2×106个孢子的接种量接种于装有50 mL发酵培养基的250 mL锥形瓶中,然后置于28℃、200 r/min振荡培养5 d。
黑曲霉分批发酵:将2×106个孢子的孢子悬液接种于装有50 mL发酵培养基的250 mL锥形瓶中,置于28℃、200 r/min的摇床中振荡培养20 h,然后转接到2 L发酵罐中进行分批发酵。发酵罐初始装液量为1.26 L,葡萄糖初始浓度为100 g/L,发酵温度28℃、通气量1 vvm、转速为300 r/min。
1.2.7 样品处理及高效液相色谱法测定方法
样品处理方法:发酵液经12 000 r/min离心15 min后,取适量上清液用超纯水稀释,稀释液经0.22 μm滤膜过滤后进行高效液相色谱法(high performance liquid chromatography,HPLC)分析。GlcNAc经HPLC分析条件:检测器为示差折光检测器(refractive index detector,RID);色谱柱为伯乐 Aminex HPX-87H(300 mm×7.8 mm),柱温为40℃,检测器温度为35℃;流动相为5 mmol/L 硫酸;流速为 0.5 mL/min;进样体积为 10 μL。
2 结果与分析
2.1 GlcNAc合成途径的构建
通过对基因组信息的挖掘,黑曲霉可以合成乙酰氨基葡萄糖-6-磷酸(GlcNAc6P):葡萄糖依次在己糖激酶和磷酸己糖异构酶作用下生成果糖-6-磷酸(F6P),随后谷氨酰胺作为氨基供体,在氨基葡萄糖-6-磷酸合成酶(GfaA)的催化下合成氨基葡萄糖-6-磷酸(GlcN6P),然后乙酰CoA提供乙酰基,在氨基葡萄糖-6-磷酸乙酰转移酶(GnaA)作用下生成GlcNAc6P。由于野生型黑曲霉中不存在乙酰氨基葡萄糖-6-磷酸磷酸酶,因此无法合成GlcNAc。因此本研究中采取的代谢改造策略如图1所示。
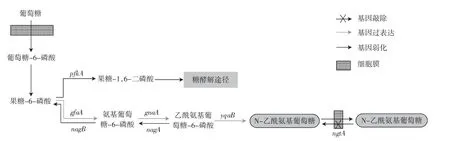
图1 黑曲霉中合成N-乙酰氨基葡萄糖代谢途径改造策略Fig.1 Metabolic engineering for the synthesis of GlcNAc in Aspergillus niger
以黑曲霉S469为出发菌株,首先将黑曲霉中Glc NAc特异性转运蛋白ngtA编码基因敲除,获得GlcNAc的吸收利用缺陷型菌株S1379(ΔngtA),从而有利于胞外GlcNAc的积累。为了实现GlcNAc在黑曲霉中的合成,本研究克隆了来源于大肠杆菌卤酸脱卤酶样磷酸酶编码基因yqaB,结果见图2。

图2 异源表达合成反应基因yqaB对GlcNAc产量的影响Fig.2 Effects of heterologous expression of yqaB on GlcNAc production
通过构建yqaB表达盒,实现yqaB在黑曲霉中的异源表达(图2A),获得重组黑曲霉菌株S1552(ΔngtA,OEyqaB)。发酵分析表明,在S1552的发酵液中成功检测到GlcNAc(图2B)。发酵3 d和5 d时,GlcNAc浓度分别为1.15 g/L和1.78 g/L(图2C)。由此,成功在黑曲霉中构建了GlcNAc合成途径。
为进一步提高GlcNAc的合成水平,通过过表达gnaA和gfaA两个基因强化GlcNAc合成,结果见图3。
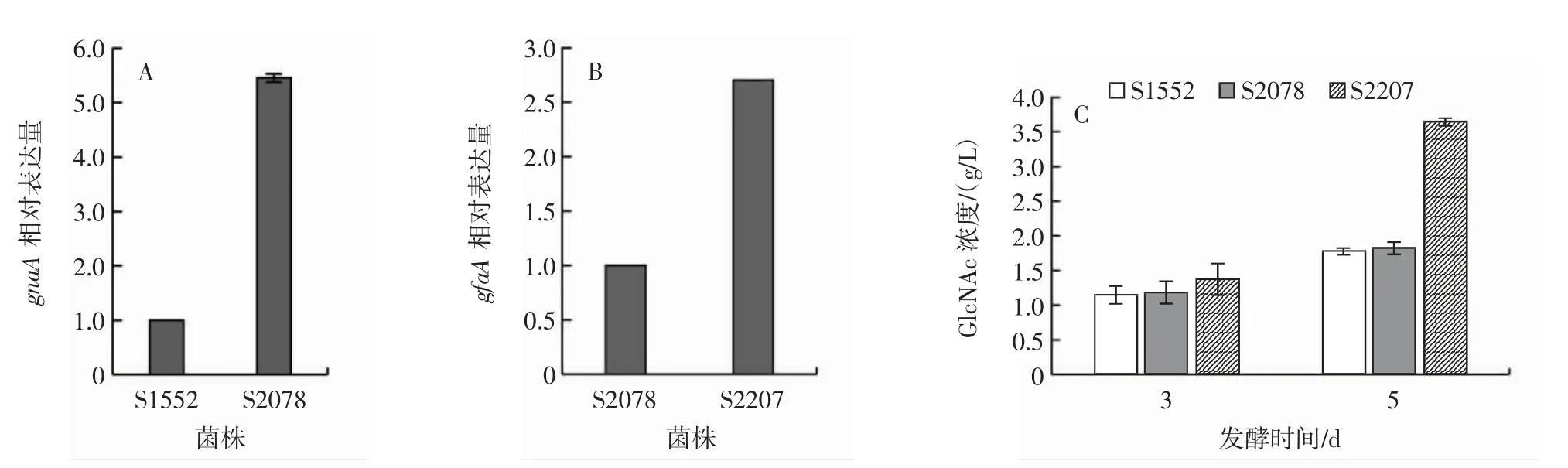
图3 强化合成途径关键基因表达对GlcNAc产量的影响Fig.3 Effect of enhanced key gene expressions of synthetic pathway on GlcNAc production
在菌株S1552(ΔngtA,OEyqaB)基础上依次过表达 gnaA(图3A)和 gfaA(图3B),获得 GlcNAc合成菌株 S2078(ΔngtA,OEyqaB,OEgnaA)和 S2207(ΔngtA,OEyqaB,OEgnaA,OEgfaA)。发酵分析表明,S2078和S2207发酵5 d后,GlcNAc浓度分别为1.83 g/L和3.64 g/L(图3C)。与S1552相比,S2207中GlcNAc合成水平提高了1.04倍。
2.2 GlcNAc6P分解代谢途径的弱化
弱化GlcNAc6P分解代谢途径对GlcNAc产量的影响见图4。
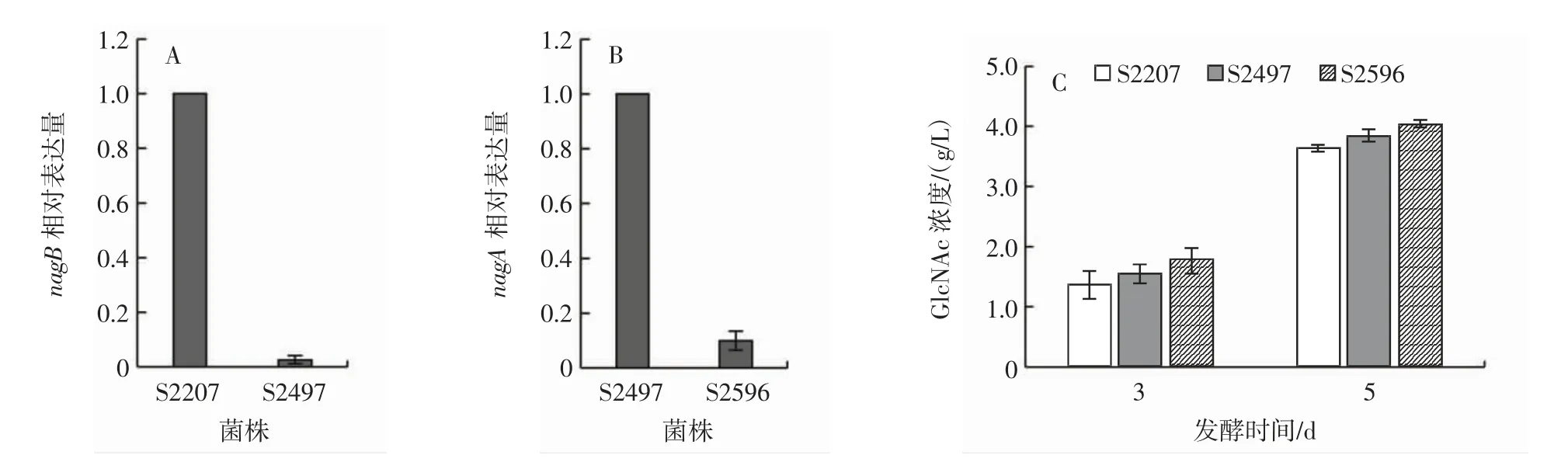
图4 弱化GlcNAc6P分解代谢途径对GlcNAc产量的影响Fig.4 Effects of weakening GlcNAc6P catabolic pathway on GlcNAc production
GlcNAc6P作为GlcNAc的直接前体物质,在黑曲霉细胞中很容易在乙酰氨基葡萄糖-6-磷酸脱乙酰酶NagA和氨基葡萄糖-6-磷酸脱氨基酶NagB的作用下形成F6P,从而在6-磷酸果糖激酶(PfkA)的作用下进入糖酵解途径,从而减少GlcNAc6P的供给水平,进而导致GlcNAc合成水平下降。因此,为了增加GlcNAc合成前体GlcNAc6P的胞内供给,本研究首先以S2207(ΔngtA,OEyqaB,OEgnaA,OEgfaA)为出发菌株,通过弱化nagB的表达降低GlcN6P生成F6P的水平,得到菌株 S2497(ΔngtA,OEyqaB,OEgnaA,OEgfaA,sinagB)。转录分析表明,与S2207相比,nagB基因在S2497中的表达水平下降了97.4%(图4A)。发酵分析发现,S2497发酵3 d和5 d时,GlcNAc浓度分别为1.55 g/L和3.85 g/L(图4C),合成水平略微提高。在此基础上,弱化nagA表达以进一步减少GlcNAc6P支路代谢,得到菌株 S2596(ΔngtA,OEyqaB,OEgnaA,OEgfaA,sinagB,sinagA)。转录分析表明,与S2497相比,nagA基因在S2596中的表达水平下降了90.1%(图4B)。发酵分析发现,S2596发酵3 d和5 d时,GlcNAc浓度分别为1.77 g/L和4.03 g/L(图4C),与S2207相比,S2596中GlcNAc合成水平提高了10.7%。以上结果表明,通过弱化GlcNAc6P分解代谢途径可明显提高黑曲霉合成GlcNAc水平。
2.3 分支代谢途径的弱化
分支代谢途径的弱化对GlcNAc产量的影响见图5。

图5 分支代谢途径的弱化对GlcNAc产量的影响Fig.5 Effects of weakened branched metabolic pathway on GlcNAc production
黑曲霉具有旺盛的糖酵解代谢活性和柠檬酸合成能力[22],与GlcNAc合成途径竞争共同前体物质F6P。在满足菌体正常代谢、生长的条件下,进一步增强GlcNAc合成的前体物质供给,本研究构建了磷酸果糖激酶基因pfkA弱化表达菌株S2629(ΔngtA,OEyqaB,OEgnaA,OEgfaA,sinagB,sinagA,sipfkA)。pfkA 弱化后,菌株生长无明显差异(图5A)。转录分析表明,与S2596相比,pfkA基因在S2629中的表达水平下降了91.6%(图5B)。发酵分析发现,S2629发酵3 d和5 d时,GlcNAc浓度分别为1.97 g/L和4.61 g/L(图5C),与S2596相比,S2629中GlcNAc合成水平提高了14.4%。以上结果表明,通过弱化F6P分支分解代谢途径,增加GlcNAc合成前体供给,可明显提高黑曲霉合成GlcNAc水平。
2.4 黑曲霉重组菌株在2 L发酵罐中分批发酵生产GlcNAc
为进一步评估黑曲霉发酵性能,在2 L发酵罐中进行了重组菌株S2629的规模化发酵试验。黑曲霉重组菌株S2629在2 L发酵罐分批发酵生产GlcNAc过程曲线见图6。
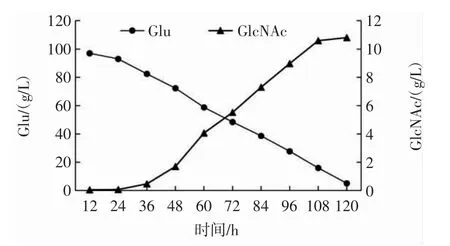
图6 黑曲霉重组菌株S2629在2 L发酵罐分批发酵生产GlcNAc过程曲线Fig.6 Process curve of the production of GlcNAc by batch fermentation of A.niger S2629 in a 2 L fermenter
由图6可知,在120 h的发酵周期中,24 h后葡萄糖消耗速率较快,120 h时葡萄糖几乎耗尽。36 h后,GlcNAc开始明显积累,重组菌株S2629在发酵120 h后GlcNAc浓度为10.8 g/L,产率为0.108 g/g葡萄糖。
3 讨论与结论
GlcNAc是一种重要的功能性单糖,在保健食品、医药、精细化工等众多领域被广泛应用,并成为近年来的研究热点。黑曲霉的遗传背景清晰,能够利用廉价的原料,具有很高的碳源转化效率,是具有科学研究和工业生产价值的丝状真菌细胞工厂。本研究通过深入分析黑曲霉中合成GlcNAc代谢途径,将改造策略分为3个部分,即强化合成途径、弱化GlcNAc6P分解代谢途径、弱化分支代谢途径。本研究首先将来源于大肠杆菌卤酸脱卤酶样磷酸酶编码基因yqaB经密码子优化后进行异源表达,实现了GlcNAc在黑曲霉中的积累。进一步通过过表达gnaA和gfaA强化GlcNAc的合成,从而使GlcNAc的合成水平达到3.64 g/L,与上一代菌株相比GlcNAc合成水平提高了1.04倍。Glc-NAc6P作为GlcNAc的直接前体物质,通过弱化nagB和nagA基因表达,减弱GlcNAc6P的分解代谢,增加胞内GlcNAc6P供给,进而使GlcNAc的合成水平达到4.03 g/L,与上一代菌株相比GlcNAc合成水平提高了10.7%。GlcNAc的合成途径与糖酵解途径共用前体物质F6P,由于黑曲霉中糖酵解途径代谢旺盛,为了使碳流更多地流向GlcNAc的合成,在前述改造的基础上进一步弱化pfkA的表达,导致GlcNAc的合成水平进一步提高至4.61 g/L。另外,黑曲霉重组菌株在2 L发酵罐中进行分批发酵,GlcNAc的浓度提高至10.8 g/L。目前以黑曲霉为细胞工厂生产GlcNAc还存在一定的差距,在后续研究中将从中心代谢的支路代谢重新设计、辅因子工程优化胞内氧化还原平衡等方面进一步提高GlcNAc合成水平,使黑曲霉成为GlcNAc等高值化合物合成的平台菌株。
