天然结合酚类化合物的研究进展
2022-08-05肖婧泓辛嘉英路雪纯刘青云宋微李慧敏方祁利
肖婧泓,辛嘉英,路雪纯,刘青云,宋微,李慧敏,方祁利
(哈尔滨商业大学 食品工程学院重点实验室,哈尔滨 150076)
植物酚类化合物是广泛分布于植物基质中的生理活性物质,在谷物、水果和蔬菜的保护组织(果皮等)和营养组织(胚芽等)中充当信号或植物防御机制,对病原体入侵提供物理和化学屏障,阻止昆虫和动物的攻击,并具有抗菌、抗氧化等生理功能,在植物中的含量仅次于纤维素、半纤维素和木质素[1-2]。酚类化合物是由一个或多个羟基(甲氧基)取代芳香烃苯环上的氢原子而形成的次生植物代谢物(如酚酸、黄酮等)[3]。酚类化合物因其卓越的生理活性逐渐成为研究热点。
酚类化合物在植物中有不同的存在形式,一种是游离酚类化合物,另一种是通过酯键、醚键和碳碳双键与纤维素、蛋白质、木质素等物质相互作用(共轭),或因离子键与膳食纤维相互作用成为植物基质,或嵌入细胞内形成结合酚类化合物[4]。目前,多数研究集中在游离酚类化合物的组成和生物学功能上,而存在于表皮、叶子中的结合酚类化合物被视为废料。然而,植物中的酚类化合物主要以结合状态存在[5]。近年来,结合酚类化合物逐渐被发现和重视,由于自身与不溶性大分子或细胞壁物质结合,不易直接采用传统的浸渍和索氏提取法获得[6]。结合酚类化合物可采用碱性、酸性水解或酶解的方法处理[7-8],Kim等[9]分别采用碱性、酸性水解处理麸皮释放结合酚类化合物,前者处理过的麸皮相较于后者有较强的生理活性。Sanchez-Gonzalez等[10]采用从微生物中提取的酶破坏结合的酯链,从而释放结合酚类化合物。除化学方法外,也可采用物理方式处理,如高温蒸煮、超高压等方法处理和释放结合酚类化合物[11],Li等[12]研究发现随着加工温度的升高,山楂中结合酚类化合物的含量增加。Zhang等[13]采用超高压对芒果叶进行预处理,发现不溶性结合酚类化合物从(20.17±1.40) mg/g增加到29.13 mg/g。
随着结合酚类化合物的研究逐渐深入,发现结合酚类化合物具有应用在食品方面的巨大潜力,邹月等[14]综述阿魏酰低聚糖可替代蔗糖添加到食品中作为甜味剂。杨文平等[15]将500 mg/mL燕麦的酚类提取物添加到冷冻猪肉中,可减缓猪肉蛋白氧化。张嵘等[16]概述了植物酚类化合物抗氧化和抗菌功能,可用于防止肉制品微生物污染和氧化。因此,本文将以结合酚类化合物为综述对象,从绿色提取方式、生物可给性和生理活性3个方面进行阐述,为后续在食品添加剂方面的应用提供参考。
1 深共熔溶剂提取方式
酚类化合物的提取常采用有机溶剂液-固浸提法,此方法高效、易操作且适用性广。直接采用有机溶剂浸提法的提取液中,酚类化合物主要以游离酚类化合物的形态存在。在植物基质中,与大分子物质通过离子键相互作用产生的结合酚类化合物不易被有机溶剂直接萃取获得,但水解后可采用有机溶剂萃取,萃取的有机溶剂大多选用乙酸乙酯和乙醚的混合物。有机溶剂提取法因其优点在酚类化合物的提取中得到广泛应用,但该方法有不可忽视的缺点:大部分溶剂具有挥发性强、有毒性、成本高等特点,并且大量使用有机溶剂对人体和环境会造成危害。为了解决这个问题,近年来学者们不断探索新兴绿色溶剂。
绿色高效提取天然化合物的溶剂是人们关注的焦点,而深共熔溶剂(deep eutectic solvents,DES)作为一种低熔点、低毒性和可生物降解的新兴溶剂备受关注。DES是由氢键受体(hydrogen bond acceptor,HBA)(氯化胆碱)和氢键供体(hydrogen bond donor,HBD)(有机酸、糖和醇)根据具体情况按不同比例组成的溶剂体系,而HBA和HBD之间形成的氢键是降低熔点和提高萃取率的主要原因[17]。作为一种溶剂性质较好的溶剂,DES在提取酚类化合物方面很受欢迎(见图1)。邢晨等[18]在概述酚类化合物提取时表明DES对其具有良好的提取效果,并提出水解后的结合酚类化合物也可采用相同的方法。随后的实验证明DES可以用于提取处理后的结合酚类化合物,而且提取效果远比传统的方法更有优势。Wang等[19]分别采用60%甲醇溶液和深共熔溶剂体系进行提取,通过DES提取的结合酚类化合物为20.8~37.1 μg/g,比传统方法得到的8.32~18.0 μg/g高12.48~19.1 μg/g,相较之下,DES对结合态酚类化合物的溶解性更好。DES对结合酚类化合物提取效果方面也优于游离酚类化合物,Wang等[20]利用DES提取茶籽油中不同类型的酚类化合物,采用氯化胆碱-甘油在50 ℃进行提取的方法,游离酚类化合物和结合酚类化合物分别增加到51.0%和93.2%,而结合酚类化合物比游离酚类化合物增加42.3%。DES作为一种绿色健康的提取方式应该被广泛地应用到对不同底物结合酚类化合物的提取,这有助于对后续结构和生理活性的探究,并对相关功能性食品开发具有指导意义。
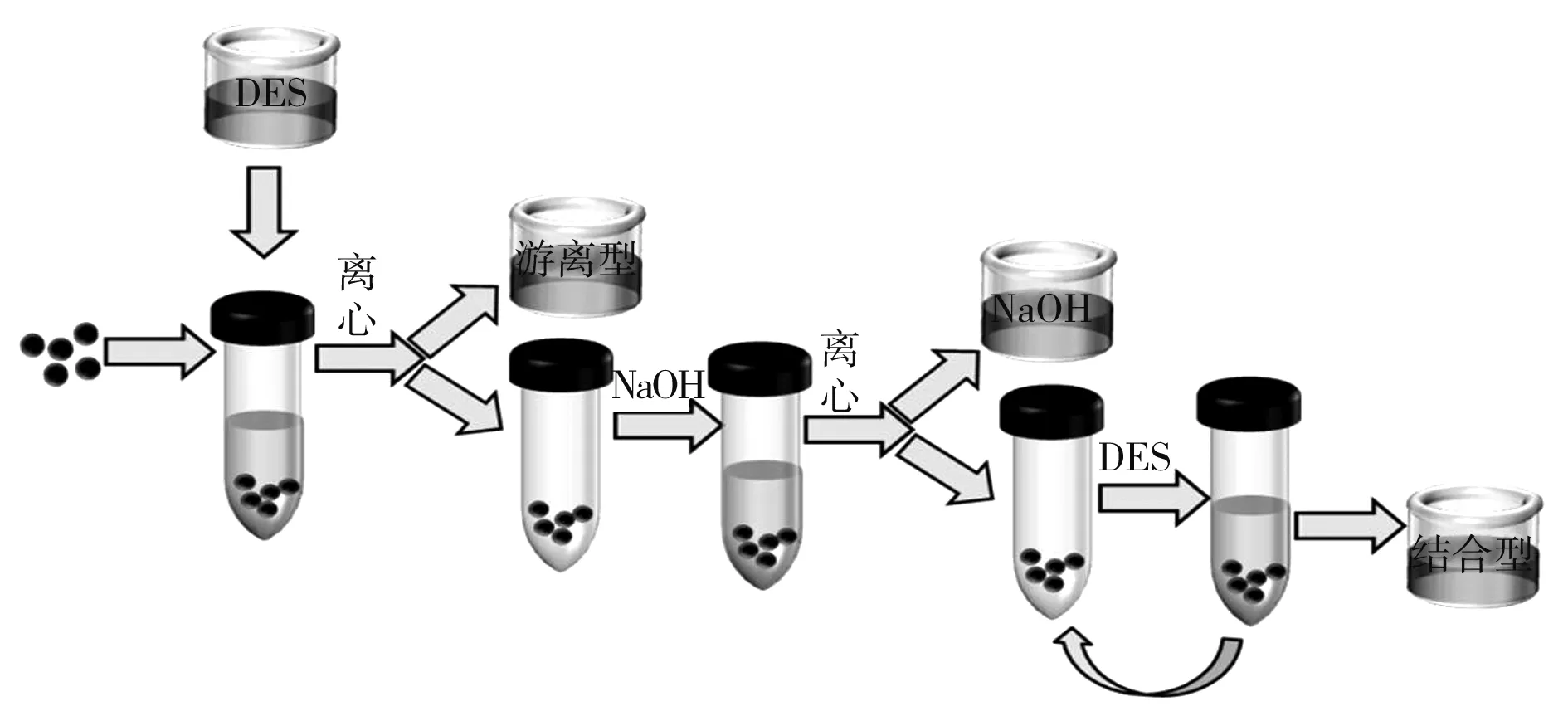
图1 DES提取过程
2 生物可给性
植物中以不同形式存在的酚类化合物具有的生物活性需通过生物利用度(释放(生物可给性)、吸收、代谢和循环)体现对人体健康产生的影响。生物利用度是指生物活性成分被血液循环系统吸收,从而在目标组织和器官上发挥生物活性的程度。而生物可给性是指肠道可能吸收的生物活性化合物的数量,因此生物利用度又严格依赖于生物可给性(释放)[21]。
近些年来,植物中存在的结合酚类化合物的生理活性作用被深入研究,其对人体健康产生影响的前提是结合酚类化合物的生物可给性和生物利用度。含酚类化合物的食物通过口腔咀嚼后进入胃中,而在胃肠道中不同形式的酚类物质遵循着不同的消化吸收途径。游离酚类化合物可直接被肠道吸收,少部分结合酚类化合物可通过胃和小肠中的转运蛋白吸收或经水解后吸收,陈华敏[22]采用Caco-2单层细胞模型模拟高粱糠提取的游离酚类化合物和结合酚类化合物在小肠中的吸收,其表观渗透系数均大于1×10-6,吸收率均大于20%,都表现出良好的吸收效果,但游离酚类化合物的表观渗透系数和吸收率均低于结合酚类化合物,表明结合酚类化合物在小肠的吸收率优于游离酚类化合物。这些通过胃和小肠吸收的酚类化合物只有5%左右,而90%以上的结合酚类化合物几乎都不能被小肠吸收进入大肠(结肠)[23]。大部分结合酚类化合物进入大肠(结肠)后在消化酶、结肠中双歧杆菌、乳酸菌(糖酶、蛋白酶和酯酶)和其他类型酶的作用下,破坏共价键水解释放结合酚类化合物,例如Zhu等[24]研究3种豆科类植物中的结合酚类化合物在结肠中释放,并且结合酚类化合物通过体外消化测试表明肠道消化优于口腔和胃。Genilton等[25]研究表明咖啡和面包中结合酚类化合物在胃酸和肠道胰蛋白酶作用下生物可给性约为11%~26%,而进一步在大肠中由微生物发酵24 h,结合酚类化合物的生物可给性达到50%左右。在肠道微生物群的作用下,结合酚类化合物被释放并代谢,因此结肠上皮被认为是体内吸收结合酚类化合物的主要部位(见图2)。释放的酚类物质通过循环系统被身体组织吸收和利用,最终发挥生物活性作用,如防止氧化损伤、炎症、癌症、肥胖、糖尿病等。
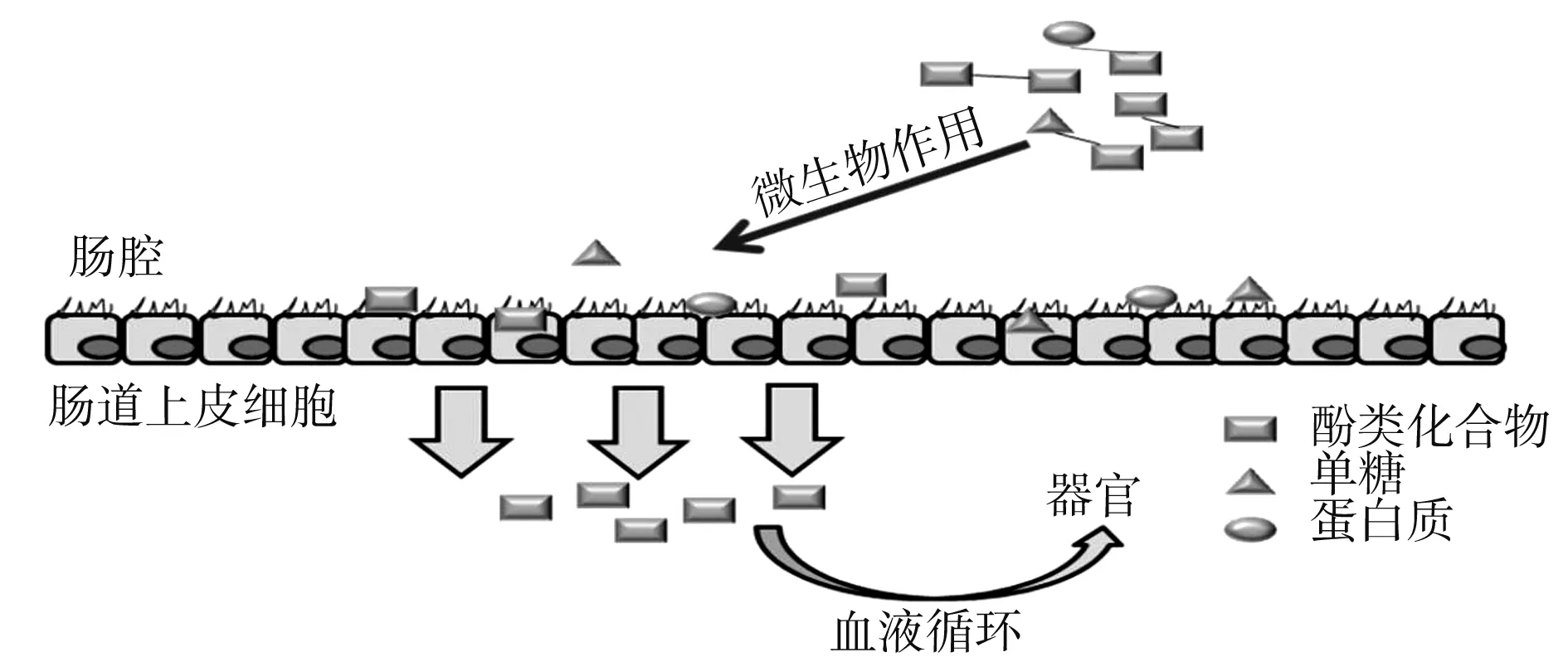
图2 结合酚类化合物在大肠中的吸收过程Fig.2 The absorption process of bound phenolic compounds in the large intestine
3 生理活性
植物中存在的结合酚类化合物是由大分子物质(蛋白质、碳水化合物等)和酚类化合物结合而成,通过大肠(结肠)中的微生物作用将其分解释放,释放后的结合酚类化合物穿过肠道上皮细胞进入血液循环,由血液将其带到各个器官发挥作用,因此结合酚类化合物具有较高的生物可给性,这意味着其生理活性可以对人体健康产生较大的影响。因此近些年,对结合酚类化合物的生理活性研究和发现逐渐成为热点,如抗氧化等生理活性[26-28]。
3.1 抗氧化活性
近几年,关于结合酚类化合物的大量研究表明,其本身具有较强的抗氧化活性[29]。Xu等[30]研究发现,荔枝中与膳食纤维结合的酚类化合物FRAP和ABTS分别为6.88~13.49 mg/g和5.64~9.98 mg/g。Takoudijou等[31]从高粱种子中提取的结合酚类化合物在DPPH和FRAP的检测中结果相似,并得出了结合酚类化合物具有较强抗氧化活性的结论。并且在一些从水果、谷物和农林废物中提取不同存在形式的酚类化合物的文章中发现,有些从植物中提取的结合酚类化合物的抗氧化性优于游离酚类化合物,例如Prakash等[32]从葡萄柚中提取不同存在形式的酚类化合物并进行DPPH、ABTS和FRAP等抗氧化检测,其结合酚类化合物的DPPH(IC50为(13.81±0.36) g/mL)、ABTS(IC50为(12.22±0.47) g/mL)和FRAP抗氧化活性最高。裘芳成等[33]从茶油中提取出的酯化、糖苷和不溶性结合酚类化合物在DPPH、ABTS、FRAP和ORAC的检测中其抗氧化活性皆高于游离酚类化合物,并且抗氧化活性随着含量的增加而升高。Koubala等[34]利用有机溶剂从干果和鲜果中提取结合酚类化合物,在DPPH、ABTS和FRAP等抗氧化检测中发现相似结果,表现出较强的抗氧化活性。可以得出从不同底物中提取的结合酚类化合物抗氧化活性较强的结论,这可能源于其含量或结合后性质的增强,需开展进一步研究。现阶段多数研究中提取物为混合物,其中包含游离酚类化合物和结合酚类化合物,将提取物进行总抗氧化活性测试,其中结合酚类化合物具有较大的贡献。Iftikhar等[35]研究黑麦麸皮及其不溶性膳食纤维中酚类物质对总抗氧化活性的影响,发现黑麦麸皮和不溶性膳食纤维的结合酚类化合物对DPPH的贡献率分别超过60%和70%;黑麦麸皮和不溶性膳食纤维的结合酚类化合物的FRAP值分别占总FRAP值的70%和87%;而黑麦麸皮和不溶性膳食纤维的结合酚类化合物的ABTS值分别占总ABTS值的69%和84%;黑麦麸皮和不溶性膳食纤维的结合酚类化合物分别占总还原力值的67%和90%。这些结果都表明结合酚类物质不仅为总抗氧化活性的主要贡献者,而且结合酚类化合物在4种抗氧化方法中都有较高的抗氧化能力。因此,可考虑采用结合酚类化合物作为绿色抗氧化剂替代人工合成抗氧化剂用于食品中,以避免人工合成抗氧化剂带来的负面影响。
3.2 抑菌能力
酚类化合物在植物中起到防御作用并且被认为具有广谱抗菌性,不仅可以减缓(甚至停止)病原菌的生长,而且能够限制病原菌产生毒素。Bibiana等[36]通过抑制黄曲霉的α-淀粉酶活性研究大豆结合和共轭酚类化合物抗真菌和毒素污染的效果,结合酚类化合物提取物可以有效抑制α-淀粉酶活性从而限制黄曲霉生长,由此检测出黄曲霉毒素B1低水平,这与Wang等[37]研究早、晚熟樱桃中共轭酚类化合物几乎完全抑制链格孢菌的生长和降低毒素的产生的结果相似。因此,结合酚类化合物不光对真菌微生物有一定抑制作用,而且可以降低生长过程中产生的毒素。
结合酚类化合物对革兰氏阳性菌(Gram-positive bacteria, G+)和革兰氏阴性菌(Gram-negative bacteria,G-)同样具有抑制作用,杜小燕[38]从小麦麸皮中提取游离酚类化合物、酯化和糖苷结合酚类化合物,发现其对金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌通过抑菌圈(mm)表示均有抑制作用,而酯化结合酚类化合物对供试菌的抑制作用优于游离酚类化合物,尤其对革兰氏阴性菌大肠杆菌O157的抑制效果最佳,为(47.10±1.84) mm,此结果与陈彩薇[39]从脱脂米糠中提取的游离酚类化合物和酯化、糖苷结合酚类化合物的抑制结果相同。其中,酯化结合酚类化合物(800 g/mL)对大肠杆菌O157的抑制效果最佳,为(19.67±0.49) mm。从谷物中提取的结合酚类化合物相较于G+,对G-表现出显著的抑制作用,但从不同底物中提取的结合酚类化合物可能表现出不同的抑制效果,Singh等[40]从辣木籽粉中提取出的结合酚类化合物和游离酚类化合物对供试菌的最小抑菌浓度分别为0.060%~0.157%和0.117%~0.191%,并在相同浓度下结合酚类化合物对G+(蜡样芽孢杆菌和金黄色葡萄球菌)的抑制作用优于G-(大肠杆菌和小肠结肠炎耶尔森菌)。因此,从不同底物中提取的结合酚类化合物对于G+和G-抑制效果产生的差异,可能源于结合酚类化合物中结合的酚类物质的类型、含量或者结合部位不同,但其真正的原因还需要今后进一步的研究,并为后续在食品中的应用提供理论基础。
3.3 抗炎作用
可能引起机体患病的炎症由细胞免疫反应产生的促炎症因子(内源性多肽)引发,促炎症因子包括一氧化氮(NO)、TNF-α和白细胞介素(IL-1~IL-38)[41]。植物中存在的结合酚类化合物可以通过多种方式防止炎症:降低促炎症细胞因子和肿瘤坏死细胞;增强抗炎因子的表达(IL-10);调节炎症信号通路(NF-kB和MAPK)的方式,使其成为有效的抗炎物质之一。Li等[42]将从红高粱中提取的结合酚类化合物用于脂多糖(LPS)激活RAW 264.7细胞,在浓度为300~500 μg/mL时,对IL-6和IL-1β的抑制作用显著(P<0.05)。通过降低细胞产生NO和白细胞介素以达到抑制炎症的作用。最近研究表明,从茶油中提取的糖苷性结合酚类化合物也表现出抑制RAW 264.7细胞产生NO的特性,并在10 μg/mL浓度下其抑制细胞产生NO的作用最强,其抗炎活性表现为NO、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)的含量降低[43]。从谷物等中提取的结合酚类化合物对于LPS激活RAW 264.7中的多种促炎症因子都表现出显著的抑制作用。除了抑制细胞中的促炎症因子外,结合酚类化合物还可以抑制细胞信号通路和增强抗炎因子。Fang等[44]用从米糠中提取的阿魏酰寡糖处理RAW 264.7细胞,其中的抗炎因子IL-10增加。NF-kB通路的异常激活会导致许多疾病,并且NF-kB异常激活的调控被认为是治疗包括炎症在内的疾病的重要治疗靶点。 Ajiboye等[45]研究发现丁香叶中400 mg/kg 浓度下的结合酚类化合物可通过降低炎症信号通路NF-kB等实现较强的抗炎作用。鉴于上述情况,结合酚类化合物是有效治疗炎症的潜在物质。
3.4 降血糖
糖尿病被称为世界第五大健康杀手,已经成为全球关注的人类疾病。糖尿病的特征是机体对胰岛素不敏感,使血糖水平升高,同时还可能带来多种并发症进而威胁身体健康。α-淀粉酶、α-葡萄糖苷酶和胰脂肪酶等在多糖代谢中的活性在糖尿病中起着至关重要的作用。但是在其治疗过程中采用的药物会引起一些不良反应如腹部不适和胀气。因此,寻找天然抑制α-淀粉酶和α-葡萄糖苷酶等的物质是目前的研究热点。近些年研究发现,天然结合酚类化合物对α-淀粉酶和α-葡萄糖苷酶等具有抑制作用,可以减少肠道内单糖的吸收从而达到控制血糖的目的。
从谷物中提取的结合酚类化合物对α-葡萄糖苷酶的抑制作用要强于α-淀粉酶,Wu等[46]从黑米、籼米和粳米3个品种米糠中提取的结合酚类化合物对α-淀粉酶的抑制率均高于相应的游离酚类化合物,而除黑米外其他的结合酚类化合物对α-葡萄糖苷酶的抑制率均高于游离酚类化合物,其粳米结合酚类化合物对α-葡萄糖苷酶的IC50为11.02 g/mL,黑米的结合酚类化合物对α-淀粉酶的IC50为103.42 g/mL,因此结合酚类化合物对α-葡萄糖苷酶的抑制优于α-淀粉酶,抑制率随含量的增加而增加。Yang等[47]用乙酸乙酯提取裸燕麦中的酯化结合酚类化合物相较于α-淀粉酶的抑制,对α-葡萄糖苷酶具有更强的抑制作用。谷物中的结合酚类化合物对α-葡萄糖苷酶和α-淀粉酶的不同抑制效果源于结合酚类化合物与α-葡萄糖苷酶活性位点有较高的亲和力[48]。因此,谷物中提取的结合酚类化合物较强的α-葡萄糖苷酶抑制活性和温和的α-淀粉酶抑制活性是降低血糖反应和避免高度抑制α-淀粉酶使肠道中未消化淀粉产生发酵异常而引发腹胀等不良反应的潜在物质。谷物中提取的结合酚类化合物具有良好的调节血糖和维持机体健康的潜力。
结合酚类化合物除了对α-葡萄糖苷酶、α-淀粉酶具有抑制作用外,还可以通过抑制其他途径达到降低血糖的作用。从水杨树中提取的结合酚类化合物对晚期糖基化结束(advanced glycation end, AGE)产生较强的抑制作用(IC50为(0.43±0.03) mg/mL)[49],AGE是机体长期暴露在高糖环境中引起一种异常的生理变化,被认为与高血糖与糖尿病并发症的主要发病机制有关,通过抑制AGEs的形成能够缓解糖尿病并发症,改善糖尿病患者的健康状况。糖尿患者的肠道会在较短时间内吸收较多的葡萄糖,而通过抑制患者肠道内的葡萄糖转运体,从而影响葡萄糖的吸收是一种有效治疗方法,以Caco-2为模型研究肠道中葡萄糖的吸收,从小麦中提取的不溶性结合酚类化合物能抑制Caco-2模型对葡萄糖的吸收,并且葡萄糖摄取抑制程度与结合酚类化合物含量呈正相关[50]。因此,结合酚类化合物通过抑制导致血糖升高的消化酶(α-淀粉酶、α-葡萄糖苷酶)、异常生理变化和葡萄糖吸收从而达到降低血糖的效果,可作为有效降低血糖的潜在物质应用在特殊人群的食品中,并对其潜在抑制机制开展进一步研究。
4 结论
植物中广泛分布的酚类化合物具有卓越的生理活性,而植物中的酚类化合物绝大部分的存在形式为与大分子物质相互作用的结合型。近几年,对于结合酚类化合物的研究越来越受到重视,深共熔溶剂法作为一种绿色环保的提取方式,使结合酚类化合物提取新方法得到进一步的开发。结合酚类化合物本身具有多种生理活性,如抗氧化、降血糖等,而所具有的生理活性要比游离酚类化合物更优越。通过肠道体外模拟测试,发现其在大肠微生物和酶的作用下释放并在不同的部位或器官上发挥活性。本文对结合酚类化合物现阶段的研究进行了总结,为后续在抗氧化剂、防腐剂和功能食品添加剂等食品行业的应用提供了理论基础,以期为科学开发富含酚类化合物的产品提供更多参考。
