南海软珊瑚共附生真菌Aspergillus sp.EGF15-0-3中色酮、蒽醌及其二聚体类化合物*
2022-08-05黎咏怡蔡金旋方越李家欣钟小倩韦霞刘炳新张翠仙
黎咏怡,蔡金旋,方越,李家欣,钟小倩,韦霞,刘炳新,张翠仙
广州中医药大学中药学院,广东 广州 510006
色酮、蒽醌及其二聚体类化合物一直是海洋微生物主要的次生代谢产物[1-7],近年来发现系列结构复杂的色酮、蒽醌形成的(杂合)二聚体类化合物[4-7],它们具有较好的生理活性:如抗肿瘤、抗病毒和抗氧化活性等。目前文献研究发现,已经报道的色酮蒽醌类杂合二聚体类化合物共有4种连 接 方 式,分 别 为C5—C7′[8-9]、C10—C7′[10]、C7—C7′[11]和C7—C5′[12](图1)。 其 中 由torosachrysone 和大黄素甲醚杂合二聚体的连接方式主要是通过C5—C7′、C7—C7′以及C10—C7′ 3种连接类型(图2)。前期我们报道了从软珊瑚共附生真菌Aspergillussp. EGF15-0-3 的GPY 培养基中分离得到了蒽醌和二酮哌嗪等生物碱类成分[13]。为了继续挖掘蒽醌类成分,我们在GNPS 和OSMAC策略的指导下[14],从此菌的PDA 培养基中不仅得到了结构丰富的二酮哌嗪类生物碱[15],还得到了2个色酮:asperflavin(3)和8-O-methyl ether-asperflavin(4);5 个蒽醌(苷)类化合物:emodin(5)、1-Omethyl emodin(6)、physcion(7)、rubrocristin(8)和3-O-(α-D- ribofuranosyl)-questin(9);2 个色酮和蒽醌(杂合)二聚体类化合物:eurorubrin(1)和anhydro flavomannin-quinone-6,6′-dimethyl ether(2)(图3)。其中1 由两分子3 通过亚甲基桥链接而成,而2 则是由色酮与大黄素组成的杂合二聚体类化合物。2为首次得到的天然产物。化合物1、2、4 和9 首次从Aspergillus属得到。本研究为此系列化合物的进一步挖掘工作提供了指引方向。

图1 目前文献报道的色酮和蒽醌类杂合二聚体类化合物连接位置及连接方式示意图Fig.1 Connective position and types of known heterodimers between xanthones and anthraquinone

图2 目前torosachrysone和大黄素甲醚杂合二聚体的3种连接方式Fig.2 Three types of connective position of dimers between torosachrysone and emodin

图3 从软珊瑚共附生真菌Aspergillus sp. EGF15-0-3中分离得到化合物1~9Fig.3 Compounds 1-9 from Aspergillus sp. EGF15-0-3 on the PDA medium
1 实验部分
1.1 仪器、试剂与材料
论文中菌种、微生物发酵用培养基、次生代谢产物提取与分离、化合物结构鉴定所用的仪器、试剂和材料与文献[16]相同。
1.2 菌株EGF 15-0-3培养
菌株EGF15-0-3的复苏、种子液培养及菌株发酵过程与文献[16]相同。
1.3 菌株EGF 15-0-3的提取分离
菌株后处理及次生代谢产物的分离、纯化见图4。其中YMC 色谱柱规格为YMC-Pack ODS-A/S 5 μm/12 nm, 250 mm×10.0 mm;Kromasil 半制备柱规格为10 mm×250 mm、5µm。
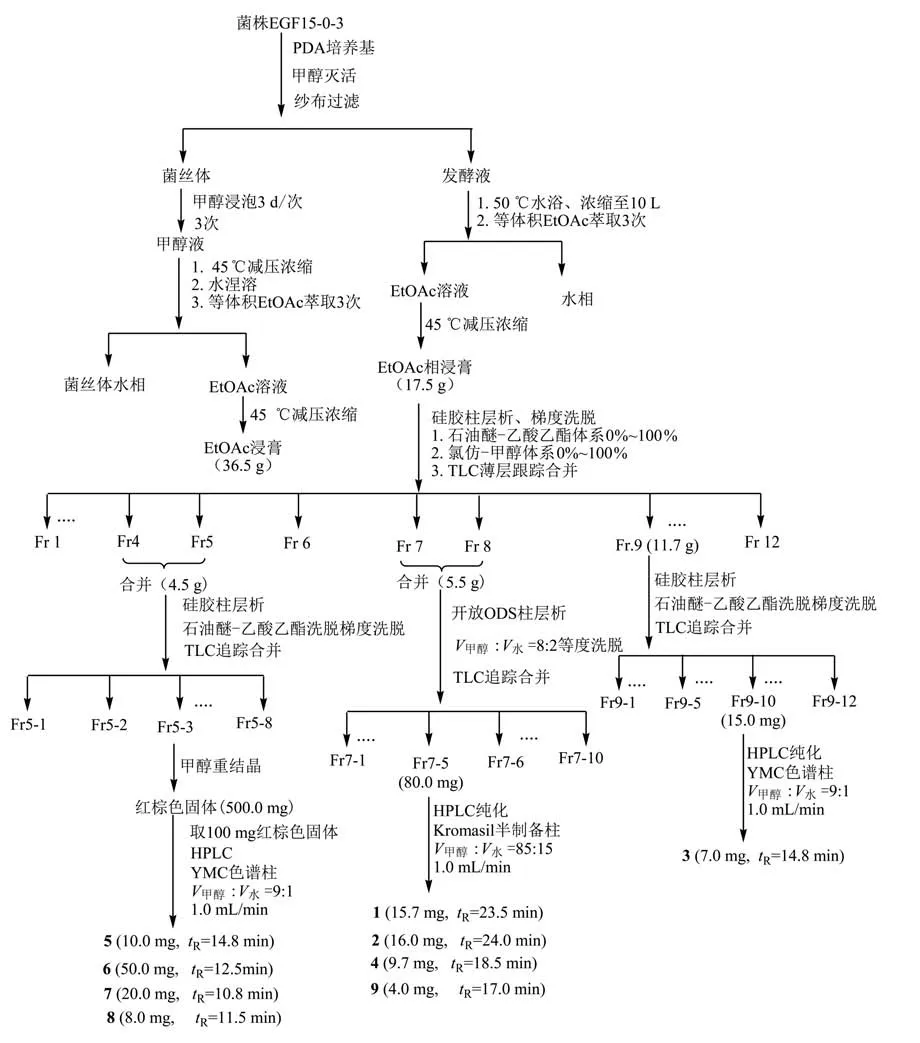
图4 化合物1~9分离流程图Fig.4 The flowing chart of compounds 1-9 from Aspergillus sp.EGF15-0-3
1.4 物理常数和波谱数据
Eurorubrin(1)黄绿色无定型粉末(甲醇),甲醇溶液在自然光下显蓝绿色荧光,分子式C33H32O10,+ 8.0°(c0.20,MeOH);1H NMR(CD3OD,400 MHz)δH和13C NMR(CD3OD,100 MHz)δC见表1;HR-ESI-MSm/z:611.187 5[M+Na]+(Cal.611.189 3)。
Anhydro flavomannin-quinone-6, 6′-dimethyl ether(2)暗红色无定型粉末(甲醇),分子式为C32H26O10=+56.5°(c0.03,MeOH);1H NMR(CD3OD,CDCl3,400 MHz)δH和13C NMR(CD3OD,100 MHz)δC见 表2;HR-ESI-MSm/z:593.141 3[M+Na]+(Cal. 593.142 4)。

表2 化合物2 的1H NMR(溶剂CD3OD、CDCl3)和13C NMR数据表Table 2 1H NMR(CD3OD and CDCl3)and13C NMR(CD3OD)data of compound 2
Asperflavin(3)蓝绿色粉末(甲醇),分子式为C16H16O5,紫外灯365 nm 下呈亮蓝色荧光,FeCl3显蓝色,+4°(c0.08,MeOH),分子式C16H16O5;1H NMR (CD3OD,DMSO-d6, 600 MHz)δH和13C NMR(CD3OD,125 MHz)δC见表1;ESI-MSm/z:287[M-H]-。
8-O-methyl ether-asperflavin(4)浅黄色针晶(甲醇),分 子 式 为C17H18O5,= + 8.1°(c0.04,MeOH);1H NMR(CD3OD,400 MHz)δH和13C NMR(CD3OD,100 MHz)δC见 表1;HR-ESI-MSm/z:303.122 9[M+H]+(Cal. 303.123 2)。
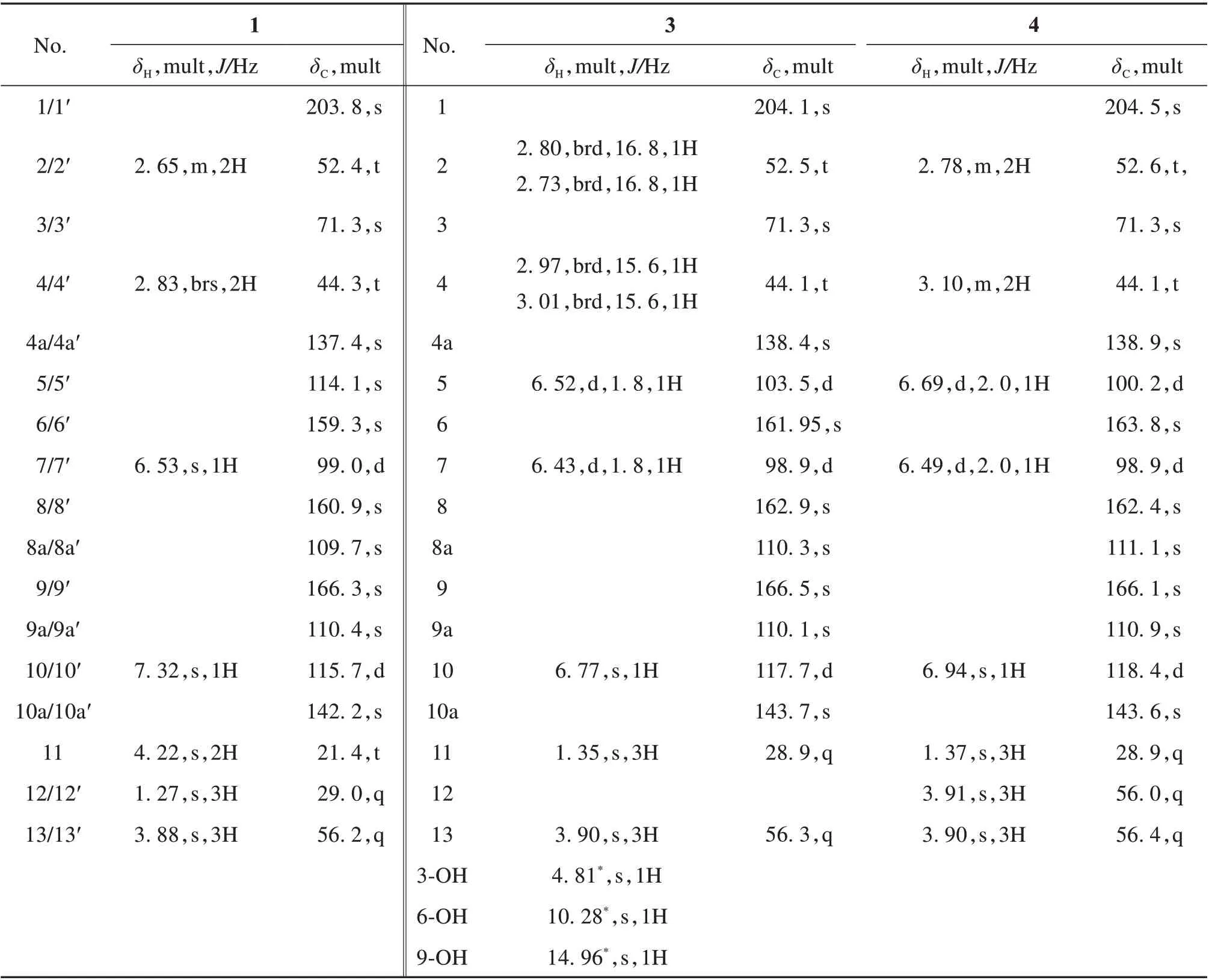
表1 化合物1、3和4的NMR数据表1)Table 1 NMR data of compounds 1,3 and 4(CD3OD)
Emodin(5)橙红色针状结晶(甲醇),分子式为C15H10O5,θmp265~267 ℃,紫外灯365 nm 下呈红色荧光。1H NMR(400 MHz,Pyr-d5)δH和13C NMR(100 MHz,Pyr-d5)δC见表3;ESI-MSm/z:269[M-H]-。
1-O-methyl emodin(6)砖红色片状晶体(甲醇),分子式为C16H12O5,θmp203~207 ℃,紫外灯365 nm下 呈 红 色 荧 光。1H NMR(400 MHz,Pyr-d5)δH和13C NMR(100 MHz,Pyr-d5)δC见表3;ESI-MSm/z:283[M-H]-。
Physcion(7)橙黄色针状结晶(甲醇),分子式为C16H12O5,θmp284~286 ℃,紫外灯365 nm 下呈红色荧光。1H NMR(400 MHz,Pyr-d5)δH和13C NMR(100 MHz,Pyr-d5)δC见表3;ESI-MSm/z:283[M-H]-。
Rubrocristin(8)红色针状结晶(甲醇),分子式为C16H12O6,θmp280~281 ℃,紫外灯365 nm 下呈红色荧光。1H NMR(500 MHz,Pyr-d5)δH和13C NMR(125 MHz,Pyr-d5)δC见 表3;ESI-MSm/z:299[M-H]-。
3-O-(α-D-ribofuranosyl)-questin(9)橙黄色不定形粉末,分子式为C21H20O9,= +88.4°(c0.04,MeOH),1H NMR(CD3OD,400 MHz)δH和13C NMR(CD3OD,100 MHz)δC见 表3;HR-ESI-MSm/z:417.117 7[M+H]+(Cal. 417.118 6)。
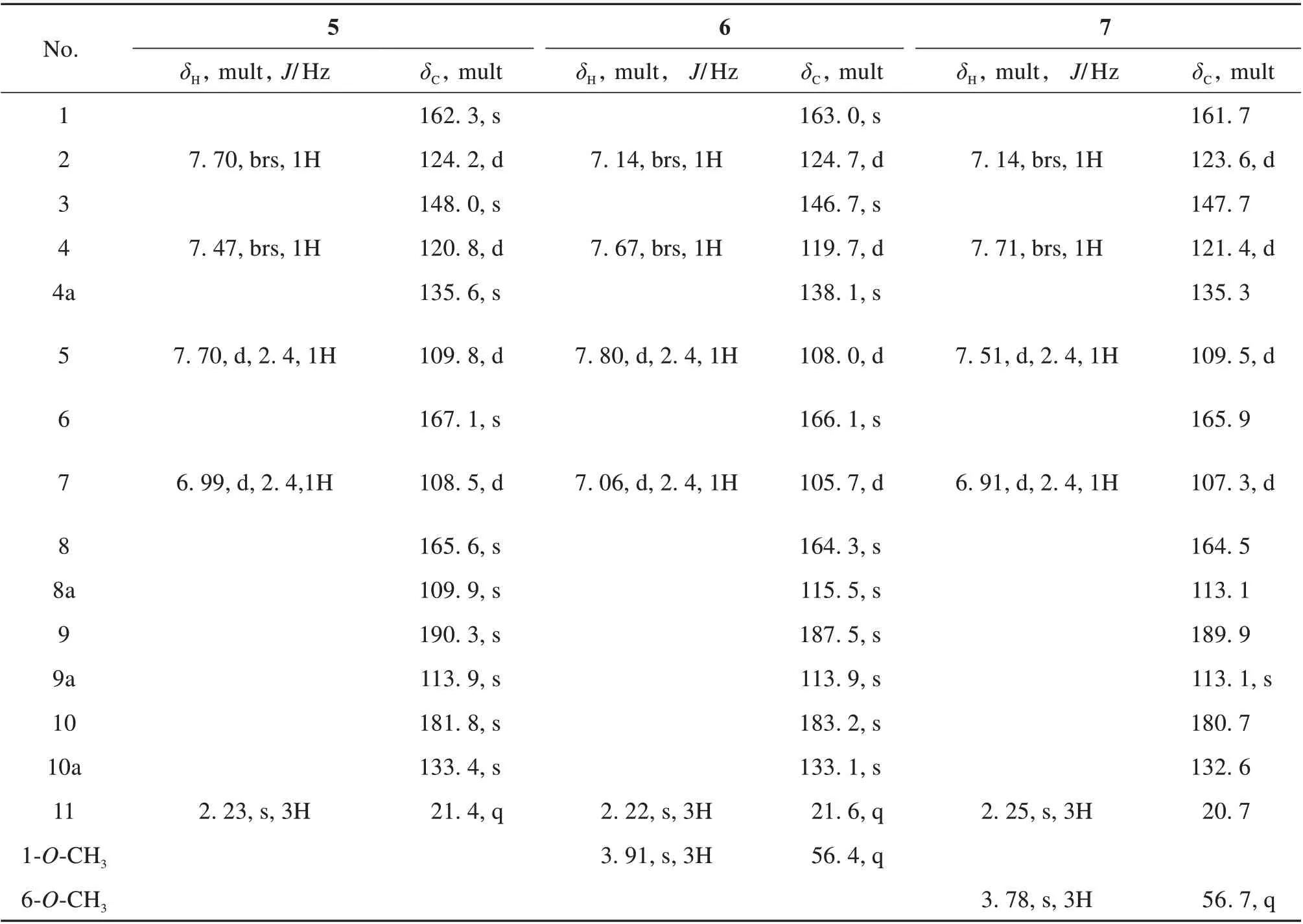
表3 化合物5~9的NMR 数据表(5~8:Pyr-d5,9:CD3OD)Table 3 NMR data of compounds 5-9(5-8 in Pyr-d5 and 9 in CD3OD)
2 结果与讨论
Eurorubrin(1)黄绿色无定型粉末,甲醇溶液在自然光下显蓝绿色荧光,HRESIMS 给出的准分子离子峰m/z:611.187 5[M+Na]+(计算值为611.189 3),分子式为C33H32O10,U=18。1H NMR 谱中给出1 组甲基信号δH1.27(3H,s),3 组亚甲基δH2.65(m,2H)、2.83(brs,2H)和4.22(s,2H,H-11),一组甲氧基3.88(s,3H)以及两个芳香质子信息6.53(s,1H)和7.32(s,1H)。13C NMR 谱中给出17个碳信号包括10 个C、3 个CH、2 个CH2和2 个CH3。综合分析其NMR 和MS 数据,推测1 可能为由一个亚甲基相连的asperflavin[17]二聚体,asperflavin(3)也在该真菌中分离得到。比较1 和asperflavin(3)的NMR 数据发现在13C NMR 谱中次甲基信号[3:δC103.5(d,C-5)]变成了季碳信息[1:δC114.1(s,C-5)],且在1H NMR谱中也缺少了一个芳香质子信号(3:6.52,d,1.8,1H)。在1 的NMR 图谱中比asperflavin 多出了一个亚甲基碳信号[δH4.22(2H,s,H-11)和δC21.4(t,C-11)]。HMBC 给出H-11→C5/C6/C10a 相关信息证实了两个asperflavin是通过一个亚甲基在5,5′位相连。将化合物旋光数据与asperflavin(3)(+ 4 °(c= 0.08,MeOH)对比,数值接近,说明C-3 位的立体构型与asperflavin(3)相同。将数据与eurorubrin[7]对照,发现基本一致,故确定1 为eurorubrin,此化合物目前报道仅来源于Eurotium属,该化合物首次从Aspergillus属中得到。
Anhydro flavomannin-quinone-6,6′-dimethyl ether(2)暗红色粉末,KOH显色呈粉红色,提示为蒽醌类物质。HRESIMS 给出的准分子离子峰m/z:593.141 3[M+Na]+(Cal. 593.142 4),分子式为C32H26O10,U=20。1H NMR(CDCl3)谱中显示有两个分子内氢键相关羟基信号δH15.92(1H,s,9-OH)和δH14.87(1H,s,1′-OH)。1H NMR(CD3OD)谱中显示5 个芳香质子δH6.17(1H,s,H-10)、6.64(1H,s,H-5)、6.84(1H,d,1.6,H-2′)、6.33(1H,d,2.0,H-4′)和6.66(1H,s,H-5′),2 个甲氧基δH3.95(3H,s,6′-OCH3)和4.01(3H,s,6-O-CH3)、1个芳香甲基δH1.90(3H,s,3′-CH3)、1 个脂肪族甲基δH1.21(3H,s,3-CH3)和2 个亚甲基δH2.67(2H,m,H-2)和δH2.76(2H,m,H-4)。结合13C NMR(CD3OD)谱给出32 个碳信号,包括21 个C、5 个CH、2 个CH2和4 个CH3。综合分析其NMR 和MS 图谱,可知该化合物应为二聚体结构类型,且为torosachrysone[18]和大黄素甲醚[19]的杂合二聚体。在常见的3 种连接方式中(图2),以C5—C7′链相连的来源于植物Senna multiglandulosa的杂合二聚体Torosanin-9′,10′-quinone 和 以C10—C7′链 相 连 的anhydrophlegmacin-9′,10′-quinone 为天然产物,而目前发现的以C7—C7′链相连的anhydro flavomannin-quinone-6,6′-dimethyl ether 怀 疑 为 人 工 产 物。HMBC 显 示δH6.17→δC44.0/71.2/113.7/143.3/162.2/204.2 相关,说明连接位点不在torosachrysone 的C10 位,连接方式为C5—C7′或C7—C7′。HMBC 另 一 相 关 片 段δH6.64→δC110.8/113.7/158.4/162.2/166.7,且δH6.64 对应的C 的化学位移值为99.1,说明连接方式应为C7—C7′链相连。而在分离过程中未接触任何特殊试剂和特殊操作,故确定2 为首次从海洋Aspergillus属真菌中分离得到的天然产物。

续表
化合物3,蓝绿色粉末(甲醇),紫外灯365 nm 下呈亮蓝色荧光,FeCl3显蓝色。ESI-MSm/z:287[M-H]-及NMR 推断其分子式为C16H16O5,不饱和度为9。由NMR 及DEPT 数据知,3 含有1 个叔甲基(δH1.35,s,3-CH3);1 个甲氧基(δH3.90,s,8-OCH3);2 个脂肪族亚甲基(δH2.73,brd,16.8,H-2;2.80,brd,16.8,H-2;2.97,brd,15.6,H-4;3.01,brd,15.6,H-4);3 个芳香质子(δH6.52,d,1.8,H-5;6.43,d,1.8,H-7;6.77,s,H-10);1 个酮羰基(δC204.1,s)。DMSO-d6溶剂测试在低场给出活泼氢之子信号:(δH4.81,s,3-OH;10.28,s,6-OH 和14.96,s,9-OH)。HMBC 显示C 和H 的远程关系:H-2(δH2.73,brd,16.8)和C-1,C-3,3-CH3;H-4(δH2.97,brd,15.6)和C-3,C-9a,C-10;H-5(δH6.52,d,1.8)和C-6,C-8a;H-7(δH6.43,d,1.8)和C-6,C-8;H-10(δH6.77,s)和C-8a,C-9a,C-10a 相耦合(见图5)。根据以上波谱分析,将该化合物3 的NMR 数据与文献asperflavin[17,20-21]数据对比,基本一致,故3确定为asperflavin。

图5 化合物3的结构式和HMBC相关性Fig.5 The structure and key HMBC of 3
8-O-methyl ether-asperflavin(4)浅黄色针晶,HRESIMS 给出的准分子离子峰m/z:303.122 9[M+H]+(Cal. 303.123 2),分子式为C17H18O5,不饱和度为9。1H NMR 谱中给出1 组甲基信号δH1.37(3H,s,H-11),两组亚甲基δH2.78(2H,m,H-2)和3.10(2H,m,H-4),两组甲氧基3.91(3H,s,H-12)和3.90(3H,s,H-13)以及3 组芳香质子信息6.94(1H,s,H-10)、6.69(1H,d,2.0,H-5)和6.49(1H,d,2.0,H-7)。13C NMR 谱中给出17 个碳信号包括9 个C、3 个CH、2 个CH2基和3 个CH3。δC204.5(s,C-1)为孤立羰基信号,δC71.3(s,C-3)为连氧季碳,52.6(t,C-2)和44.1(t,C-4)为亚甲基碳信号但化学位移值明显向低场移动。对比化合物4 与3 发现,二者结构十分相似,只是比3增加了一个甲氧基信息。将4 的NMR 数据与(S)-torosachrysone-8-Omethyl ether 对比[22],二者基本一致,故确定4 为8-O-methyl ether-asperflavin。
化合物5,橙红色针状结晶(甲醇),紫外灯365 nm 下呈红色荧光,KOH 显色呈粉红色,提示为蒽醌类物质。ESI-MSm/z:269[M-H]-结合NMR推断其分子式为C15H10O5,不饱和度为11。13C NMR中δC190.3(s)和181.8(s)出现两个羰基信号;同时1H NMR 谱中δH12.44(1H, s)显示存在分子内氢键质子信号; 7.70 (1H, brs), 7.47 (1H, brs), 7.70(1H,d,2.4)和6.99(1H,d,2.4)给出芳香环质子信息;另外还有1 个与芳香环相连的甲基信号2.23(3H,s)。将5的NMR数据与大黄素(emodin)[23]数据对照,二者基本一致。故确定5为大黄素。
化合物6,砖红色片状结晶(甲醇),而7为橙黄色针状结晶(甲醇),二者KOH显色呈红色,提示为蒽醌类化合物,且紫外灯365 nm 下呈红色荧光。二者ESI-MSm/z均为283[M-H]-,结合NMR推断其分子式为C16H12O5,不饱和度为11。对比6、7 和5 的NMR 信息发现,仅比5 多了一个甲氧基信息。分别将6 和7 的NMR 数据与文献1-O-methyl emodin[23-24]和physcion[23]数据对照,基本一致。故确定6 为1-O- methyl emodin,7 为physcion。二者的差别在于甲氧基取代位置不同。而8 亦为红色针状结晶(甲醇),紫外365 nm 和KOH 显色与6 和7 相似,提示其也为蒽醌类化合物。与7 相比增加了1 个分子内氢键信息δH14.32(1H,s),减少了1个芳基质子信息7.71(1H,brs)。将8的NMR数据与rubrocristin[20]数据对比,基本一致。故确定8为rubrocristin。
化合物9,橙黄色不定形粉末,KOH显色呈粉红色,Molish 反应呈阳性提示其为蒽醌苷类物质。HRESIMS 给出的准分子离子峰m/z:417.117 7[M+H]+(Cal. 417.118 6),分子式为C21H20O9,不饱和度为12。将9的NMR与5对照,发现增加6个连氧碳的质子信息δH4.17 (1H, m, H-3′)、4.32(1H,t,5.2,H-2′)、4.40(1H,m,H-4′)、5.83(1H,d,4.0, H-1′)、3.92 (3H, s, H-12)、3.72 (2H, m)和连氧碳信息δC71.1 (d, C-3′)、73.6 (d, C-2′)、88.6(d, C-4′)、101.8 (d, C-1′)、63.2 (t, C-5′)和57.0 (q,-OCH3)。暗示其连接一个五碳糖,且含有一个甲氧基。将9 的NMR 数 据 与3-O-(α-D-ribofuranosyl)-questin[7]对比,基本一致,故确定9 为3-O-(α-D-ribofuranosyl)-questin。
3 结 论
从软珊瑚共附生真菌Aspergillussp. EGF15-0-3的PDA 培养基中共分离得到9 个色酮、蒽醌及其二聚体类单体化合物。化合物2是首次获得的天然产物,化合物1、2、4 和9 首次从Aspergillus属中分离得到。此类成分与临床常用含蒽醌类成分的中药大黄[26(P24),27]、虎杖[25,26(P217)]、何首乌[19,26(P183)]和番泻叶[26(P362)]等具有相同或相似的结构,从某种角度讲海洋微生物可以提供此类中药的单体化合物,来缓解此类药材的胡乱采挖而带来的环境破坏问题。同时对蒽醌-色酮部位体外药理活性测试表明在ρ为200 μg/mL 时对吉非替尼耐药细胞株H1975/GR 的抑制率为69.60%,而单体化合物3、5~8 在50 μg/mL 时,仅化合物6 对吉非替尼耐药细胞株H1975/GR 的抑制率为45.68%。在对此菌的不同培养基产生的次生代谢产物通过GNPS、NMR 和TLC分析发现[14-15],此菌具有很强的代谢能力,不同的培养基明显产生不同的代谢产物,且存在大量结构新颖的化合物,其分离工作正在进行中。
