退化泥炭地亚表层土壤酶活性与DOC变化规律研究
2022-08-04曹芹刘建亮刘坤曾嘉严飞杨刚
曹芹, 刘建亮, 刘坤, 曾嘉, 严飞, 杨刚,*
退化泥炭地亚表层土壤酶活性与DOC变化规律研究
曹芹1, 刘建亮2,3, 刘坤4, 曾嘉1, 严飞1, 杨刚1,*
1. 西南科技大学生命科学与工程学院, 绵阳 621010 2. 中国科学院成都生物研究所山地生态恢复与生物资源利用重点实验室, 成都 610041 3. 中国科学院四川若尔盖湿地生态研究站, 四川红原 624400 4. 重庆市生态环境科学研究院固体废物与土壤研究所, 重庆 401147
在气候变化背景下, 泥炭地亚表层土壤有机碳逐渐参与到碳循环中, 为揭示泥炭地亚表层碳输出与土壤酶活性的关系。以四川省红原县日干乔湿地自然保护区的泥炭沼泽(S1)、沼泽草甸(S2)、高寒草甸(S3)3种不同退化泥炭生态系统中不同深度(0—30 cm、30—60 cm、60—90 cm、90—120 cm、120—150 cm)的土壤作为研究对象, 研究泥炭地表层(<30 cm)、亚表层(30—60 cm)和深层(>60 cm)土壤酶(酚氧化酶、β-葡萄糖苷酶、蔗糖酶)活性和土壤溶解性有机碳(DOC)的变化规律及二者的关系。结果显示, 从泥炭沼泽到沼泽草甸再到高寒草甸的退化过程中, DOC含量逐渐增加。随着泥炭地退化程度的加深, 土壤酶活性呈先升高后降低的变化趋势。从垂直方向来看, 泥炭沼泽和沼泽草甸DOC从表层到亚表层逐渐增加, 高寒草甸DOC从表层到亚表层逐渐减少; 土壤酶中表层的酚氧化酶活性高于深层土壤, 而深层土壤中的β-葡萄糖苷酶、蔗糖酶活性高于表层与亚表层。酚氧化酶活性、β-葡萄糖苷酶活性、蔗糖酶活性直接影响DOC含量变化。其中, β-葡萄糖甘酶在不同水位变动条件下都和DOC保持很好的线性关系, 可作为指示DOC分解的关键酶类。
泥炭地; 土壤亚表层; 酚氧化酶; β-葡萄糖苷酶; 蔗糖酶; 土壤溶解性有机碳
0 前言
泥炭地作为重要的陆地碳库, 尽管只有380万至410万km2面积, 约占全球陆地面积的3%—4%左右, 却储存了全球1/3的土壤有机碳[1-2]。土壤碳库作为最大的有机碳库, 主要是以CO2、HCO3-以及土壤溶解性有机碳(Dissolved organic carbon, DOC)等形式参与地球化学循环[3]。由于人类活动及气候变化加剧, 水位降低造成的逆行演替(泥炭沼泽-沼泽化草甸-高寒草甸)造成大量泥炭地表现出退化趋势[4]。逆行演替使得泥炭地亚表层土壤真菌数量增加[5], 加速植物凋落物、根系分泌物、土壤腐殖质分解, 并形成众多不稳定且极易被分解的DOC, 这部分DOC是土壤碳循环中最活跃的部分, 在土壤碳循环中起着关键性的作用[6]。它们不仅是土壤微生物活动能源和土壤养分的驱动力,而且还直接参与土壤生物化学转化过程[7]。在DOC的分解和转化过程中, 土壤酶是其中主要的参与者, 是土壤整个生物过程的调节者[8], 主要来源于土壤中动植物和微生物活细胞的分泌物以及残体的分解物[9]。不同的土壤酶发挥着不同的作用, 微生物分泌的胞外酶可介导土壤有机质的降解、转化与矿化并对土壤碳动态造成影响[10]。土壤水解酶(如β-葡萄糖苷酶、蔗糖酶等)可参与催化生态系统中植物凋落物中的各种葡萄糖苷及不稳定有机碳的分解, 还可参与分解不稳定的纤维素和其他碳水化合物聚合物。土壤氧化酶(如酚氧化酶等)与木质素降解有关, 介导了木质素降解、腐殖化的关键生态系统功能, 催化土壤中芳香族化合物的氧化分解, 同时对碳矿化和DOC的输出也有相应影响[11-13]。土壤酶对自然或人为因素引起的土壤变化反应迅速, 反映土壤化学和代谢状态, 通常被认为是土壤质量的指标[14-15]。近年来,由于人类垦殖活动及气候变化的影响导致泥炭地退化严重,这必然引起泥炭地亚表层土壤酶活性和有机碳组分的变化。了解泥炭地退化过程土壤中的酶活性和有机碳储量对揭示土壤微生物活性和碳固定具有重要意义。但已有的研究大多强调土壤表层土壤酶和碳动态特征, 有关泥炭地亚表层土壤酶活性和DOC储量方面研究还相当有限。因此, 本研究拟从3种不同退化程度的泥炭即泥炭沼泽(Peat mire, S1)、沼泽草甸(Swamp meadow, S2)、高寒草甸(Alpine meadow, S3)生态系统土壤进行研究, 探讨土壤酶活性和DOC在泥炭地退化过程中的变化特征, 揭示亚表层DOC与土壤酶活性的相关性是否因土壤深度有所差异。为进一步认识和理解不同退化类型泥炭地土壤DOC在地球生物化学循环过程中的作用,为深入理解泥炭地土壤碳素生物地球化学循环机理提供理论依据。
1 材料与方法
1.1 研究区概况
研究区域位于红原县日干乔湿地保护区附近(海拔3300—3600 m), 地处青藏高原东南部。属高原寒温带湿润季风气候, 气候寒冷, 年平均气温为5.5 ℃, 最高温出现在7月份, 为17.9 ℃, 最低温出现在1月份, 为—19.1 ℃, 年平均降雨量为860.8 mm, 数据来源于中国气象局国家气象信息中心。区域盛产冬虫夏草()、贝母()、雪莲()等名贵中药材[16]。区域内覆盖龙胆()、金莲花()、木里薹草()、驴蹄草()等优势植物。
1.2 样地设置与样品采集
为研究泥炭生态系统从泥炭沼泽到沼泽草甸再到高寒草甸退化过程对气候变化的响应, 选取3个不同退化程度的泥炭地作为实验样地, 即泥炭沼泽S1(33°06′ 19″ N, 102°39′ 10″ E), 年平均水位为—2.0 cm; 沼泽草甸S2(33°06′ 15″ N, 102°39′ 05″ E), 年平均水位为—8.0 cm; 高寒草甸S3(33°06′ 00″ N, 102°38′ 52″ E), 年平均水位为—13.8 cm。样地基础养分状况见表1[17]。于2016年8月采集3个不同退化程度泥炭地中的土壤样品。每个区域内随机选择3个10×10 m的样方, 每个样地选取3个样点作为重复, 采集0—150 cm(0—30 cm、30—60 cm、60—90 cm、90—120 cm、120—150 cm)土壤作为研究材料。根据实验需要, 将土壤剖面分为土壤表层(< 30 cm)、土壤亚表层(30—60 cm)、土壤深层(> 60 cm)[18]。在样方内用直径为8 cm的泥炭钻插入土壤, 推进, 获得深度为150 cm的土柱样本, 立即用刀片以30 cm为1层进行分割, 用自封袋保存。并及时放于4 ℃冰箱进行保存, 避免挥发并减少微生物的活动。
1.3 测定方法
酚氧化酶活性测定采用L-DOPA法[19], β-葡萄糖苷酶活性测定采用硝基酚比色法[20], 蔗糖酶活性测定采用3, 5-二硝基水杨酸比色法[21], DOC含量测定采用湿氧化法[22]。
1.4 数据处理
数据的计算和分析统计主要采用SPSS 22.0、SigmaPlot 13.0、Origin 2019b等软件, 采用SPSS 22.0统计软件对不同退化泥炭地与不同土壤深度的土壤酶活性和DOC含量进行误差和显著性分析, 土壤酶活性与DOC变化数据主要采用SigmaPlot 13.0作图, 土壤酶活性与DOC相关性数据作图主要利用Origin 2019b完成。用方差分析检验处理间的效应, 用LSD法检验平均数之间的差异。
2 结果与分析
2.1 退化泥炭地土壤酶活性变化
退化泥炭地不同土层酚氧化酶活性介于2.370—6.940 μmol·g-1·min-1之间, 平均为3.575 μmol·g-1·min-1, 在S2和S3中表层土壤的酚氧化酶活性最高, 总体表现为随着土层厚度的增加呈先降低后升高再降低的趋势; 而在S1中亚表层中的酚氧化酶活性却为最高, 表现为随着土层厚度的增加总体呈现先升高后降低的趋势(图1, A)。3种不同泥炭地土样中, S3中的酚氧化酶活性最高, 平均达到了4.620 μmol·g-1·min-1,总体表现为S3>S2>S1。在S1、S2和S3中β-葡萄糖苷酶活性总量为2 122.674、4 036.203和1 577.332 ug·g-1·h-1。在S3中, 土壤表层的β-葡萄糖苷酶活性显著高于深层土壤(<0.05)(图1, B)。而在S1和S2中, 土壤表层与深层中的β-葡糖苷酶活性差异不显著(>0.05), 深度为60—90 cm中的β-葡萄糖苷酶活性达最高。关于土壤中的蔗糖酶, 在S1和S3中, 土壤深度为60—90 cm中的活性明显高于其它土壤深度(<0.05); 而在S2中, 土壤深度为90—120 cm下的蔗糖酶活性最高, 达到了13.893 mg·g-1, 且随着泥炭层深度增加呈逐渐升高的趋势(图1, C)。
2.2 退化泥炭地DOC变化特征
退化泥炭地中的DOC含量最高达到了445.043 mg·kg-1, 处于S3的表层土壤(图2)。其中, 土壤亚表层DOC总含量达到了867.783 mg·kg-1。S3中的DOC在垂直尺度上表现为逐渐降低的趋势, 其中表层含量最多, 表层和亚表层土壤DOC与深层土壤DOC存在显著性差异(<0.05)。S1和S2样地中亚表层DOC含量与其他土壤深度差异不显著(>0.05), 随着土层深度的增加呈现先升高后降低的变化趋势。随着泥炭沼泽向高寒草甸的演替类型变化, 亚表层土壤中DOC含量呈现逐渐上升的变化趋势。
2.3 退化泥炭地DOC与土壤酶活性相关分析
对DOC和3种酶活性进行逐步回归分析,从图3可以看出, 在S1和S3泥炭地中, DOC与酚氧化酶和蔗糖酶曲线呈极显著正相关, 而在S2泥炭地下, 曲线均呈负相关; DOC与β-葡萄糖苷酶在泥炭地退化演替过程中均呈现显著正相关趋势。其中, 在S1和S3泥炭类型下, 土壤DOC与酚氧化酶、β-葡萄糖苷酶、蔗糖酶活性的线性曲线拟合性较好, 有明显的线性关系, 而在S2类型下拟合性较弱。方程表明, 总体上土壤DOC对土壤酶活性均表现为正效应, 具有促进作用。随着泥炭地土壤DOC的增加, S1和S3条件下的酚氧化酶、β-葡萄糖苷酶、蔗糖酶活性随之增强。β-葡萄糖苷酶在3个样地中均与DOC表现出良好的正相关关系。

表1 不同退化泥炭地的土壤性质
注:数值为年平均值±标准误差, 表中数据同一土壤性质的不同字母表示差异显著(<0.05)。
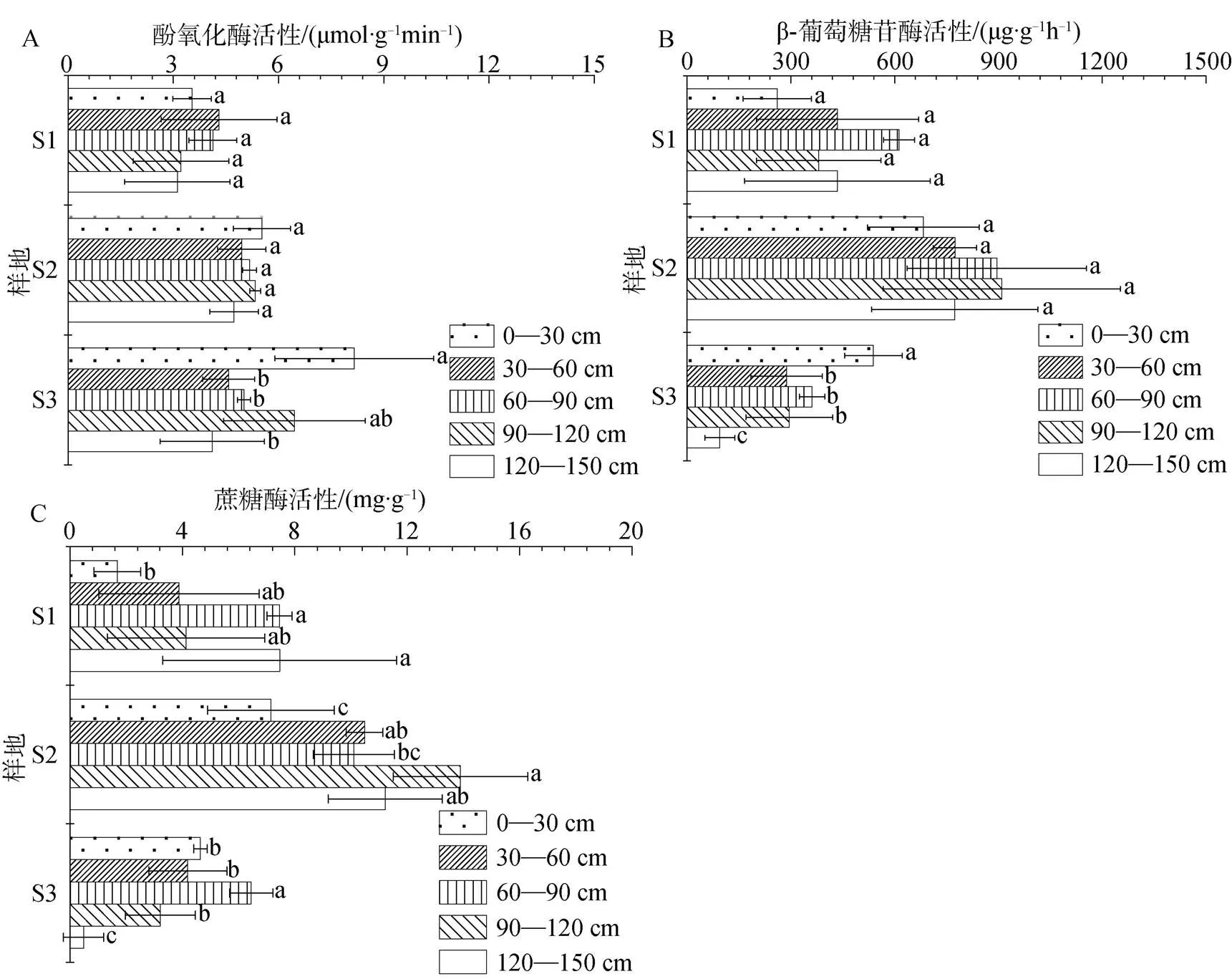
图1 不同退化程度泥炭生态系统和不同土壤深度的土壤酶(酚氧化酶、β-葡萄糖苷酶、蔗糖酶)分布特征。S1: 泥炭沼泽; S2: 沼泽草甸; S3: 高寒草甸。横条表示标准偏差(N = 3)。图中数据同一样地的不同字母表示差异显著(P<0.05)。
Figure 1 Distribution characteristics of soil enzymes (phenol oxidase, β-glucosidase, sucrase) in peat ecosystem with different degradation degree and soil depth. S1: Peat mire; S2: Swamp meadow; S3: Alpine meadow. Bars indicate standard deviation (= 3). Different letters in the same site indicate significant differences (<0.05).
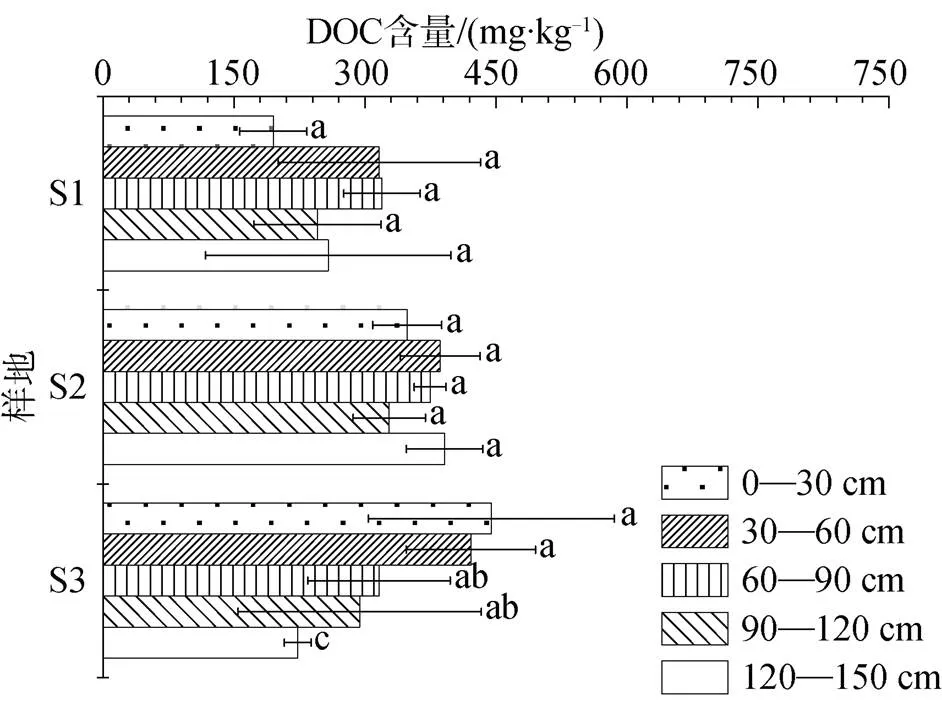
图 2 不同退化程度泥炭生态系统中土壤溶解性有机碳(DOC)变化规律特征。S1: 泥炭沼泽; S2: 沼泽草甸; S3: 高寒草甸。横条表示标准偏差(N = 3)。图中数据同一样地的不同字母表示差异显著(P<0.05)。
Figure 2 Variation characteristics of soil dissolved organic carbon (DOC) in peat ecosystem with different degradation degrees. S1: Peat mire; S2: Swamp meadow; S3: Alpine meadow. Bars indicate standard deviation (= 3). Different letters in the same site indicate significant differences (<0.05).
3 讨论
泥炭地作为一种典型湿地生态系统, 地上植被覆盖率高, 土壤中植物根系密集, 长期的冷湿、缺氧环境造成有机质分解缓慢, 碳净初级生产力超过其分解速率和其他途径碳损失[23]。在人为因素和气候变化的影响下, 处于好氧或温度升高条件下的泥炭沼泽表现出退化趋势, 造成地表植被覆盖度降低, 凋落物的累积减少, 微生物活性加强, 腐殖质矿化作用增强, 使土壤体积质量、孔隙度和通透性变差, 导致土壤的渗透能力下降[24]。有研究表明, 在近200年间, 全球湿地碳储量已减少了4.1 Pg[25]; 在近40年期间, 我国青藏高原地区湿地面积缩小了10%左右[26]。而泥炭地退化造成的水位降低, 改变着湿地的厌氧环境, 加速了碳的分解和释放。我们发现, 随着泥炭地从泥炭沼泽退化到沼泽草甸及高寒草甸, 表层和亚表层土壤中DOC含量都逐渐升高。泥炭地退化导致的逆行演替使得有机碳受水位和温度影响,水位降低或温度升高, 土壤氧化过程加剧, 使得泥炭地成为重要“碳源”, 表层泥炭有机质在有氧环境下会快速分解, 使得DOC输出增加, 并以二氧化碳形式排放到大气中[27]。从土壤DOC的垂直分布看, 本研究发现, 随着土壤深度增加, DOC含量大致呈下降趋势, 这与黄慧[28]的研究结果相似。这与凋落物和细根残体在土壤中的垂直分布有关[29-30], 表层土壤中的微生物种类和含量相较于深层土壤含量多, 高质量凋落物的分解速率更快, 土壤中的DOC含量更丰富[31-32]。随着土壤深度加深, 有机质含量减少, 土壤通气性变差, 氧气不足, 微生物活动受到限制, 微生物数量和酶活性受到抑制, 减缓了有机质的分解速率[33]。

图 3 土壤溶解性有机碳(DOC)与土壤酶活性回归曲线(S1: 泥炭沼泽; S2: 沼泽草甸; S3: 高寒草甸)
Figure 3 Regression curve of soil dissolved organic carbon (DOC) and soil enzyme activity(S1: Peat mire; S2: Swamp meadow; S3: Alpine meadow)
土壤酶作为湿地生态系统中DOC分解的重要功能性物质, 在微生物的作用下土壤酶会直接利用土壤中碳氮元素, 微生物也能通过酶促反应促进土壤中碳氮的转化。我们的结果显示, DOC含量受酚氧化酶、β-葡萄糖苷酶、蔗糖酶活性的直接影响。土壤酶活性可促进泥炭地中DOC的循环转化。本研究发现, β-葡萄糖甘酶可作为指示DOC分解的关键酶类, 因为它在不同水位变动条件下都和DOC保持良好的线性关系。Maslov等[34]表明, 泥炭地退化造成的水位下降和温度升高, 导致土壤中的腐殖质含量高, 以纤维素为养料的微生物密度增加, 微生物呼吸活性增强, 促使纤维素分解为多糖, 增加酶促反应速率, 使得β-葡萄糖苷酶含量升高。而β-葡萄糖苷酶活性增强也使微生物消耗新鲜植物凋落物中的碳和氮, 微生物活动受到刺激, 加速泥炭分解, 土壤微生物生物量碳增加[35], 有助于有机物分解和土壤生物化学转化。
前人认为酚氧化酶是影响泥炭地碳输出的关键因子, 与DOC含量呈正相关关系, 对全球生态系统碳循环产生深远影响[36-37]。酚氧化酶在泥炭地退化的过程中受水位变化、植被、氧含量变化以及温度等因素的影响。泥炭地退化过程中增加的维管束植物可使氧气通过根系扩散到地下, 促进酚氧化酶氧化酚类物质, 加快微生物的周转速率, 使胞外酶更好的发挥有机质分解的作用, 增加DOC的输入[38-39]。但本研究发现在不同退化及水位情况下, 酚氧化酶与DOC并不是恒定的正相关性, 其内在机理值得进一步探索。在泥炭地退化过程中, DOC与蔗糖酶活性的关系与酚氧化酶极其相似。可见, 蔗糖酶也是影响DOC分解的关键因子之一。在泥炭退化过程中, 土壤碳、氮转化酶的活性增强, 导致惰性碳组分分解, 释放蔗糖酶底物, 使蔗糖酶活性升高, 催化供微生物能量的低分子糖分解, 提高微生物活性, 进而促进有机质分解, 提高DOC的输出[40]。
全球气候变暖导致的泥炭地退化日益严重, 含碳温室气体排放不断增加。泥炭地退化造成的水位波动直接影响着含碳温室气体的排放, 对湿地碳能量流动及有机物生产传递转化过程产生影响[41]。土壤DOC在水位波动下, 极不稳定, 水位下降使泥炭易被微生物快速分解并释放二氧化碳。不同土壤深度的DOC对环境的响应程度不同, 受土壤酶活性的调控。在泥炭地退化过程中, 表层土壤DOC逐渐升高, 可能是由于DOC分解以二氧化碳形式释放, 也可能是DOC随水流进入水体。这两种方式均会对区域环境造成不利影响, 以二氧化碳排放将增加区域温室效应的正反馈, 而流入水体的DOC会造成有机酸积累、pH缓冲能力加剧、水体颜色加深、可见度降低等, 直接或间接影响各种生物的生存与发展, 导致生态系统结构的变化和功能的退化[42]。因此, 了解清楚泥炭地中DOC含量变化规律对全球气候变化和区域环境保护都有实质性的意义。
4 结论
本研究探讨了在泥炭地退化过程中土壤酶活性与土壤溶解性有机碳在不同深度下的变化规律以及土壤酶活性与碳输出间的关系, 研究结果表明:
1)泥炭地退化造成的好氧环境使得土壤微生物代谢活动加快, 增加了土壤酶活性。随着泥炭地退化程度的加深, 酚氧化酶活性逐渐增加, β-葡萄糖苷酶与蔗糖酶活性呈先升高后降低的变化趋势。土壤亚表层是泥炭地土壤有机碳含量和密度较高的层次, 酶活性较高, 其中, 高寒草甸的亚表层酚氧化酶活性与β-葡萄糖苷酶活性显著低于表层, 亚表层中的蔗糖酶活性与深层中的酶活性也存在显著差异。
2)关于土壤中的有机碳输出, 随着泥炭地的退化, DOC呈逐渐增加的变化趋势。高寒草甸中的亚表层DOC含量与深层存在显著性差异。土壤酶作为DOC分解和转化的主要参与者, 在不同水位条件下, β-葡萄糖苷酶都与DOC保持良好的线性关系, 可作为指示DOC分解的关键性酶类。
[1] CONG Jinxin, GAO Chuanyu, HAN Dongxue, et al. Stability of the permafrost peatlands carbon pool under climate change and wildfires during the last 150 years in the northern Great Khingan Mountains, China[J]. Science of The Total Environment, 2020, 712(2020): 1–11.
[2] RUDIYANTO, BUDIMAN M, BUDI I S, et al. Digital mapping for cost-effective and accurate prediction of the depth and carbon stocks in Indonesian peatlands[J]. Geoderma, 2016, 272(2016): 20–31.
[3] 张雪雯, 莫熠, 张博雅, 等. 干湿交替及凋落物对若尔盖泥炭土可溶性有机碳的影响[J]. 湿地科学, 2014, 12(2): 134–140.
[4] ZHANG Zhihui, WANG Chengshan, LV Dawei, et al. Precession-scale climate forcing of peatland wildfires during the early middle Jurassic greenhouse period[J]. Global and Planetary Change, 2020, 184(2020): 30–51.
[5] CHEN Wenqing, XU Ran, CHEN Jun, et al. Consistent responses of surface- and subsurface soil fungal diversity to N enrichment are mediated differently by acidification and plant community in a semi-arid grassland[J]. Soil Biology & Biochemistry, 2018, 127(2018): 110–119.
[6] ALISON H, MAGILL J D A. Variation in soil net mineralization rates with dissolved organic carbon additions[J]. Soil Biology & Biochemistry, 2000, 32(5): 597–601.
[7] 万忠梅, 宋长春, 郭跃东, 等. 毛苔草湿地土壤酶活性及活性有机碳组分对水分梯度的响应[J]. 生态学报, 2008, 28(12): 5980–5986.
[8] 万忠梅, 宋长春, 杨桂生, 等. 三江平原湿地土壤活性有机碳组分特征及其与土壤酶活性的关系[J]. 环境科学学报, 2009, 29(2): 406–412.
[9] 杨万勤, 王开运. 土壤酶研究动态与展望[J]. 应用与环境生物学报, 2002, 8(5): 564–570.
[10] SINSABAUGH R L. Phenol oxidase, peroxidase and organic matter dynamics of soil[J]. Soil Biology & Biochemistry, 2010, 42(3): 391–404.
[11] BHATTACHARYYA R, GHOSH A, ZHANG Yaqi, et al. Land use affects temperature sensitivity of soil organic carbon decomposition in macroaggregates but not in bulk soils in subtropical Oxisols of Queensland, Australia[J]. Soil & Tillage Research, 2020, 198(2020): 1–8.
[12] 孙锋, 赵灿灿, 李江涛, 等. 与碳氮循环相关的土壤酶活性对施用氮磷肥的响应[J]. 环境科学学报, 2014, 34(4): 1016–1023.
[13] BOERNER R E J, BRINKMAN J A. Fire frequency and soil enzyme activity in southern Ohio oak–hickory forests[J]. Applied Soil Ecology, 2003, 23(2): 137–146.
[14] ZHOU Bin, ZHAO Lixia, WANG Yuebo, et al. Spatial distribution of phthalate esters and the associated response of enzyme activities and microbial community composition in typical plastic-shed vegetable soils in China[J]. Ecotoxicology and Environmental Safety, 2020, 195(2020): 1–10.
[15] MONTES G, SOLANO-CAMPOS F, VEGA-BAUDRIT J R, et al. Environmentally relevant concentrations of silver nanoparticles diminish soil microbial biomass but do not alter enzyme activities or microbial diversity[J]. Journal of Hazardous Materials, 2020, 391(2020): 1–10.
[16] LI Jinchang, WANG Wenli, HU Guangyin, et al. Changes in ecosystem service values in Zoige Plateau, China[J]. Agriculture, Ecosystems & Environment, 2010, 139(4): 766–770.
[17] YANG Gang, TIAN Jianqing, CHEN Huai, et al. Peatland degradation reduces methanogens and methane emissions from surface to deep soils[J]. Ecological Indicators, 2019, 106(2020): 1–7.
[18] 胡云龙, 白银萍, 董发勤, 等. 泥炭地亚表层含碳温室气体排放及其影响因素[J]. 应用与环境生物学报, 2018, 24(2): 395–400.
[19] DUNN C, JONES T G, GIRARD A, et al. Methodologies for Extracellular Enzyme Assays from Wetland Soils[J]. Wetlands, 2014, 34(1): 9–17.
[20] 陈艳鑫, 耿玉清, 黄金, 等. 青海湖鸟岛地区不同淹水条件下土壤酶活性的差异及其影响因素[J]. 生态学杂志, 2019, 38(3): 735–743.
[21] 骆爱兰, 余向阳. 氟啶胺对土壤中蔗糖酶活性及呼吸作用的影响[J]. 中国生态农业学报, 2011, 19(4): 902–906.
[22] 张雪雯, 莫熠, 张博雅, 等. 干湿交替及凋落物对若尔盖泥炭土可溶性有机碳的影响[J]. 湿地科学, 2014, 12(2): 134–140.
[23] BAO Kunshan, ZHAO Hongmei, XING Wei, et al. Carbon Accumulation in Temperate Wetlands of Sanjiang Plain, Northeast China[J]. Soil Science Society of America Journal, 2011, 75(6): 2386–2397.
[24] 刘克宏, 王立, 马维伟, 等. 尕海泥炭地退化过程中土壤渗透特征的变化[J]. 土壤, 2016, 48(4): 813–818.
[25] ROULET N T, LAFLEUR P M, RICHARD P J H, et al. Contemporary carbon balance and late Holocene carbon accumulation in a northern peatland[J]. Global Change Biology, 2007, 13(2): 397–411.
[26] ZHANG Yu, WANG Genxu, WANG Yibo. Changes in alpine wetland ecosystems of the Qinghai–Tibetan plateau from 1967 to 2004[J]. Environmental Monitoring and Assessment, 2011, 180(4): 189–199.
[27] Freeman C, Fenner N, Ostle N J, et al. Export of dissolved organic carbon from peatlands under elevated carbon dioxide levels[J]. Nature, 2004, 430(6996): 195–198.
[28] 黄慧. 成都龙泉驿区不同土地利用方式下土壤可溶性有机质含量的研究[D]. 成都: 四川师范大学, 2013.
[29] 杜俊龙, 孙霞, 李志军. 典型干旱荒漠区枣园土壤有机碳与土壤酶活性变化及相关研究[J]. 陕西农业科学, 2016, 5(62): 1–5.
[30] ZHANG Yue, ZHAO Dongfeng, LIN Jinshi, et al. Impacts of collapsing gullies on the dynamics of soil organic carbon in the red soil hilly region of southeast China[J]. CATENA, 2020, 190(2020): 1–9.
[31] 肖好燕, 刘宝, 余再鹏, 等. 亚热带典型林分对表层和深层土壤可溶性有机碳、氮的影响[J]. 应用生态学报, 2016, 27(4): 1031–1038.
[32] SRIVASTAVA P, SINGH R, BHADOURIA R, et al. Temporal change in soil physicochemical, microbial, aggregate and available C characteristic in dry tropical ecosystem[J]. CATENA, 2020, 190(2020): 1–19.
[33] 张晓雅, 胡益珩, 安菁, 等. 若尔盖泥炭沼泽土壤中可溶性有机碳含量对降水变化的响应[J]. 湿地科学, 2018, 16(4): 546–551.
[34] MASLOV M N, MASLOVA O A. Temperate peatlands use-management effects on seasonal patterns of soil microbial activity and nitrogen availability[J]. CATENA, 2020, 190(2020): 1–9.
[35] PARVIN S, BLAGODATSKAYA E, BECKER J N, et al. Depth rather than microrelief controls microbial biomass and kinetics of C-, N-, P- and S-cycle enzymes in peatland[J]. Geoderma, 2018, 324(2018): 67–76.
[36]XING Xueci, LI Tong, BI Zhihao, et al. Efficient removal of disinfection by-products precursors and inhibition of bacterial detachment by strong interaction of EPS with coconut shell activated carbon in ozone/biofiltration[J]. Journal of Hazardous Materials, 2020, 392(2020): 1–11.
[37] LIU Liangfeng, CHEN Huai, ZHU Qiuan, et al. Responses of peat carbon at different depths to simulated warming and oxidizing[J]. Science of The Total Environment, 2016, 548(2016): 429–440.
[38] MA Qingxu, WEN Yuan, WANG Deying, et al. Farmyard manure applications stimulate soil carbon and nitrogen cycling by boosting microbial biomass rather than changing its community composition[J]. Soil Biology and Biochemistry, 2020, 144(2020): 1–11.
[39] FANG Xiong, ZHOU Guoyi, QU Chao, et al. Translocating subtropical forest soils to a warmer region alters microbial communities and increases the decomposition of mineral-associated organic carbon [J]. Soil Biology and Biochemistry, 2020, 142(2020): 1–9.
[40] 蒋磊, 宋艳宇, 宋长春, 等. 大兴安岭冻土区泥炭地土壤碳、氮含量和酶活性室内模拟研究[J]. 湿地科学, 2018,16(3): 294–302.
[41] ZHANG Li, MITSCH W J. Sediment chemistry and nutrient influx in a hydrologically restored bottomland hardwood forest in Midwestern USA[J]. River Research and Applications, 2007, 23(9): 1026–1037.
[42] 张娜, 张心昱, 高鲁鹏. 长期监测水体可溶性有机碳变化趋势与影响因子研究进展[J]. 水土保持研究, 2009, 16(3): 286–290.
Study on the changes of enzyme activity and DOC in subsoil of degraded peatland
CAO Qin1, LIU Jianliang2,3, LIU Kun4, ZENG Jia1, YAN Fei1, YANG Gang1,*
1. School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang 621010, China 2. Key Laboratory of Mountain Ecological Restoration and BioresourceUtilization, Chengdu Institute of Biology, Chengdu 610041, China 3.Zoige Wetland Ecosystem Research Station, Chinese Academy of Sciences, Hongyuan 624400, China 4. Solid Waste and Soil Research Institute of Chongqing Academy of Ecological and Environmental Sciences, Chongqing 401147, China
Under the background of climate change, soil organic carbon at subsurface gradually participates in the carbon cycle. In this study, the peat mire (S1), swamp meadow (S2) and alpine meadow (S3) at Riganqiao provincial wetland reserve, Hongyuan County were chosen to reveal the relationship between the subsurface soil carbon output and soil enzyme activity.Different soil depths (0-30 cm, 30-60 cm, 60-90 cm, 90-120 cm and 120-150 cm) in three different degraded peatland ecosystems were sampled. Soil enzyme activities (phenol oxidase, β-glucosidase, sucrase) and dissolved organic carbon (DOC) in peat surface, subsurface and deep layer were measured.The results showed that DOC increased gradually during the degradation process from peat swamp to swamp meadow and alpine meadow. With the deepening of the degradation degree of peat land, the soil enzyme activity increased first and then decreased. From the vertical direction, the DOC of peat swamp and swamp meadow increased gradually from surface to subsurface, while that of alpine meadow decreased from surface to subsurface. Phenol oxidase activity in surface soil was higher than that in deep soil, while the activity of β-glucosidase and sucrase in deep soil was higher than that in surface and subsurface soil. The activities of phenol oxidase, β-glucosidase and sucrase affect the content of DOC directly. β-glucosidase has a good linear relationship with DOC under different water levels, which can be used as a key enzyme to indicate DOC decomposition.
peatland; subsurface; phenol oxidase; β-glucosidase; sucrase; dissolved organic carbon
曹芹, 刘建亮, 刘坤,等.退化泥炭地亚表层土壤酶活性与DOC变化规律研究[J]. 生态科学, 2022, 41(5): 144–151.
CAO Qin, LIU Jianliang, LIU Kun, et al. Study on the changes of enzyme activity and DOC in subsoil of degraded peat[J]. Ecological Science, 2022, 41(5): 144–151.
10.14108/j.cnki.1008-8873.2022.05.018
X53
A
1008-8873(2022)05-144-08
2020-08-28;
2020-09-23
四川省科技计划(2020YFS0020);国家自然科学基金项目(42077038); 西南科技大学学生创新基金项目(19ycx0072); 重庆市生态环境局科研项目(2019-130)
曹芹(1995—), 女, 四川武胜人, 硕士, 主要从事湿地生态学研究, E-mail: 3050806616@qq.com
杨刚, 男, 副研究员, 主要从事湿地生态学, 全球变化生态学等方面研究, E-mail: yanggang903@163.com
