油蒿扩繁丛枝菌根真菌的效果及土壤条件优化研究
2022-08-04山宝琴宋惠子李嘉怡秦爽凌小嫒李婧
山宝琴, 宋惠子, 李嘉怡, 秦爽, 凌小嫒, 李婧
油蒿扩繁丛枝菌根真菌的效果及土壤条件优化研究
山宝琴1,2,*, 宋惠子1, 李嘉怡1, 秦爽1, 凌小嫒1, 李婧1
1. 延安大学石油工程与环境工程学院, 陕西延安 716000 陕西省区域生物资源保育与利用工程技术研究中心,陕西延安 716000
为验证油蒿()作为宿主植物扩繁AM真菌的潜能, 试验选用了艾蒿、三叶草、黑麦草和紫花苜蓿4种植物为对照, 采用盆栽方法研究培养30 d、60 d、100 d后植物根围AM真菌孢子密度的变化, 测定了100 d后植物根系的真菌菌丝侵染率、丛枝侵染率, 并针对油蒿研究了不同类别土壤对其扩繁的影响, 分析孢子密度与土壤理化因子的相关性。结果表明: 油蒿和艾蒿两种植物的菌丝侵染率平均值约达40%, 显著高于其它3种植物(23%— 25%), 表现出与AM真菌良好的共生性。以油蒿为宿主经过100 d扩繁后, 其根围孢子密度平均达57个·10g-1干土, 显著高于其它4种植物。油蒿扩繁最大值出现在60 d, 其它4种植物虽然孢子密度随培养时间的延长而增加, 但60 d—100 d增长不显著, 建议60 d为AM真菌盆栽扩繁最佳期限。相关分析表明植物根围AM真菌孢子密度与真菌菌丝侵染率、土壤速效磷呈显著正相关, 但与土壤pH值呈负相关性。当选用油蒿为宿主植物分别4种土壤类型进行AM真菌扩繁时, 土壤养份较高的腐殖质土孢子密度最大。
丛枝菌根真菌; 植物扩繁; 油蒿
0 前言
丛枝菌根(Arbuscular Mycorrhizal, AM)真菌属于真菌界球菌门, 通过侵染高等植物根系后菌丝二分叉形成丛枝状共生互惠结构—菌根[1], 植物繁茂的根系提供了真菌生存需要的微环境, 而真菌延伸的菌丝又成为植物与土壤间的桥梁, 约有90%的陆生植物能够利用AM真菌从土壤中获取需要的营养成分, 从而提高自身的活性与抗逆性[2-3]。AM 真菌是土壤有机碳库的主要来源之一[4-5], 菌丝能促进土壤团粒结构的形成及稳定, 对退化土壤和污染土壤修复都有一定的改善作用[6-7], 使得它在提高土壤环境质量、稳定生态系统等方面有着非常广阔的应用前景。因此如何批量生产AM 真菌, 以获得稳定的工程菌剂已成为菌根生物技术应用的要点。
真菌和植物之间存在的双向物质交换是丛枝菌根互惠共生的生理基础[8], AM真菌的完整生活史必须依靠宿主植物根系所提供的碳水化合物, 从而决定了真菌产孢过程对宿主植物的依赖性, 这使得AM真菌人工纯培养难以突破。通过盆栽植物活体扩繁依然是国内目前最经典与常用的方法[9], 周霞等[10]以玉米和红三叶草为宿主, 江龙等[11]以烟草为宿主植物, 研究了不同扩繁基质对AM真菌繁殖的影响。陈宁等[12]认为扩繁土壤的沙土比是关键的培养因子。大量的野外研究证明, AM真菌与共生植物之间虽无严格的专一性, 但随宿主植物不同, AM真菌的侵染率、产孢量以及菌根效应都不同[13], 表明植物与真菌之间的共生关系有一定的相互选择性[14]。AM真菌的扩繁应该首先是针对宿主植物的筛选, 李媛媛等[15]的研究首选根系发达的草本植物, 如三叶草、紫花苜蓿、烟草、黑麦草等, 那么选择须根发达且与AM真菌有良好共生性的油蒿做为宿主植物[16], 对于获得量大且优质的AM菌剂可能有更显著的效果。
油蒿()属于菊科蒿属多年生草本植物, 是半固定沙地先锋物种[17], 其根系沙埋后能通过产生不定根进行无性繁殖, 根系发达且须根丰富。野外调查研究表明油蒿根系与AM真菌有极好的共生性, 且根围AM真菌孢子密度较高[16], 因此本研究选用油蒿为宿主植物, 以AM真菌扩繁研究的优选植物三叶草()、黑麦草()[10, 15]及陕北荒地恢复中常见草本植物艾蒿)、紫花苜蓿()作为参照, 通过实验室盆栽试验, 旨在筛选出最佳扩繁植物, 验证油蒿活体扩繁AM真菌的效果, 为丛枝菌根菌剂的制备和应用提供新的材料和科学依据, 也为退化土壤以及污染土壤的菌根修复技术寻找突破口。
1 材料与方法
1.1 研究材料
1.1.1 菌种
AM真菌自野外土壤分离后先在显微镜下通过形态鉴定确定优势属种及占比率, 其中球囊霉属()的约占85%、无梗囊霉属()的约占15%。在体视镜下筛选饱满、有活性的真菌孢子, 植物出苗后按照50个每盆接种于植物根围约2 cm深土壤中。
1.1.2 宿主植物
选用油蒿、艾蒿、三叶草、黑麦草和紫花苜蓿作为宿主植物, 植物种子用0.5% H2O2溶液消毒10 min, 无菌水冲洗5次, 盆栽前经过种子发芽实验确定出芽率。
1.1.3 栽培基质
①5种植物对比试验所用栽培基质: 为延安大学树木园黄绵土和细沙土以3:1比例混合。土壤背景值为: 有机质23 mg·g-1, 速效氮21.5 μg·g-1, 速效磷12.59 μg·g-1, 速效钾160 μg·g-1, pH 7.5。
②以油蒿为唯一宿主, 不同土壤类型对比试验: 所用基质为4种, 其中流动沙地与半固定沙地土壤, 取自陕北毛乌素沙漠(109°10′28″E, 37°23′ 56″N )背风缓坡沙丘的下部; 轻质黄绵土与腐殖质土, 取自延安大学树木园(109°32′06″ E, 36°35′12″ N),该园是由国家林业局于 1980 年下达陕西省林科院在延安建立的我国第一个黄土高原树木园, 引种了许多珍贵树种, 土壤类别多样。土壤样品风干后, 利用高压灭菌法(121 ℃, 0.1 MPa)灭菌120 min。
1.2 实验设计
盆栽试验选取直径为15 cm, 高25 cm的塑料制盆作为培养器皿, 用95%酒精对培养器皿进行消毒, 然后用蒸馏水冲洗。每盆装1.5 kg土壤基质。播种时挑选均匀、饱满、健康的宿主植物种子, 按照30株/盆播种, 覆盖约2 cm的土壤, 出苗后间苗至15株/盆, 间苗后在根围2—5cm土层接种AM菌种。5种植物, 每种植物设定三组平行样品, 共计15盆。并且每个样品采样测定三次, 共计45个。实验期间平均温度为22 ℃(白天)和16 ℃(夜间), 相对湿度60%。
实验共100 d, 分别于30 d、60 d和100 d采集一次土壤样品, 100 d后采收植物根系。
1.3 主要测定方法
1.3.1 土壤理化因子测定: 土壤 pH采用电位法、土壤有机质采用重铬酸钾容量—外加热法、土壤速效磷测定用NaHCO3浸提—钼锑抗比色法, 土壤速效氮含量用碱解扩散法[18]。
1.3.2 AM真菌孢子密度: 用湿筛倾注蔗糖离心法[19]对10 g风干土壤中的AM真菌孢子进行分离。在体视镜下挑取AM真菌孢子进行计数, 将每10 g风干土中的含孢量计为孢子密度。
1.3.3 菌根侵染率测定: 将收集的根样切成1 cm的根段, 用KOH透明—乳酸甘油酸性品红染色法测定根组织内菌丝的侵染发育状况[20]。选取25条约1.0 cm长的细根压扁后, 采用细根的面积来分别计算菌丝、丛枝和泡囊等的侵染情况, 置于Olympus BXSO型显微镜下观测计算根系的菌根侵染率。
1.4 数据处理
数据采用 SPSS18.0生物统计软件进行单因素方差(One–Way ANOVA)分析和两两相关(Pearson)分析, Excel软件制图。
2 结果与分析
2.1 不同宿主植物对AM真菌侵染率及繁殖的影响
宿主植物培养100 d后, 分析土壤中AM真菌孢子密度和植物根系真菌侵染率。由图1可知, 5种植物根围AM真菌菌丝侵染率随物种不同差异显著。油蒿和艾蒿两种蒿属植物的菌丝侵染率平均值约40%, 显著高于黑麦草、三叶草和紫花苜蓿, 后3种植物间菌丝侵染率为23%—25%, 无显著差异。5种植物根围AM真菌丛枝侵染率极低, 三叶草的丛枝侵染率最高, 平均值达3.5%, 紫花苜蓿最低(0.9%), 但不同植物间差异未达显著性。采用不同宿主植物经过相同培养时间后, AM真菌孢子繁殖结果差异显著。以油蒿为宿主经过100d扩繁后, 其根围孢子密度平均达57个·10g-1干土, 而其它4种植物根围孢子密度平均值只在20—26个·10g-1干土之间, 油蒿扩繁效果显著好于其它对照。
2.2 扩繁时间对AM真菌繁殖的影响
根据30 d、60 d和100 d培养时间不同, 分析不同宿主植物根围土壤中AM真菌孢子密度的变化, 结果如图2所示, 黑麦草、三叶草、艾蒿和紫花苜蓿呈现同样的规律, 都是孢子密度随着培养时间的延长而增加, 最大值出现在100 d。其中黑麦草、艾蒿和紫花苜蓿30 d数值较低, 60 d后有显著增长, 但60 d和100 d之间差异并不显著。说明同时考虑扩繁数量和时间两个参数, 60 d为最佳培养期限。油蒿的孢子密度随培养时间先升后降, 30 d至60 d有显著增长, 扩繁效果极好, 但延长至100 d反而有显著下降。试验中观察到, 60 d时油蒿根围土壤中有新产生的孢子囊, 以及破裂后出现的量大而密集的小孢子果; 100 d时新生孢子体积增大但数量减少, 很可能由于是盆栽容积有限, 土壤中养分竞争而导致的生物自疏现象。因此, 综合5种植物孢子密度随培养时间的变化, 60天应该是盆栽扩繁的最佳期限。

注: 小写字母不同表示不同植物在ρ< 0.05水平上差异显著; 下同。
Figure 1 Spore density and infection rate of AM fungi in the rhizosphere of host plant
2.3 不同土壤类型对油蒿扩繁AM真菌的影响
从5种植物中选取扩繁量最高的油蒿进一步研究其扩繁适宜的土壤条件。从表1中分析, 半固定沙土、固定沙土、黄绵土、腐殖质土的营养物质含量依次明显增加, 达到显著差异, 腐殖质土的养分状态和土壤脲酶活性最好。从图3中分析可知, AM真菌菌种在四种不同土壤中经共生扩繁后第60 d时, 孢子密度的增长随土壤类别不同也呈现出显著差异, 腐殖质土 > 黄绵土 > 固定沙土 > 半固定沙土, 与土壤中有机质、速效氮和速效磷等的变化趋势一致。说明盆栽扩繁过程中, 孢子繁殖效果受到土壤养分及土壤酶活性的显著影响。本研究表明, 采用油蒿扩繁AM真菌, 营养丰富的腐殖质土是最佳匹配。
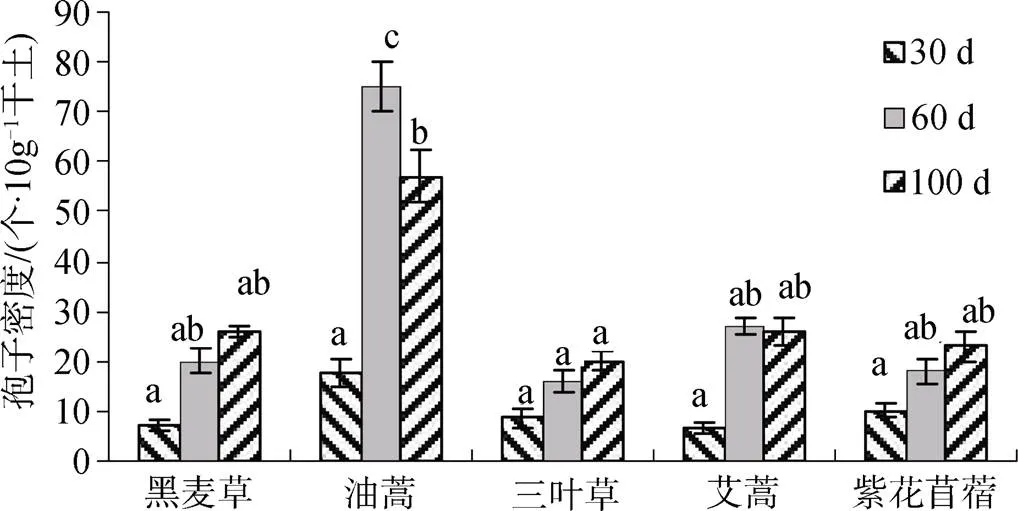
图 2 培养时间与AM真菌孢子密度关系
Figure 2 Relationship between spore density of AM fungi and time
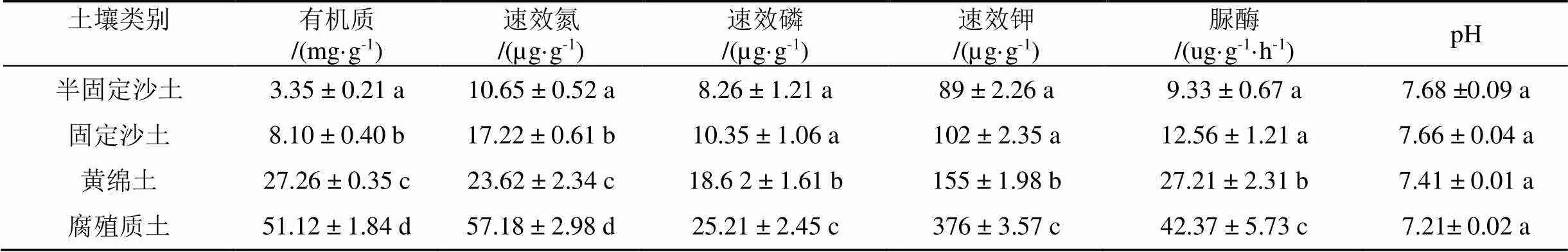
表1 4种土壤类型理化性质分析
分析不同土壤类别随培养时间所展现的效果, 30 d时黄绵土和腐殖质中孢子密度略高, 60 d时黄绵土和腐殖质土显著高于两种沙土, 到100 d时, 腐殖质土中的孢子密度是半固定沙土的2.3倍。
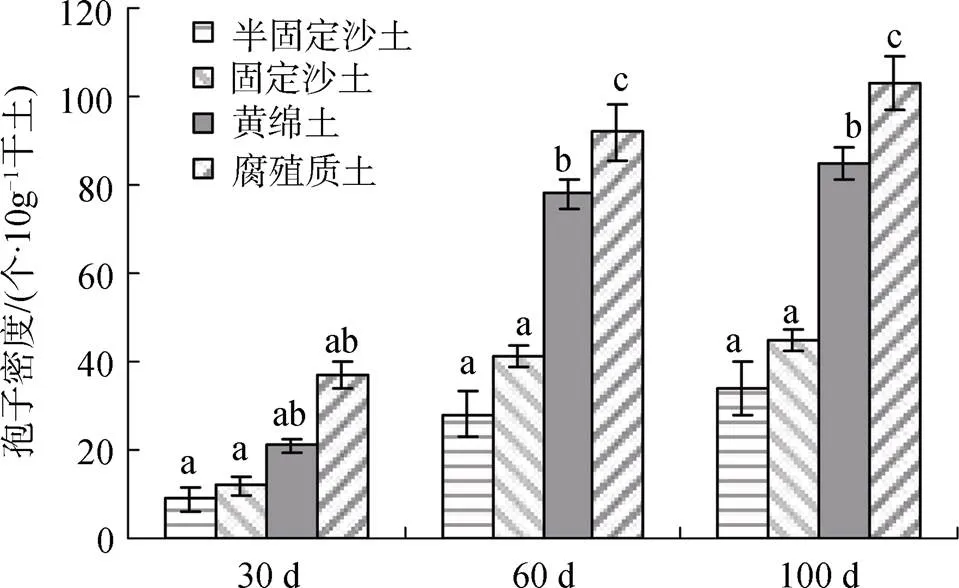
图3 不同土壤类型对AM真菌孢子密度的影响
Figure 3 Effect of different soil types on spore density of AM fungi
2.4 相关性分析
研究于100 d后一次性采收植物根系并统计分析AM真菌侵染率, 因此采用100 d时土壤理化因子数据进行两两相关分析。结果表明, 植物根围AM真菌孢子密度与土壤速效磷、菌丝侵染率呈显著正相关, 与土壤pH呈显著负相关。菌丝侵染率和土壤有机质呈显著负相关。丛枝侵染率与土壤速效磷呈显著负相关。
3 讨论
AM真菌与宿主植物间是一种偏利的互惠共生关系, 植物获取土壤养分的难易程度决定了两者间关系的紧密性, 油蒿长期适应严酷的荒漠环境, AM真菌能有效促进植物对有效态氮及有机磷的吸收和利用, 从而协助油蒿抵御外界不良环境。以植物活体为宿主时, 丛枝菌根真菌的扩繁效果受制于宿主植物与菌种本身的生物特性, AM真菌作为共生真菌对宿主植物具有一定的选择性[21], 须根发达且有良好共生性的宿主植物能为真菌孢子繁殖提供良好的微环境。菌丝在土壤中大量生长延伸了植物根系的吸收面积, 同量也是植物根系皮层细胞中物质传递的器官, 丛枝是共生体物质及信息交换的界面。作为宿主植物对AM真菌的响应, 菌根侵染率是 AM 真菌与宿主植物的共生关系的最佳体现。三叶草和紫花苜蓿等由于易培养且根系生物量大, 常常作为AM 真菌扩繁的优选植物[15, 22], 然而本研究中蒿属的两种植物菌丝侵染率显著更高, 具备扩繁真菌的优良条件。以油蒿为宿主经过100 d扩繁后, 其根围孢子密度平均达57个·10g-1干土, 而其它4种植物根围孢子密度平均值只在20—26个·10g-1干土之间, 油蒿扩繁效果显著高于其它对照。油蒿须根繁盛, 可以占到其总根生物量的70%以上[23], 长期生长在荒漠恶劣环境中从而进化出与丛枝菌根的相互依赖的共生策略。

表 2 AM真菌孢子密度及侵染率与其它因子相关性分析表(n=45)
注: *表示两者之间在<0.05水平上有显著相关性。
AM真菌生长繁殖所需的碳源均来源于宿主植物[14], AM真菌孢子繁殖需要经过原孢子萌发, 萌发管生长, 真菌与植物根系双重识别, 菌丝延伸和营养传递等多个环节。孢子繁殖经历适应期, 快速增长期然后趋于饱和, 生物种群繁殖的世代重叠连续增长近似“J”形, 即随时间增长而增长, 但在盆栽的有限空间及资源条件下, 培养后期增长极缓慢。
AM 真菌为好氧性真菌, 野外调查表明孢子密度在土壤垂直剖面上最大值出现在 0—10 cm土层[24],因此本研究植物根围真菌接种深度也设定在土壤表层。AM真菌孢子繁殖主要受到土壤理化条件, 植物亲和性及菌丝侵染率的影响。相关分析表明植物根围AM真菌孢子密度与土壤速效磷、菌丝侵染率呈显著正相关, 但是与土壤pH值呈负相关性。AM 真菌根外菌丝体可为土壤中的解磷细菌提供营养元素, 促进其生长延伸, 从而提高土壤中磷的活化及植物对磷的吸收利用, 因此AM真菌能控制土壤中磷的流失, 降低土壤磷对植物生长的限制作用[25-26]。袁月等[27]认为植物生长和生理指标对不同土壤pH有积极响应, 朱红惠等[28]和任爱天等[29]研究表明AM真菌更适于在中性偏酸的土壤中生长, 本研究中AM真菌孢子密度与土壤pH呈显著负相关, 碱性土壤对真菌繁殖有抑制作用。
菌丝是AM真菌与植物间的地下桥梁, 是物质与信息交换的界面, 通过真菌庞大的地下菌丝网, 植物间矿质营养元素可以实现再分配[30]。Douds等[31]用百喜草作为宿主植物, 发现孢子密度和菌根的侵染率存在显著的正相关关系, 本研究呈现相同的规律。
4 结论
(1) 油蒿根系发达且与AM真菌有良好的共生性, 做为宿主植物能为AM真菌孢子繁殖提供良好的微环境, 本研究数据显示油蒿是AM真菌扩繁的良好宿主植物。
(2) 由于植物盆栽的空间及养分资源有限, 兼顾到盆栽扩繁的时间及数量效果, 以油蒿为宿主植物时建议60 d为AM真菌最佳培养期限。
(3) 油蒿虽然是半固定沙土先锋物种, 但是其根围真菌繁殖受到土壤养分的显著影响。4种研究土壤中养份较高的腐殖质土, 是最适合油蒿扩繁AM真菌的土壤类别。
综上所述, 5种供试植物间比较, 油蒿更具有做为优良宿主植物的潜质, 值得进一步细化研究其扩繁条件。
[1] 王幼珊, 刘润进. 球囊菌门丛枝菌根真菌最新分类系统菌种名录[J].菌物学报, 2017, 36(7): 820–850.
[2] 张峰, 南志标, 闫飞扬, 等. 丛枝菌根真菌在草地生态系统碳汇中的重要作用[J].草业学报, 2015, 24 (4): 195–200.
[3] 祝英, 熊俊兰, 吕广超, 等. 丛枝菌根真菌与植物共生对植物水分关系的影响及机理[J].生态学报, 2015, 35(8): 2419–2427.
[4] BARRETT G, CAMPBELLl C D, FITTER A H, et al. The arbuscular mycorrhizal funguscan capture and transfer nitrogen from organic patches to its associated host plant at low temperature [J]. Applied Soil Ecology, 2011, 48 (1): 102–105.
[5] RILLIG M C, WRIGHT S F, EVINER V T. The role of arbuscular mycorrhizal fungi and glomalin in soil aggregation: comparing effects of five plant species[J]. Plant and Soil, 2002(238): 325–333.
[6] 山宝琴, 屈萌萌, 李皎, 等. 丛枝菌根真菌与植物共生修复陕北石油污染土壤[J]. 草业学报, 2016, 25(7): 87–94.
[7] LEUNG H M, WANG Z W, YE Z H, et al. Interactions between arbuscular mycorrhizae and plants in phytoremediation of metal - contaminated soils: a review[J]. Pedosphere, 2013, 23(5): 549–563.
[8] SMITH S E, SMITH F A. Structure and function of the interfaces in biotrophic symbioses as they relate to nutrient transport [J]. New Phytologist, 1990(114): 1–38.
[9] 杨晓红, 孙中海, 邵菊芳. 丛枝菌根真菌培养方法研究进展[J]. 菌物学报, 2014, 23(3): 444– 456.
[10] 周霞, 崔明, 秦永胜, 等. 扩繁条件对3种丛枝菌根真菌(AMF) 的影响[J]. 中国农学通报, 2012, 28(12): 83–87.
[11] 江龙, 王茂胜, 黄建国, 等. 不同基质对接种丛枝菌根真菌烟苗生长和营养状况的影响[J].山地农业生物学报, 2010, 29(2): 100–103.
[12] 陈宁, 王幼珊, 蒋家珍, 等. 培养基质对丛枝菌根(AM)真菌生长发育的影响[J]. 农业工程学报, 2007, 23(9): 205–207.
[13] KLIRONOMOS J N. Feedback with soil biota contributes to plant rarity and invasiveness in communities [J]. Nature, 2002(417): 67–70.
[14] 祝英, 刘英霞, 巩晓芳, 等. 3 种丛枝菌根真菌与3种寄主植物的共生关系[J]. 微生物学通报, 2016, 43(3): 527–533.
[15] 李媛媛, 王晓娟, 豆存艳, 等. 四种宿主植物及其不同栽培密度对AM真菌扩繁的影响[J]. 草业学报, 2013, 22(5): 128–135.
[16] 山宝琴, 贺学礼. 2 种沙蒿根围 AM 真菌时空分异[J].干旱区研究, 2011, 28(5): 813–819.
[17] 林鎔, 林有润. 中国植物志(第七十六卷第二分册)[M]. 北京:科学出版社, 1991.
[18] 鲁如坤.土壤农业化学分析方法[M]. 北京:中国农业科技出版社, 2000.
[19]IANSON D C, ALLEN M F. The effects of soil texture on extraction of vesicular arbuscular mycorrhizal fungal spores from arid soils [J]. Mycologia,1986(78):164–168.
[20] PHILLIPS J M, HAYMAN D S. Improved procedures for clearing roots and staining parasitic and vesicular- arbuscular mycorrhizal fungi for rapid assessment of infection[J].Transactions of the British Mycological Society, 1970, 55 (1): 158–161.
[21] 郝晓红, 索培芬,王俊, 等. 丛枝菌根真菌与宿主植物识别共生的分子机制[J]. 草地学报, 2012, 20 (5):800–804.
[22] 李嫒嫒. 不同紫花苜蓿基因型对AM真菌的响应以及AM真菌扩繁的研究[D]. 甘肃兰州:兰州大学, 2010:17.
[23] 秦艳, 胡永宁, 王林和. 毛乌素沙地臭柏、油蒿群落细根生产与生长过程中养分的动态[J]. 中国草地学报, 2013, 35(5): 96–102.
[24] 山宝琴, 贺学礼, 白春明, 等. 荒漠油蒿根围AM真菌分布与土壤酶活性[J]. 生态学报, 2009, 26(6): 813–819.
[25] 王岩, 邢丹, 宋拉拉. AM真菌对石漠化地区桑树的促生及养分调控作用研究[J]. 热带作物学报, 2020, 41(1): 7–14.
[26] ZHANG S J, GUO X Y, YUN W F, et al. Arbuscular mycorrhiza contributes to the control of phosphorus loss in paddy fields [J]. Plant and Soil, 2020(447): 623–636.
[27] 袁月, 代志国, 张丙秀, 等. 土壤pH对蓝莓生理特性的影响[J]. 西北植物学报, 2019, 39(8): 1434–1443.
[28] 朱红惠, 姚青. pH值对孢子萌发、菌丝生长与聚磷酸盐含量的影响[J]. 菌物学报, 2006, 25(1): 120–124.
[29] 任爱天, 鲁为华, 杨洁晶, 等. 石河子绿洲区苜蓿地丛枝菌根真菌的多样性及与土壤因子的关系[J]. 草业科学, 2014, 31 ( 9) : 1666–1672.
[30] 陈永亮, 陈保冬, 刘蕾, 等. 丛枝菌根真菌在土壤氮素循环中的作用[J]. 生态学报, 2014, 34 (17): 4807–4815.
[31] DOUDS D D, SCHENCK N C. Increased sporulation of vesicular-arbuscular mycorrhizal fungi by manipulation of nutrient regimens[J]. Applied and Environmental Microbiology, 1990, 56(2): 413–418.
Effect ofas host plant on the propagation of arbuscular mycorrhizae fungi and soil condition optimization
SHAN Baoqin1,2,*, SONG Huizi1, LIJiayi1, QINShuang1, LING Xiaoyuan1, LI Jing1
1.School of Petroleum Engineering and Environmental Engineering, Yan’an University, Yan’an 716000, China 2.Shaanxi Provincial Engineering Technology Research Center for Conservation and Utilization of Biological Resources, Yan'an 716000, China
having lush root system and good symbiosis ability with arbuscular mycorrhizal fungi, was selected to verify potential as a host plant of AMF propagation via pot, and four other plants ()were used as controls. The spore density of AMF in the rhizosphere soil of five host plant was studied at 30 d, 60 d and 100 d, respectively. The hyphal infection rate and arbuscularinfection rate of five host plant after 100 d were measured. Effects of different soil types on AMF propagation were studied, and the correlation between spore density and soil factors was analyzed. The result showed that the average hyphae infection rate ofandwas about 40%. The spore density in the rhizosphere soil ofwas 57N·10 g soil-1,which was significantly higher than that of other plants and showed a maximum at 60 d. correlation analysis showed that spore density was positively correlated with available phosphorus in soil and hyphal infection rate of AMF. But spore density was negatively correlated with soil pH. Whenwas used as host plant, humus soil with higher soil nutrients and lower pH was the most suitable soil type for AM fungi propagation.
arbuscular mycorrhizal fungi; propagation;
山宝琴, 宋惠子, 李嘉怡, 等. 油蒿扩繁丛枝菌根真菌的效果及土壤条件优化研究[J]. 生态科学, 2022, 41(5): 128–133.
SHAN Baoqin, SONG Huizi, LIJiayi, et al. Effect ofhost plant on the propagation of arbuscular mycorrhizae fungi and soil condition optimization[J]. Ecological Science, 2022, 41(5): 128–133.
10.14108/j.cnki.1008-8873.2022.05.016
Q933
A
1008-8873(2022)05-128-06
2020-08-27;
2020-11-20
国家自然科学基金项目(21866031); 陕西省区域生物资源保育与利用工程技术研究中心项目(sxqczx-2019-07); 陕西省延安市科技局项目(SL2019ZCNY-004); 陕西省大学生创新项目(S201910719066)
山宝琴(1970—), 女, 新疆乌鲁木齐人, 教授, 博士, 主要从事环境微生态研究, E-mail. xiaoshanbao@163.com
山宝琴
