多花兰传粉生物学研究
2022-08-04罗火林陈兴惠肖汉文陈衍如刘环卢建黄文辉熊冬金杨柏云
罗火林, 陈兴惠, 肖汉文, 陈衍如, 刘环, 卢建, 黄文辉, 熊冬金, 杨柏云,*
多花兰传粉生物学研究
罗火林1, 陈兴惠1, 肖汉文1, 陈衍如1, 刘环1, 卢建2, 黄文辉2, 熊冬金1, 杨柏云1,*
1. 江西省植物资源重点实验室, 南昌大学生命科学学院, 南昌 330031 2. 江西齐云山国家级自然保护区, 赣州 341000
传粉是植物繁殖和进化的一个关键环节, 为探讨中国产多花兰()的传粉生物学特性, 对其开花物候、繁育系统、花的挥发性成分、传粉昆虫行为学实验进行了研究。结果表明, 多花兰不存在自动自交和无融合生殖, 种子的形成有赖于传粉媒介。其自然结实率远低于人工授粉, 存在严重的传粉限制。中华蜜蜂()为多花兰的有效传粉昆虫, 但未能从中获得报酬, 在传粉过程中将花粉块连药帽一起带出。通过昆虫的行为学实验发现, 多花兰气味对中华蜜蜂具有显著性吸引作用, 而颜色对中华蜜蜂无显著性吸引作用。花朵的主要挥发性成分为醛类与醇类物质, 一天之中在种类和量上几乎没有变化, 只有芳樟醇含量的变化与传粉昆虫活动频率相关。本研究可为兰多花兰的野生保护和杂交育种提供一定依据。
多花兰; 繁育系统; 中华蜜蜂; 传粉生物学
0 前言
兰科植物是被子植物的大科之一, 约有736余属28000种, 广泛分布于全球的大部分区域, 特别是热带地区的兰科植物具有较高的多样性[1, 2]。多花兰()是兰科(Orchidaceae)兰属()多年生附生植物, 多生于海拔100—3300 m的林中或溪谷旁透光的岩石上, 湖南、浙江、江西、福建、台湾等地均有分布[3, 4]。由于多花兰观赏价值和经济价值较高, 导致其野生资源面临人为破坏。此外, 生态环境的破坏, 更加剧了该物种的濒危程度。
作为濒危植物生存和进化的重要一环, 植物传粉生态学研究一直备受关注。在兰属植物中, 已知存在四种传粉模式: 自动自交, 奖励性传粉, 泛化的食源性欺骗和贝氏拟态(模拟同期开花并具有报酬的植物)。其中,,和通过自动自交的方式实现传粉, 这些植物缺少一个在花药和柱头之间起物理隔离作用的喙[3]。具报酬的传粉发生在中, 由无刺蜂传粉。这种蜂可在唇瓣表面收集粘性物质, 用于筑巢[4]。在中, 也发现类似的传粉模式[5]。选择泛化食源性欺骗的传粉方式的兰属植物较多, 包括[6],[7,8]和[7,9]。subsp.则通过贝氏拟态模拟具有花蜜的杜鹃花属植物的视觉信号, 欺骗性地吸引大黄蜂前来传粉[10]。在兰属植物吸引传粉者的机制中, 气味是很重要的一个因素, 如虎头兰和春兰[8, 11]。
日本研究人员发现, 在日本, 多花兰可通过释放特殊的挥发性物质吸引日本蜜蜂(japonica), 包括工蜂, 雄峰和蜂王。甚至发现大量的日本蜜蜂在一朵花上聚集成群, 而日本蜜蜂在多花兰上聚集、传粉过程中未获得食物报酬[7, 12-14]。然而, 这些研究主要着眼于昆虫行为观察和花的化学成分分析, 对于和植物传粉生态密切相关的开花物候学、系统繁育学、传粉昆虫在花上的访花行为、植物花色对传粉者的吸引等方面, 缺乏详细的数据。此外, 同一个植物物种, 在不同的生态条件下, 它的传粉策略或许会发生改变。众所周知, 日本蜜蜂在中国分布较少, 那么在这种情况下, 中国产的多花兰传粉策略会如何调整?上述几点引发了我们的研究兴趣。本文对多花兰的开花物候、繁育系统、传粉昆虫以及花的挥发性成分进行了研究, 并用黑白瓶实验探讨了吸引传粉者的机制, 以便为中国产的多花兰保育研究提供科学依据。。
1 材料和方法
1.1 研究地概况
本研究于江西省齐云山国家级自然保护区进行, 其地理坐标为东经113°54′—114°38′, 北纬25°24′—25°55′, 该地属于中低山地貌, 中亚热带山地湿润季风气候, 年均温度为18.2 ℃, 年均降水量为1615.2 mm, 年均相对湿度为83%[15]。其伴生植物主要有: 毛竹()、黄精()、构骨()、钩距虾脊兰()、油茶()、杨梅()、棕竹()、石韦()、悬钩子()、芒萁()、万寿竹()、杜英()、香椿()、石楠()、冬青()、地锦()、蛇莓()、地菍()等。同期开花植物主要有酢浆草()、风轮菜()七星莲()鼠麴草()、锐尖山香圆()、石斑木()杜鹃()、金樱子()、蓬蘽()。
1.2 开花物候及花朵形态观察
参照 Dafni标准记录开花进程, 对居群中30株多花兰进行定点、定时观察, 记录每一朵开花和枯萎的时间, 对单朵花花期、单株花序花期和居群群体花期进行观察统计[16]; 同时记录花粉块移入移出情况; 观察记录居群内所有植株花的颜色变化, 唇瓣的结构、唇瓣上的斑点变化以及有无花蜜等。在盛花期随机选取30朵花, 用游标卡尺(精确度0.01 mm)测量其形态指标。同时, 记录每天的温度及天气的变化与花粉流之间的关系。
1.3 繁育系统
在居群内随机选择来自30个植株的90朵花, 平均分成6组。开花前套尼龙袋以防止昆虫进入花内, 在盛花期取下套袋按照以下方式随机进行处理: (1) 不作任何处理; (2) 去雄后套袋; (3) 自花授粉; (4) 同株异花授粉; (5) 异株异花授粉; (6) 全程套袋。待花期结束后统计其结实情况, 计算自然结实率。
1.4 访花昆虫及其行为
开花期间每天8:00—17:00对多花兰进行连续观察。用HDR-AC3摄像机及LUMIX照相机记录所有访花昆虫及其行为, 包括访花前行为、停落方式、访花过程、单花停留时间、居群停留时间、访花数目等。用捕虫网捕捉传粉昆虫, 标本存放在南昌大学江西省植物资源重点实验室。
1.5 花的挥发性成分检测
参考张聪的化学成分的气相色谱-质谱联用分析方法, 采用 Agilent 6890 GC 气相色谱-质谱联用仪采集花的挥发性成分。通过 GC-MS 分析和 NIST02.L质谱经计算机谱库检索, 选择较高匹配度的化学成分, 对样品进行定性分析。分别采集多花兰盛花期不同时间段(8:00、12:00、16:00)的花朵进行气味检测[17]。
1.6 颜色与气味对昆虫吸引的行为学实验
参考Burger的飞行箱实验并稍作修改[18], 该试验用到三种玻璃瓶, 如图1所示, a为带孔黑色玻璃瓶, 昆虫看不到瓶内的物体, 但里面的挥发性成分可以释放出来; b为白色无孔玻璃瓶, 昆虫能看到瓶内物体, 但里面的挥发性成分无法释放出来; c为带孔的白色玻璃瓶, 昆虫能看到瓶内物体, 且里面的挥发性成分可以释放出来。每天10:00—16:00在蜜蜂活动期间, 以空白为对照组、植物花序为实验组, 将黑白瓶放在多花兰居群中, 统计传粉昆虫访问黑白瓶的次数, 来探究颜色与气味对昆虫的吸引。每种玻璃瓶做3个处理, 每天统计其被中华蜜蜂访问次数, 重复3天, 最后对其差异性进行方差分析。
2 结果与分析
2.1 开花物候及花部形态
研究地的多花兰花期近30d, 单朵花花期为(10.1±0.89) d(=30), 单株花序花期为(15.5±0.87) d(=30); 从居群内第一朵花开开放到居群进入盛花期需要近7 d, 花部器官形态参数如表1所示。授过粉的花或花粉块被带走的花, 其花期会缩短, 为5—6 d。花蕾期的花序从苞片中抽出, 花序低于叶片高度, 并且花序轴会倾斜(图2-A)。随着时间的推移, 花梗不停伸长生长, 花蕾逐渐膨大, 花序轴下垂, 基部花朵慢慢张开(图2-B)。盛开时, 中萼片、侧萼片与花瓣均张开到最大, 唇瓣微微向下反卷(图2-C)。同时, 观察到花粉块未被带走时或柱头未授粉时唇瓣上红色斑点的颜色界限分明(图2-D); 花粉块移出或柱头授粉1 d后唇瓣上红色斑点界线开始变的模糊, 整个唇瓣的变为浅桃红色, 合蕊柱的色泽不变(图2-E); 花粉块移出后3 d合蕊柱微微弯曲, 变为红色, 唇瓣颜色变为红棕色(图2-F)。
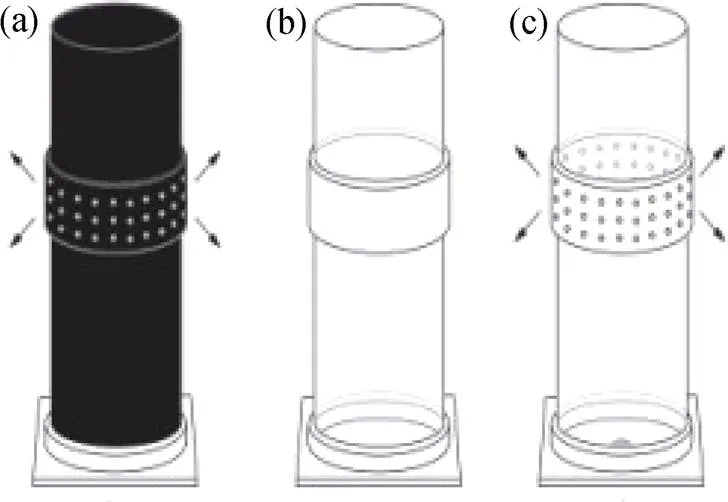
注: a. 黑色有孔玻璃瓶, 用来探究气味对昆虫的吸引; b. 透明密闭玻璃瓶, 用来探究颜色对昆虫的吸引; c. 透明有孔玻璃瓶用来探究颜色+气味对昆虫的吸引。
Figure 1 Glass bottle that explores the behavior of insects
2.2 繁育系统
繁育系统结果显示, 去雄套袋和全程套袋的结实率为0, 自然结实率为26.67%, 无论是何种方式的人工授粉, 结实率都接近100% (表2)。
2.3 访花昆虫及其行为
多花兰的访花昆虫包括蜜蜂科(Apidae)的中华蜜蜂(图3-A)、蚁科(Formicidae)的拟黑多刺蚁(图3-B)、夜蛾科(Noctuidae)的魔目夜蛾(图3-C)、蝝蝽科(Coreidae)的蝝椿(图3-D), 其中中华蜜蜂为多花兰的有效传粉昆虫。中华蜜蜂从多花兰的初花期到凋谢期都会对其进行访问, 但访问主要集中在盛花期, 且在晴天10:00–14:00气温较高的时间段活动最为频繁。发生花粉块移入或移出的访花持续时间为(29.9 ± 4.67) s (= 10), 而未发生花粉块移入或移出的时间为(13.7 ± 1.90) s (= 10)。
中华蜜蜂访花时, 直接落在唇瓣上, 随后钻入蕊柱与唇瓣相连的通道(图3-F), 由于中华蜜蜂体宽和胸高小于通道, 但体长大于通道长度(表1)。当其头部接近蕊柱基部便不能继续前进, 其尾部不停左右摆动, 开始退出, 在退出过程中, 后腿向外蹬, 背部会向蕊柱上拱起并与药帽接触, 花粉块会连药帽一起带出(图3-G)。如果中华蜜蜂携带着花粉块进行访花时, 在其退出时胸背部同样会拱起而接触到合蕊柱上部, 从而将粘附在背部的花粉块粘到柱头上, 完成授粉。在中华蜜蜂整个访花过程中, 其身体接触的花器官, 如唇瓣、蕊柱等, 均不分泌花蜜, 而多花兰的花粉对于中华蜜蜂来说也是不可食的。

注: A.花蕾期; B.初花期; C.盛花期; D.未被带走花粉块的花; E.花粉块移出1d后的花; F.花粉块移出后3d的花
Figure 2 Flowering phenology of

表1 多花兰和中华蜜蜂的表型特征
表2 不同授粉方式的结实率

Table 3 Fruit set in different pollination types
在传粉观测中, 发现花粉块未被带走时或柱头未授粉时唇瓣上红色斑点的颜色界限分明(图2-D); 花粉块移出或柱头授粉1 d后唇瓣上红色斑点界线开始变的模糊, 整个唇瓣的变为浅桃红色, 合蕊柱的色泽不变(图2-E); 花粉块移出后3 d合蕊柱微微弯曲, 变为红色, 唇瓣颜色变为红棕色(图2-F)。在为期30 d的肉眼观察和摄像机记录中, 唇瓣变为红棕色后未发现中华蜜蜂访问该朵花。
当天气晴朗气温明显升高时, 多花兰的花会大量开放, 花粉块移入移出数量明显增多。4月17日, 研究区域的平均气温升高到31.2℃, 比之前阴雨天的平均气温提高了近15℃, 当天花朵大量盛开, 占到了总开花数的64.44%, 花粉块移出数为91, 占到了总数的25%, 移入数为42, 占到总数的26.75%(图4)。

注: A.访花昆虫中华蜜蜂; B.拟黑多刺蚁; C.魔目夜蛾; D.蝝蝽; E.多花兰的传粉者中华蜜蜂; F.花部结构: c, 蕊柱; ml, 唇瓣中裂片; p, 花粉块; pe, 花瓣; s, 萼片; sl, 唇瓣侧裂片; G.中华蜜蜂钻入多花兰花内; H.中华蜜蜂退出时带出花粉块
Figure 3 Visiting insects and pollinators

图4 温度与花粉块移出移入的关系
2.4 颜色与气味对昆虫吸引的行为学实验
在黑白瓶试验的六个处理中, 传粉昆虫访花频率分为两档, 第一档为放有多花兰花序的a瓶和c瓶, 第二档为其余四个处理。放有花序的a瓶访花频率显著高于对照, 表明气味可以吸引传粉者。而放有花序的c瓶, 传粉者既能看到里面的花, 也能闻到里面的气味, 但其访问频率与放有花序的a瓶(只能闻到, 不能看到)无显著性差异。此外, 放有花序的b瓶(昆虫能看到, 但闻不到气味)的访问频率与对照无显著性差别。由此可见, 多花兰的挥发性成分在吸引传粉者中起着决定性作用。

表3 中华蜜蜂对不同黑白瓶的访花频率统计
注: 利用Tukey’s post hoc test进行差异显著性分析,<0.05定义为差异显著性。
2.4 花的挥发性成分
对多花兰不同时间段的挥发性成分进行测定, 结果见图5。各个时间段花的挥发性成分变化不明显。8:00的挥发性成分主要为异戊醛、己醛、庚醛、蒎烯、莰烯、辛醛、桉叶油醇、芳樟醇、壬醛(图5-A), 含量分别为10.32%、42.13%、2.94%、2.26%、9.24%、5.07%、5.07%、4.34%、11.47%; 12:00的挥发性成分主要有戊醛、己醛、庚醛、莰烯、辛醛、桉叶油醇、芳樟醇、壬醛(图5-B), 含量分别为11.94%、38.04%、3.09%、2.24%、4.03%、5.99%、4.44%、13.95%; 16:00的挥发性成分主要有戊醛、己醛、庚醛、莰烯、辛醛、桉叶油醇、壬醛 (图5-C), 含量分别为9.64%、47.88%、3.23%、3.37%、5.65%、7.80%、11.28%。花朵的主要挥发性成分在各个时间段均为醛类与醇类物质, 在种类和量上几乎没有变化, 只有芳樟醇在14:00后含量降至0, 而传粉观测显示, 14:00以后也未见传粉者访花, 这暗示着芳樟醇含量的变化与传粉者活动可能有潜在的关系。
3 讨论
植物与传粉动物的互利关系在生态系统中非常普遍[19], 许多兰科植物可以给传粉者提供花蜜、油类物质或脂类物质等报酬来吸引传粉昆虫为其传粉[18-20],然而, 约1/3的兰花采用欺骗的方式吸引昆虫为其进行传粉[20, 21]。有报酬的兰科植物通常利用花蜜或者类脂类物质吸引传粉者为它们传粉, 中华蜜蜂为其他植物传粉时通常以花蜜或可食的花粉为报酬的。然而在多花兰花内我们没有发现任何这类可作为传粉者的报酬, 因而我们认为多花兰不能为传粉者提供食物类的报酬。此外, 多花兰的花部形态, 结合传粉者行为, 也没有显示其能为传粉者提供繁殖地、避难所等功能。因此, 我们推断多花兰主要靠欺骗的方法吸引中华蜜蜂前来传粉。
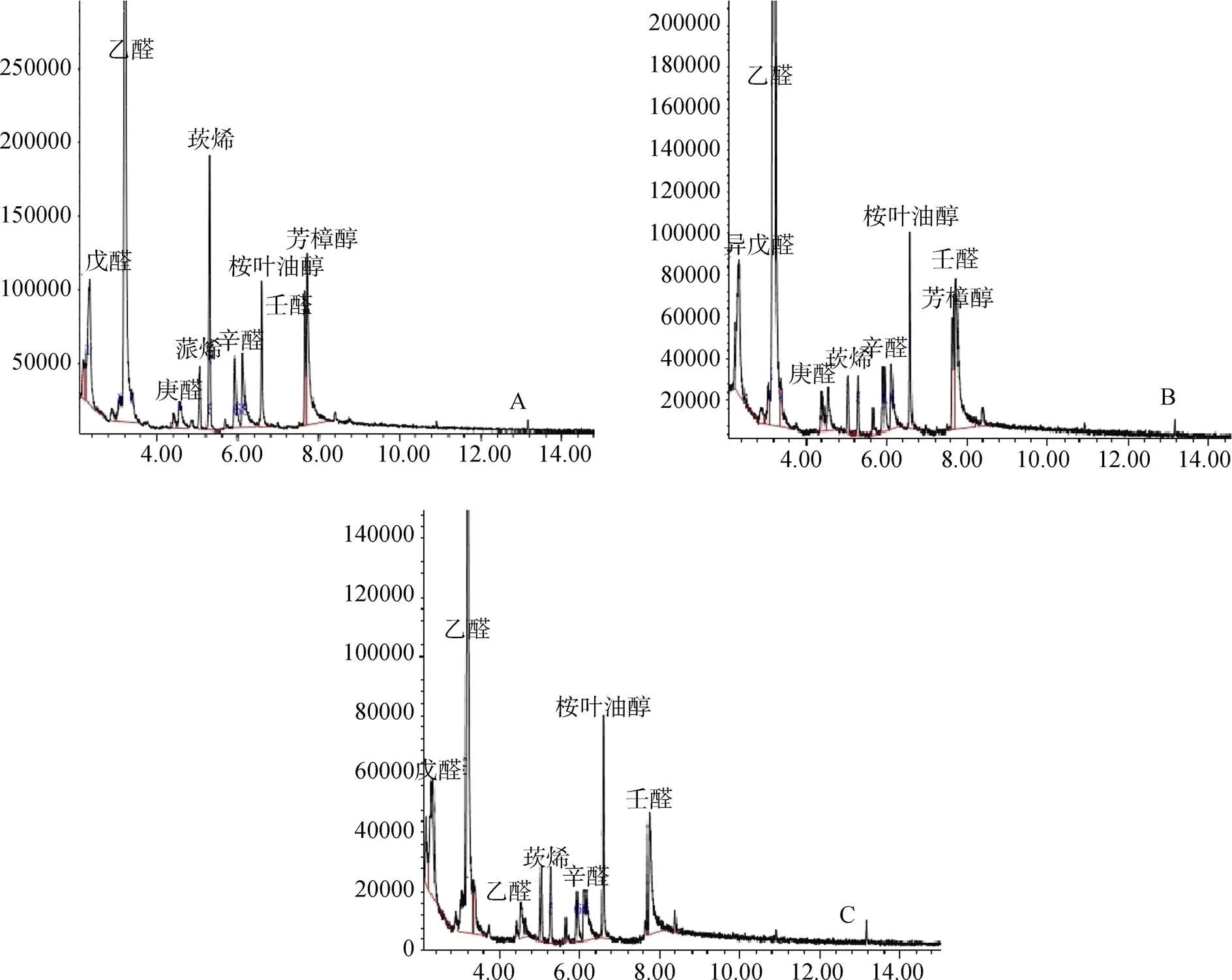
注: A.8:00; B.12:00; C.16:00
Figure 5 Volatile odor ions at full-blossom
人工授粉试验中, 去雄套袋的结实率为0, 表明不存在多花兰不存在无融合生殖, 全程套袋的结实率为0, 这也排除了自动自交现象, 这表明多花兰种子的形成离不开传粉媒介。在自然条件下, 无报酬兰科植物的平均结实率为28%-41%[22], 而多花兰的自然结实率为26.6%, 与其相接近, 但与人工授粉结实率差距甚大, 表明多花兰的繁殖成功受到传粉者限制(表2)。通常情况下, 无报酬植物的结实率要低于有报酬植物。首先, 传粉昆虫也有“学习”能力, 特别是对于中华蜜蜂这种社会性昆虫。一个昆虫个体, 接收到植物释放的欺骗性信号, 降落花器官上后并未获得报酬, 在此后的一段时间内, 它会避免访问此类花。因此, 欺骗性花朵被访问的频率就偏低。其次, 传粉的成功, 更多取决于携带花粉的昆虫能否二次被骗, 再次访问这种植物的花。Johnson研究发现, 在这种情况下, 昆虫大多数会远离该居群, “二进宫”的概率低于首次被欺骗。因此, 在很多欺骗性植物中, 花粉迁出率和结实率并不对等[23], 比如本研究中, 观察到花粉被移出数为91, 而移入数仅为42.
多花兰具有根状茎, 在野外以点状分布为主, 在一个居群内, 大多是由几个根状茎的克隆植株构成。一般来说, 对于这种克隆植物, 随着克隆植物基株的变大, 基株上的每朵花逐渐被同一基株的其它花所包围, 克隆内花粉传递增加, 阻碍了基株的花粉向外散发, 降低了不同基株间的交配机会, 不可避免地增加了同株异花授粉的可能[24]。而在我们的观察中, 由于传粉者无法从多花兰中获得报酬, 在尝试着访问1-5朵花后便会离开这个居群, 从而降低了同株异花授粉的比例, 增加远交的机会。
植物的花部特征与传粉者行为、传粉机制和植物适合度密切相关[25, 26]。在野外的观察中发现, 多花兰的有效传粉昆虫为中华蜜蜂, 花粉块位于中华蜜蜂的背部。多花兰唇瓣、唇瓣侧裂片以及合蕊柱形成通道入口的高度和宽度平均值与中华蜜蜂的胸高、体宽平均值相吻合, 中华蜜蜂能够进入多花兰花内, 为其传粉。中华蜜蜂为多花兰的唯一传粉昆虫, 表明多花兰的传粉系统是一种典型的具有专一传粉者的特化传粉系统。截止到现在, 除了和[5, 27]其余的兰属植物均选择只有一个传粉者, 如春兰的传粉者也仅有中华蜜蜂一种传粉者[8]。在齐云山自然保护区内, 多花兰居群呈间断分布, 居群之间距离较远。物种片段化的分布会在很大程度上阻碍各个居群之间的基因交流, 而具有特化的传粉系统无疑会能够更大程度地保障多花兰的繁育成功。
无报酬植物欺骗性地吸引传粉者的策略很多, 如泛化的食源欺骗, 贝氏拟态, 模拟传粉者产卵地、性欺骗、或者释放昆虫信息素等。前两种传粉策略中, 植物一般通过视觉信号吸引传粉者。在黑白瓶试验中, 证实多花兰是通过嗅觉信号, 而非视觉信号吸引昆虫。因此, 排除泛化的食源欺骗[22-24]。
气味是兰科植物吸引传粉者的主要机制之一[28, 29]。Luo等通过中华蜜蜂的触角电位实验表明, 芳樟醇在麻风树吸引中华蜜蜂过程中起着关键的作用[30]。本研究中, 中华蜜蜂是由多花兰挥发性成分吸引, 而在挥发性成分中, 芳樟醇在中华蜜蜂访花的时间段含量较高, 而在中华蜜蜂访花以外的时间段, 检测不到其信号峰。因此, 我们推测, 芳樟醇在多花兰吸引传粉昆虫中可能起了比较关键的作用。
近年来, 随着化学生态技术的发展, 在传粉机制的研究中发现了越来越多的与昆虫化学通讯相关的拟态。如的花可释放蚜虫报警的化学信号, 诱骗食蚜蝇[31]。亦可通过通过模拟蜜蜂报警素吸引蜜蜂的捕食者-胡蜂[32]。本研究中, 未发现中华蜜蜂访问区域内同期开花植物, 基本可排除贝氏拟态, 而泛化的食源性欺骗主要有赖于视觉信号。该地区多花兰通过气味吸引中华蜜蜂, 是在模拟中华蜜蜂的某种信息素, 还是性欺骗, 或者其他方式, 还有待进一步研究。
一些花在授粉或花粉块移出后, 花的某一特定部位会改变颜色[33, 34]。花颜色的变化被认为是为了阻止传粉者访问已经授粉或花粉被移出的花[35, 36]。通过观察发现, 多花兰的花粉块移出或移入后, 其唇瓣逐渐变成红棕色, 中华蜜蜂的访花频率也随之降低。自然界中, 多花兰本就存在严重的传粉限制, 此举可以认为是为了减少传粉资源的浪费。
目前, 所有野生兰科植物均被列入《野生动植物濒危物种国际贸易公约》的保护范围, 且占该公约应保护植物的90%以上[37], 兰科植物的保护已成为当务之急。中华蜜蜂是多花兰唯一的传粉者, 其数量的减少可能会影响到多花兰的数量。因此, 我们在保护多花兰时, 可在其野生栖息地旁边适当地种植中华蜜蜂的蜜源植物, 以吸引和供养更多的传粉者。此外, 多花兰作为一种观赏植物被广泛栽培。在人工栽培中, 一般通过人工种内杂交授粉, 进行新品种选育。而根据本研究, 可通过在多花兰种植园中饲养中华蜜蜂, 或者种植蜜源植物吸引中华蜜蜂前来为多花兰传粉, 提高结实率。而且, 中华蜜蜂在多花兰中的传粉机制导致异交率较高, 从而提高其种内杂交率, 以便选育表型更丰富的品种。如此, 也能减少花农上山盗采多花兰的可能性。
[1] Liu Q, Chen J, Corlett R T, et al. Orchid conservation in the biodiversity hotspot of southwestern China [J]. Conservation Biology,2015, 29 (6):1563–1572.
[2] Merritt D J, Hay F R, Swarts N D, et al. Ex situ conservation and cryopreservation of orchid germplasm [J]. International Journal of Plant Sciences,2014, 175 (1):46–58.
[3] Suetsugu K. Autonomous self-pollination and insect visitors in partially and fully mycoheterotrophic species of(Orchidaceae) [J]. Journal of Plant Research,2015, 128 (1): 115–125.
[4] Du Puy D, Cribb P, Tibbs M. The genus Cymbidium[M]. Royal Botanic Gardens Kew, 2007.
[5] Davies K, Stpiczyńska M, Turner M. A rudimentary labellar speculum in(Rchb. f.) Rchb. f. andPaxton (Orchidaceae) [J]. Annals of botany,2006, 97 (6):975–984.
[6] Jin C, Shiyong L, Rong H, et al. Food-deceptive pollination in(Orchidaceae) in Guangxi, China[J]. Biodiversity Science, 2007, 15 (6):608–617.
[7] Tsuji K, Kato M. Odor‐guided bee pollinators of two endangered winter/early spring blooming orchids,and, in Japan [J]. Plant Species Biology,2010, 25 (3):249–253.
[8] YU Xiaohong, LUO Yibo, DONG Ming. Pollination biology of(Orchidaceae) in China [J]. Journal of Systematics and Evolution,2007, 46 (2):163–174.
[9] Sugahara M, Tsutsui K. Foraging behavior ofjaponica on the oriental orchids,and[J]. Bibliographic Information,2001, 19 (2): 81–82.
[10] Kjellsson G, Rasmussen F N, Dupuy D. Pollination of Dendrobium infundibulum,(Orchidaceae) and(Ericaceae) by Bombus eximius (Apidae) in Thailand: a possible case of floral mimicry [J]. Journal of Tropical Ecology,1985, 289–302.
[11] DuPuy D J. A taxonomic revision of the genus(Orchidaceae) [D]. University of Birmingham, 1986.
[12] Sugahara M, Izutsu K, Nishimura Y, et al. Oriental orchid () attracts the Japanese honeybee (japonica) with a mixture of 3-hydroxyoctanoic acid and 10-hydroxy-(E)-2-decenoic acid[J]. Zoological Science,2013, 30 (2): 99–104.
[13] Sugahara M.andas well asattracts Japanese honeybees (japonica) [J]. Zoological Science,2006, 23: 1225.
[14] Sasagawa H. Honey bee communications and pollination tactics of[M]. The 2004 ESA Annual Meeting and Exhibition,2004.
[15] 范志刚, 孔令杰, 彭德镇, 等. 齐云山自然保护区兰科植物资源分布及其区系特点[J]. 热带亚热带植物学报, 2011, 19 (2): 159–165.
[16] Renner S S. Pollination Ecology-A Practical Approach [J]. Nordic Journal of Botany,1993, 13 (5): 514–514.
[17] 张聪, 刘守金, 杨柳, 等. GC-MS 法检测云南产细茎石斛花中挥发性成分[J]. 云南农业大学学报: 自然科学版,2017, 32 (1): 174–178.
[18] Burger H, Dötterl S, Ayasse M. Host-plant finding and recognition by visual and olfactory floral cues in an oligolectic bee [J]. Functional Ecology,2010, 24 (6): 1234– 1240.
[19] Kaiser-Bunbury C N, Mougal J, Whittington A E, et al. Ecosystem restoration strengthens pollination network resilience and function [J]. Nature,2017, 542 (7640): 223–227.
[20] Wong D C, Pichersky E, Peakall R. The biosynthesis of unusual floral volatiles and blends involved in orchid pollination by deception: current progress and future prospects [J]. Frontiers in Plant Science,2017, 8: 1955–1962.
[21] Aguiar J M, Pansarin E R. Deceptive pollination of(Oncidiinae:Orchidaceae) [J]. Flora,2019, 250: 72–78.
[22] Ravigné V, Olivieri I, Martinez S G, et al. Selective interactions between short‐distance pollen and seed dispersal in self‐compatible species [J]. Evolution,2006, 60 (11): 2257–2271.
[23] Johnson S D, Peter C I, Nilsson L A, et al. Pollination success in a deceptive orchid is enhanced by co‐occurring rewarding magnet plants [J]. Ecology,2003, 84 (11): 2919–2927.
[24] Handel S N. The intrusion of clonal growth patterns on plant breeding systems [J]. The American Naturalist,1985, 125 (3): 367–384.
[25] Phillips R D, Peakall R, van der Niet T, et al. Niche Perspectives on Plant–Pollinator Interactions [J]. Trends in Plant Science,2020, 25 (8): 779–793.
[26] 黄双全, 郭友好. 传粉生物学的研究进展 [J]. 科学通报,2000, 45 (3): 225–237.
[27] Van Der Cingel N A. An atlas of orchid pollination: European orchids[M]. CRC Press, 2001.
[28] Chapurlat E, Ågren J, Anderson J, et al. Conflicting selection on floral scent emission in the orchid[J]. New Phytologist,2019, 222 (4): 2009–2022.
[29] Lahondère C, Vinauger C, Okubo R P, et al. The olfactory basis of orchid pollination by mosquitoes [J]. Proceedings of the National Academy of Sciences,2020, 117 (1): 708–716.
[30] Luo C, Huang ZY, Li K, et al. EAG Responses of Apis cerana to Floral Compounds of a Biodiesel Plant,(Euphorbiaceae) [J]. Journal of Economic Entomology,2013, 106 (4): 1653–1658.
[31] Stökl J, Brodmann J, Dafni A, et al. Smells like aphids: orchid flowers mimic aphid alarm pheromones to attract hoverflies for pollination [J]. Proceedings of the Royal Society B: Biological Sciences,2011, 278 (1709): 1216–1222.
[32]Brodmann J, Twele R, Francke W, et al. Orchid mimics honey bee alarm pheromone in order to attract hornets for pollination [J]. Current Biology,2009, 19 (16): 1368–1372.
[33] Dudareva N, Pichersky E. Biochemical and molecular genetic aspects of floral scents [J]. Plant Physiology,2000, 122 (3): 627–634.
[34] Vasconcelos M C, Greven M, Winefield C S, et al. The flowering process of: a review [J]. American Journal of Enology and Viticulture,2009, 60 (4): 411–434.
[35] Gegear R J, Burns J G. The birds, the bees, and the virtual flowers: can pollinator behavior drive ecological speciation in flowering plants? [J]. The American Naturalist,2007, 170 (4): 551–566.
[36] Ushimaru A, Watanabe T, and Nakata K. Colored floral organs influence pollinator behavior and pollen transfer in(Commelinaceae) [J]. American Journal of Botany,2007, 94 (2): 249–258.
[37] Fuchs C. Convention on International Trade in Endangered Species of Wild Fauna and Flora (CITES)–Conservation Efforts Undermine The Legality Principle [J]. German Law Journal,2008, 9 (11): 1565–1596.
Pollination biology of(Orchidaceae)
LUO Huolin1, CHEN Xinghui1, XIAO Hanwen1, CHEN Yanru1, LIU Huan1, LU Jian2, HUANG Wenhui2, XIONG Dongjin1, YANG Boyun1,*
1. School of Life Science, Nanchang University, Nanchang 330031, China 2. National Nature Reserve of Qiyunshan, Ganzhou 341315,China
Pollination is a key link in plant reproduction and evolution. In order to explore the pollination biological characteristics of, the flowering phenology, breeding system, flower volatile components and behavior of pollinating insects were studied. The results showed that there was no automatic selfing and apomictic reproduction in, and the formation of seeds depended on pollinators. Its natural seed setting rate was much lower than that of artificial pollination, and there were serious pollination restrictions.was an effective pollinator for, but it could not get reward from the plants. During pollination, the pollinium was taken out together with the cap. Through the behavioral experiments of insects, it was found that the odor ofplayed a key role in attracting pollinators, while the color had no significant attractive effect on. The main volatile components of flowers were aldehydes and alcohols, and there was almost no change in type and amount in a day for the volatile components. Only the change in linalool content was related to the frequency of pollinating insects. This study could provide a certain basis for wild protection and hybrid breeding of orchids.
; breeding system; honeybee; pollination biology
罗火林, 陈兴惠, 肖汉文,等. 多花兰传粉生物学研究[J]. 生态科学, 2022, 41(5): 72–80.
LUO Huolin, CHEN Xinghui, XIAO Hanwen, et al. Pollination biology of(Orchidaceae)[J]. Ecological Science, 2022, 41(5): 72–80.
10.14108/j.cnki.1008-8873.2022.05.009 图分类号:S682. 31
A
1008-8873(2022)05-072-09
2020-08-16;
2020-11-27
国家科技基础资源调查专项(2018FY100406); 国家自然科学基金项目(31360491); 江西省自然科学基金(20171ACB21014)
罗火林(1982—), 博士, 副教授, 研究方向为兰科植物发育生物学, E-mail: 572460991@163.com
杨柏云, 博士, 教授, 博士研究生导师, 研究方向为植物学, E-mail: yangboyun@163.com
