Dawson型磷钼酸盐对水合肼和过氧化氢的可逆光谱检测
2022-08-04王志强王晓红刘宗瑞
包 英, 陆 爽, 王志强, 王晓红, 许 良,2, 王 斌,2, 刘宗瑞
(1. 内蒙古民族大学 化学与材料学院, 内蒙古 通辽 028000; (2. 天然产物化学及功能分子合成自治区重点实验室, 内蒙古 通辽 028000)
水合肼(N2H4·H2O), 又称水合联氨, 具有强还原性、 强碱性、 吸湿性及高能量等性质, 是航天动力系统、 纺织染料、 医药、 农药等领域应用广泛的化工原料, 但水合肼具有高毒性和致癌性, 吸入或摄入水合肼会导致血液异常及DNA、 呼吸道、 神经系统等损伤[1-2]. 因此, 研究简便快捷、 灵敏度高、 可重复使用的新型水合肼检测方法与技术具有实际应用前景. 目前, 滴定分析法[3]、 循环伏安法[4]、 色谱法[5]、 光谱法[6]等对水合肼的检测已有文献报道. 紫外-可见光谱法具有操作简单、 响应速度快、 灵敏度高、 兼具定性与定量分析功能等优点, 是传感领域应用较广泛、 较具发展潜力的微痕量物质探测技术之一.

本文在N2H4·H2O和H2O2的氧化还原作用下, 利用紫外-可见光谱实现P2Mo18水溶液对其可逆检测, 并考察该检测方法的检出限、 检出范围、 响应时间、 抗干扰性等, 为水合肼的检测提供新的检测方法与技术.
1 实 验
1.1 试剂及仪器
钼酸钠、 浓磷酸(φ=85%)、 浓盐酸、 浓硝酸、 水合肼、 三氯化铁、 氯化锰、 草酸、 碘化钾和三乙胺(C6H15N)等购于国药集团化学试剂有限公司; 纯净水由Millipore Milli-Q净水系统制备(18.2 MΩ·cm).
Fourier变换红外光谱仪(Nexus 470型, 美国Nicolet公司); 激光Laman光谱仪(InVia型, 英国Renishaw公司); 粉末X射线衍射仪(SmartLab型, 日本Rigaku公司); 紫外-可见光谱仪(UV-2600型, 日本Shimadzu公司); 电化学工作站(CHI660e型, 上海辰华仪器有限公司); 蠕动泵(RZ1020型, 南京润泽流体控制设备有限公司).
1.2 P2Mo18 的合成及结构


图1 Dawson型的球棍模型结构(A)和多面体结构(B)Fig.1 Ball-stick model structure (A) and polyhedral structure (B) of Dawson type
1.3 P2Mo18 的结构表征


图2 P2Mo18的粉末XRD谱(A)、 FTIR光谱(B)和Raman光谱(C)Fig.2 XRD pattern (A), FTIR spectrum (B) and Raman spectrum (C) of P2Mo18
2 结果与讨论
2.1 P2Mo18 的光电活性
利用紫外-可见光谱仪及循环伏安法对P2Mo18的光活性及电化学氧化还原性质进行考察, 结果如图3所示. 图3(A)为5 μmol/L P2Mo18溶液的紫外-可见光谱. 由图3(A)可见, 在波长为213,325 nm处出现了Od→Mo和Ob/c→Mo的电荷迁移跃迁吸收峰(LMCT)[16], 在可见区没有吸收峰, 表明P2Mo18对水合肼的检测无干扰. 图3(B)为0.1 mmol/L P2Mo18在0.5 mol/L H2SO4/Na2SO4(pH=1)缓冲溶液中、 扫描速度为100 mV/s的循环伏安曲线. 由图3(B)可见, 在E1/2=0.40 V(1e),0.25 V(1e),0.08 V(2e),-0.22 V(2e)处出现4对Dawson型磷钼酸盐特有的可逆氧化还原峰, 表明P2Mo18发生了可逆的氧化还原反应, 且结构保持不变[17].
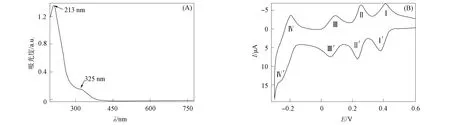
图3 P2Mo18的紫外-可见光谱(A)和循环伏安曲线(B)Fig.3 UV-Vis spectrum (A) and cyclic voltammetry curves (B) of P2Mo18
2.2 P2Mo18浓度对着色程度的影响
通过紫外-可见光谱对N2H4·H2O与不同浓度P2Mo18反应的着色程度进行考察, 在0.1 mol/L N2H4·H2O溶液中分别加入0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mmol/L的P2Mo18, 将混合液在密封样品瓶中反应1 h, 测量其紫外-可见吸收光谱, 结果如图4(A)所示. 由图4(A)可见, 随着P2Mo18浓度的增加, 溶液的蓝色逐渐加深, 在650 nm处的吸光度线性增强. 为确保检测过程中N2H4·H2O反应完全, 使用稍过量的10 mmol/L P2Mo18溶液为检测液. 图4(B)分别为0.1 mol/L N2H4·H2O与1.0 mmol/L P2Mo18混合液(红线)、 10 mmol/L P2Mo18与0.119 mmol/L N2H4·H2O混合液(黑线)的紫外-可见吸收曲线. 由图4(B)可见, 当N2H4·H2O过量时, 最大吸收峰由750 nm蓝移至650 nm, 这是由于P2Mo18发生了多电子还原所致[18].
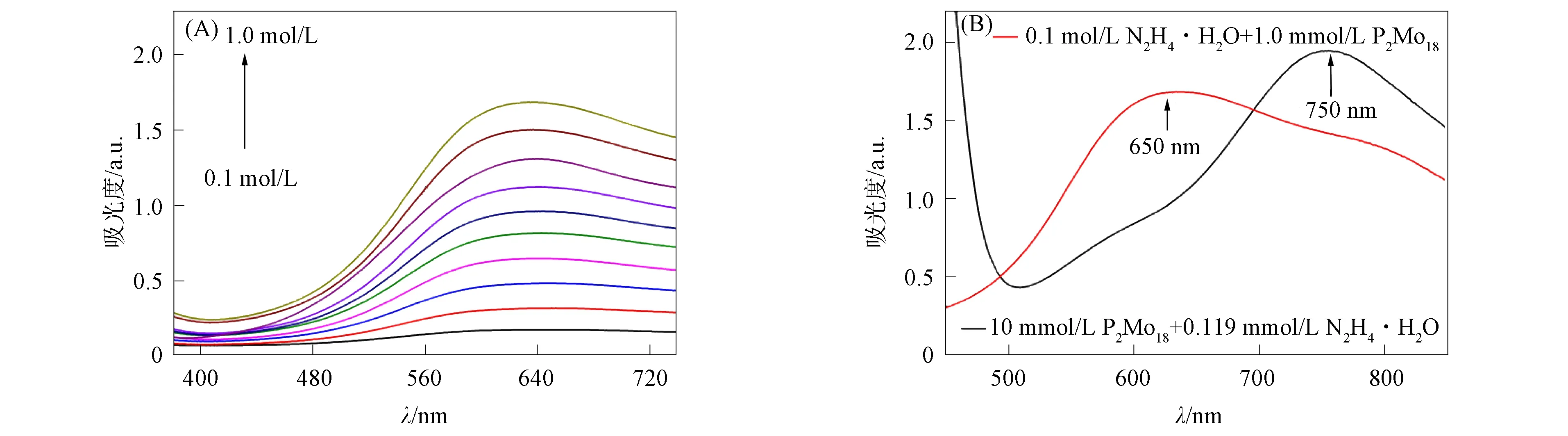
图4 0.1 mol/L N2H4·H2O与不同浓度的P2Mo18混合液(A)和 不同浓度的N2H4·H2O与P2Mo18混合液(B)的紫外-可见光谱Fig.4 UV-Vis spectra of 0.1 mol/L N2H4·H2O mixed with different concentrations of P2Mo18 (A) and different concentrations of N2H4·H2O mixed with P2Mo18 (B)
2.3 P2Mo18溶液对N2H4·H2O和H2O2的紫外-可见光谱检测
在10 mmo/L的P2Mo18检测液中分别加入0.011,0.023,0.035,0.047,0.059,0.071,0.083,0.095,0.107,0.119 mmol/L的N2H4·H2O, P2Mo18被N2H4·H2O还原后, 在其结构中存在混合价态的Mo5+/Mo6+, 同时溶液在400~900 nm内出现新的吸收峰, 归属于Mo5+→Mo6+分子内价电子转移吸收(IVCT)[19]; 随着N2H4·H2O浓度的增加, 在750 nm处的吸光度线性增强(图5(A)). 以750 nm处的吸光度对N2H4·H2O浓度做图, 结果如图5(B)所示, 得到P2Mo18溶液对N2H4·H2O检测的线性方程为A=17.403 7c+0.081 9, 线性相关系数R2=0.999 1, 检出限cL=kSN/m=7.24×10-5mmol/L(其中置信因子k=3, 标准偏差SN=0.000 42, 标准曲线的斜率m=17.403 7), 线性工作范围为7.24×10-5~0.119 mmol/L. 为验证该方法的有效性, 与电化学法(EC)[20]、 紫外-可见分光光度法(UV-Vis SPM)[21]、 气相色谱-质谱法(GC-MS)[22]、 荧光光谱法(FL)[23]对N2H4·H2O检测的线性检测范围及检出限进行对比, 结果列于表1. 由表1可见: 本文方法与电化学方法均具有较高的检测上限, 适用于高浓度N2H4·H2O溶液的检测; 本文方法具有较低检出下限, 适用于低浓度N2H4·H2O溶液的检测, 即本文方法具有较宽的线性检测范围; 气相色谱-质谱法对N2H4·H2O检测的检出限最低, 但存在仪器昂贵、 检测过程复杂等问题; 本文方法与电化学法、 紫外-可见分光光度法的检出限在同一数量级, 且比荧光光谱法的检测灵敏度高.

图5 10 mmol/L P2Mo18与不同浓度N2H4·H2O混合液的紫外-可见光谱(A) 及750 nm处的吸光度对N2H4·H2O浓度做图(B)Fig.5 UV-Vis spectra of 10 mmol/L P2Mo18 mixed with different concentrations of N2H4·H2O (A) and plot N2H4·H2O concentration with absorbance at 750 nm (B)
表1 不同方法对N2H4·H2O检测的线性范围及检出限 Table 1 Linear range and detection limit of N2H4H2O detected by different methods mmol/L

表1 不同方法对N2H4·H2O检测的线性范围及检出限 Table 1 Linear range and detection limit of N2H4H2O detected by different methods mmol/L
方法线性范围检出限EC[20]1.0×10-4~0.21.6×10-5UV-Vis SPM[21]3.16×10-5~2.8×10-33.8×10-5GC-MS[22]1.8×10-6~1.1×10-34.0×10-7FL[23]1.0×10-3~6.0×10-26.5×10-4本文7.24×10-5~0.1197.24×10-5
在被0.119 mmol/L的N2H4·H2O还原后的10 mmol/L P2Mo18溶液中, 分别加入0.045,0.090,0.136,0.181,0.227,0.272,0.318,0.363,0.409 mmol/L的H2O2, 溶液在400~900 nm内的吸收峰逐渐降低(图6(A)); 以750 nm处的吸光度对H2O2浓度做图, 结果如图6(B)所示, 得到还原态P2Mo18溶液对H2O2检测的线性方程A=-5.865 7c+2.427 2, 线性相关系数R2=0.998 1, 检出限cL=2.15×10-4mmol/L, 线性工作范围为2.15×10-4~0.409 mmol/L.

图6 还原态P2Mo18与不同浓度H2O2混合液的紫外-可见光谱(A)及750 nm处的吸光度对H2O2浓度做图(B)Fig.6 UV-Vis spectra of reduced P2Mo18 mixed with different concentrations of H2O2 (A) and plot H2O2 concentration with absorbance at 750 nm (B)
将本文方法与电化学法[24]和紫外-可见分光光度法[25]对H2O2检测的线性检测范围及检出限进行比较, 结果列于表2. 由表2可见: 本文方法明显优于电化学方法的线性检测范围及检出限, 略高于紫外-可见分光光度法的检出限; 本文方法比紫外-可见分光光度法的线性范围下限低2个数量级, 适用于低浓度H2O2溶液检测.

表2 不同方法对H2O2检测的线性范围及检出限 Table 2 Linear range and detection limit of H2O2 detected by different methods mmol/L
图7(A)为10 mmo/L的P2Mo18溶液与不同浓度N2H4·H2O反应的实物照片. 由图7(A)可见, 随着还原剂N2H4·H2O浓度的增加, 溶液的颜色逐渐加深. 图7(B)为N2H4·H2O还原后的P2Mo18溶液与不同浓度H2O2反应的实物照片. 由图7(B)可见, 随着氧化剂H2O2浓度的增加, 溶液的颜色逐渐变浅, 呈现可逆的化学响应变色性质.

图7 P2Mo18溶液与不同浓度N2H4·H2O(A)和H2O2(B)反应的实物照片Fig.7 Physical photographs of P2Mo18 solution reacting with different concentrations of N2H4·H2O (A) and H2O2 (B)
2.4 P2Mo18溶液对N2H4·H2O和H2O2检测的动力学曲线
利用动力学曲线对P2Mo18与N2H4·H2O和H2O2的反应速率及可逆性进行考察. 图8为在3,6 mol/L HCl中, P2Mo18与N2H4·H2O和H2O2反应的动力学曲线. 由图8(A)可见, 随着反应时间的增加, 750 nm处的吸光度逐渐增大, 44.8 min后溶液的吸光度不再变化, 表明P2Mo18与N2H4·H2O的反应达到平衡. 由P2Mo18溶液与0.409 mmol/L H2O2反应的动力学曲线可见, 随着反应时间的增加, 750 nm处的吸光度逐渐降低, 23.9 min后溶液的吸光度不再变化, 表明还原态P2Mo18与H2O2的反应达到平衡. 由图8(B)可见, 在6 mol/L HCl溶液中, P2Mo18对N2H4·H2O和H2O2的响应时间分别为37.1,22.0 min, 表明响应速率随溶液酸度的增大而加快.

图8 在3 mol/L HCl(A)和6 mol/L HCl(B)中, P2Mo18与N2H4·H2O和H2O2 反应的动力学曲线Fig.8 Kinetic curves of P2Mo18 reacting with N2H4·H2O and H2O2 in 3 mol/L HCl (A) and 6 mol/L HCl (B)
2.5 P2Mo18溶液对N2H4·H2O检测的抗干扰性
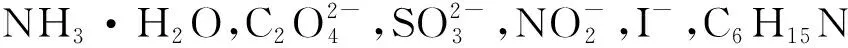

图9 P2Mo18与不同干扰组分混合溶液的吸收曲线Fig.9 Absorption curves of P2Mo18 and mixed solution of different interfering components
2.6 P2Mo18溶液对N2H4·H2O和H2O2检测的可重复使用性
利用动力学曲线对检测体系的可重复使用性进行考察, 结果如图10所示. 由图10可见: 在10 mmol/L P2Mo18溶液中加入0.119 mmol/L N2H4·H2O, 在750 nm处的吸光度逐渐增大; 在N2H4·H2O还原后的P2Mo18溶液中加入0.409 mmol/L的H2O2, 在750 nm处的吸光度逐渐降低; 循环检测3次, P2Mo18溶液在氧化状态与还原状态的吸光度无明显变化, 表明该体系对N2H4·H2O和H2O2的检测具有可重复使用性.

图10 N2H4·H2O和H2O2重复检测的动力学曲线Fig.10 Kinetic curves of repeated detection of N2H4·H2O and H2O2
综上所述, 本文基于Dawson型磷钼酸盐P2Mo18可逆的氧化还原性质, 在外界还原剂N2H4·H2O和氧化剂H2O2的作用下, 实现了P2Mo18溶液可逆的化学响应变色性质. 在此基础上, 基于P2Mo18可逆的氧化还原及变色性质, 利用紫外-可见光谱检测研究了P2Mo18溶液对N2H4·H2O和H2O2的可逆光谱检测. 该方法对N2H4·H2O检测的线性方程A=17.403 7c+0.081 9, 线性相关系数R2=0.999 1, 检出限cL=7.24×10-5mmol /L, 线性工作范围为7.24×10-5~0.119 mmol/L; 对H2O2检测的线性方程A=-5.865 7c+2.427 2, 线性相关系数R2=0.998 1, 检出限cL=2.15×10-4mmol/L, 线性工作范围为2.15×10-4~0.409 mmol/L. 动力学结果表明, 该体系可重复使用, 对N2H4·H2O和H2O2检测的响应时间分别为44.8,23.9 min. 抗干扰实验结果表明, P2Mo18溶液对N2H4·H2O的光谱检测具有较高的选择性.
