单宁酸和蛋白质相互作用机制及其对蛋白质理化及功能特性影响的研究进展
2022-08-03石长波孙昕萌赵钜阳袁惠萍
石长波,孙昕萌,赵钜阳,袁惠萍
(哈尔滨商业大学旅游烹饪学院,黑龙江哈尔滨 150030)
多酚类物质是植物次生代谢产物,由于其潜在的保健作用,近几十年来受到广泛关注。多酚类化合物主要存在于绿茶和红茶、葡萄酒(尤其是红酒)、一些水果和谷类食品中[1]。据估计,人类每天约摄入1 g多酚,其中单宁的平均摄入量占50 %以上[2]。单宁酸(Tannic acid,TA)又名丹宁酸、鞣酸,它的化学式为C76H52O46,分子量在500 到3000 kDa 之间,是一类复杂的高分子多元酚类化合物[2]。单宁酸通常分为可水解单宁和缩合单宁。可水解单宁酸是结构简单的酚类混合物,其中包括没食子酸和鞣花酸[3],结构如图1所示;缩合单宁也称原花青素或类黄酮[4],是以黄烷-3-醇为基本结构的聚合物,结构如图2所示。其用于合成各种次生代谢物,包括萜烯类、生物碱类和酚类化合物。

图1 可水解单宁结构示意图[4]Fig.1 Hydrolyzed tannin structure[4]
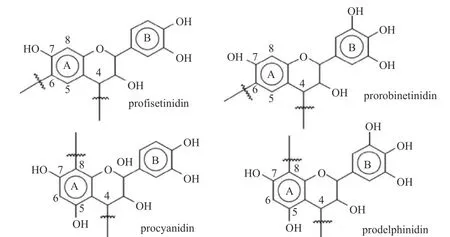
图2 缩合单宁的主要结构[4]Fig.2 Four main structures of flavonoid tannins[4]
单宁酸因其生物和药理活性而受到广泛关注(图3)。一方面,由于单宁具有抗菌、抗病毒和抗突变等活性,对人类慢性病的发展提供了保护作用[5]。另一方面,单宁酸作为抗氧化化合物,可以保护蛋白质、脂质和维生素等营养物质免受氧化[6]。单宁酸与食物中存在的碳水化合物、蛋白质或脂质等天然活性功能化合物的复合可改善许多聚合物的功能属性,扩大其应用领域。蛋白质和单宁酸之间的相互作用会自发地在大多数食品系统中产生“蛋白质-单宁酸复合物”,并且会影响食品的感官、功能和营养特性。研究表明单宁酸和蛋白质的复合物有助于改变食物结构[4],例如增强小麦面筋的强度[7]以及减少葡萄糖代谢[8];单宁酸还可以与蛋白质结合形成保护层,用来制备生物膜,例如Picchio 等[9]使用与卵清蛋白共价交联的单宁酸制备食品包装膜;另一方面,在食品体系中,单宁酸由于与蛋白质的相互作用进而引发沉淀,导致食物涩味的产生[10];并且单宁酸与消化道中的膳食蛋白相结合,会降低蛋白质的营养价值;蛋白质多肽碳酰基与单宁酸中的烃基形成氢键,结合病原体的酶和毒性蛋白使其失活进而抑制酶活性。
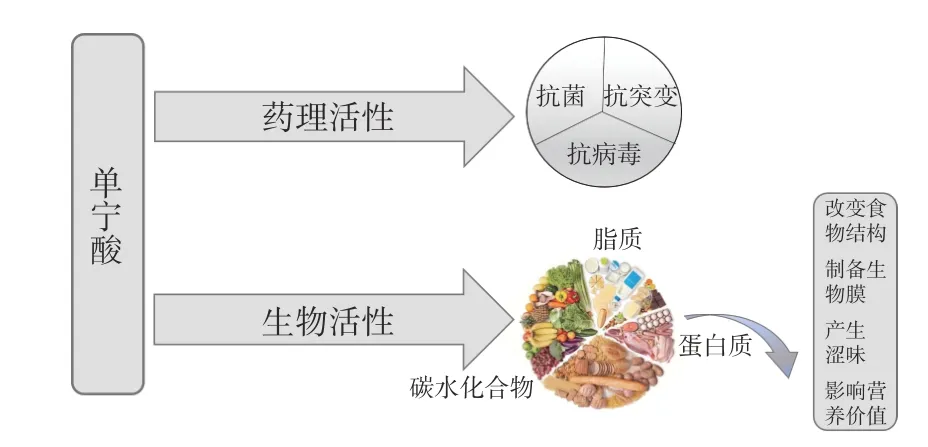
图3 单宁酸的生物和药理活性[11]Fig.3 Biological and pharmacological activities of tannic acid[11]
已知单宁酸和蛋白质的相互作用影响蛋白质的结构和功能特性等,更好地理解单宁酸与蛋白质的相互作用将有助于控制食品加工、运输和储存过程中蛋白质的功能特性。并且了解单宁酸和蛋白质之间的结合机制对于开发功能性食品配方和评估单宁酸的生物利用度是必不可少的。基于此,本文主要对单宁酸与蛋白质的相互作用进行阐述,包括单宁酸与蛋白质互作的机理、影响因素,以及单宁酸和蛋白质相互作用的应用,为开发单宁酸-蛋白质功能性产品提供理论依据。
1 单宁酸与蛋白质相互作用的机理
1.1 非共价相互作用
由于单宁酸含有众多的羟基,可以与蛋白质形成强烈的非共价相互作用[12],其中主要结合方式包括氢键、疏水作用和范德华力[13-14],如图4所示[15]。氢键产生于单宁酸的羟基和蛋白质的羰基和肽键之间[16]。在单宁酸与蛋白质结合的过程中,氢键是二者结合的主要驱动力。Jing 等[17]在pH6.0 下研究了TA 与牛乳铁蛋白(Bovine lactoferrin,LF)的络合。发现二者之间存在氢键相互作用,分子对接表明,TA 被残基Arg654,Pro655,Pro409,Ser601,Arg323,Ser322,Leu385,Tyr319,Leu318,Gln249,Leu687,Cys405,Thr688 和Lys404 包围(如图5)。Simon 等[18]通过核磁共振和分子模拟研究表明,原花青素二聚体B3 与唾液14-a.a 肽IB7 通过氢键结合。Frazier等[5]发现在单宁与富含脯氨酸的唾液蛋白片段结合的过程中,脯氨酸羰基与苯酚或邻苯二酚羟基基团之间通过氢键结合。疏水相互作用主要发生在多酚的苯环与蛋白质脂肪族、芳香族氨基酸之间[19],其中疏水性氨基酸,如亮氨酸,色氨酸等的蛋白质残基与单宁酸多酚的非极性芳香环相互作用[20]。Ishtikhar 等[1]发现单宁酸的芳香杂环能够与氨基酸残基之间发生疏水相互作用,从而引起蛋白质构象的改变。单宁酸与蛋白质相互作用方式也可能是混合方式,比如同时存在氢键和疏水相互作用,Wang 等[21]研究了玉米醇溶蛋白水解物与单宁酸的胶体络合,通过等温滴定量热法证实了二者之间的络合是由疏水相互作用和氢键驱动的。此外,酚类化合物的苯环与蛋白质非极性氨基酸侧链之间的疏水作用增强了范德华相互作用[22]。Cong 等[23]研究了单宁酸中的缩合单宁葡萄籽原花青素与动物源蛋白之间的相互作用,荧光结果表明二者主要作用力是范德华力、氢键和疏水作用。尽管形成的键可能是可逆的并且能量低,但是非共价蛋白-多酚相互作用可能在食品工业中对改善食品的功能和质量起重要作用。
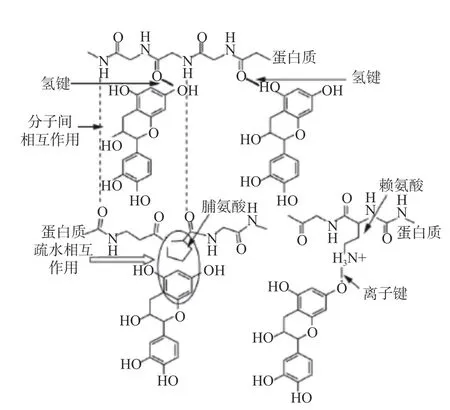
图4 单宁酸与蛋白质非共价作用机制[13]Fig.4 Mechanism of non-covalent interaction between tannic acid and proteins[13]

图5 乳铁蛋白与单宁酸分子对接图[17]Fig.5 Molecular docking diagram of lactoferrin and tannic acid[17]
1.2 共价相互作用
单宁酸和蛋白质的非共价结合是可逆的,然而二者之间的共价结合是不可逆的。蛋白质和单宁酸通过共价键结合,共价键由蛋白质的亲核基团,例如–NH2和–SH 与单宁酸氧化产生的醌基,如图6所示[15];或由酸催化缩合单宁酸解聚产生的碳阳离子之间的反应产生[22]。单宁酸与蛋白质的共价结合可能发生在碱性、氧化酶存在以及高温处理等条件下[23](图7)。单宁酸可以在碱性pH 下被带有侧链氨基的分子氧化成奎宁,从而导致蛋白质交联的形成[5],进而改变蛋白质的功能性和其他理化特性;在有氧及氧化酶存在条件下[24],单宁酸被氧化成醌,从而与蛋白亲核加成;在高温处理条件下,单宁酸会发生氧化和裂解,蛋白的二级结构也同时改变,氨基酸暴露程度增加[25]。
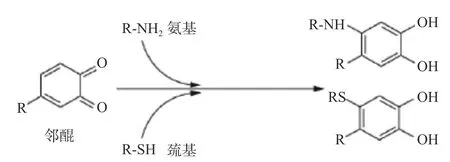
图6 邻醌与氨基、巯基的1, 4-亲核加成反应示意图[13]Fig.6 Schematic diagram of 1,4-nucleophilic addition reaction of o-quinone with amino and sulfhydryl groups[13]
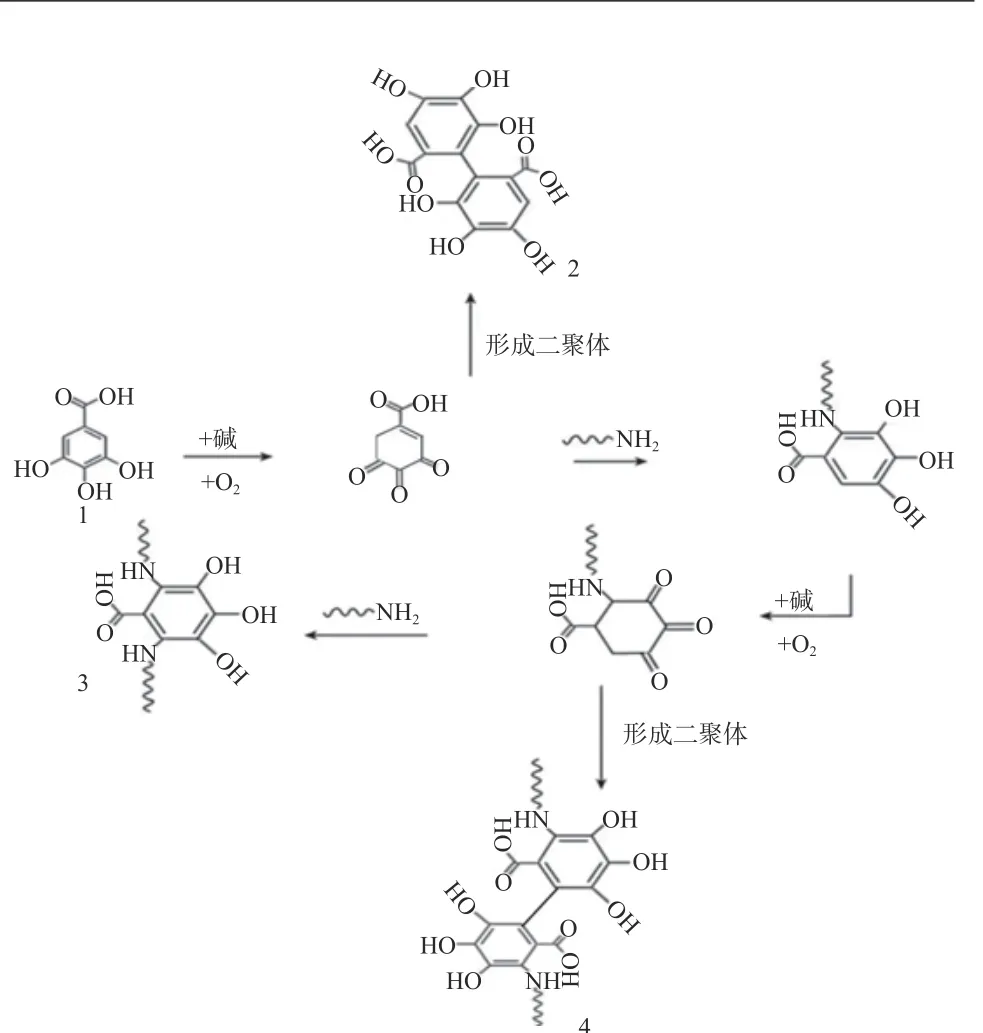
图7 碱处理形成蛋白质-单宁酸(没食子酸为例)复合物的机理[13]Fig.7 Mechanism of formation of protein- tannic acid (gallic acid as an example) complex by alkali treatment[13]
Guo 等[25]研究发现在碱性条件下,单宁酸(TA)可与大豆分离蛋白(Soy protein isolate,SPI)的共价交联,形成的SPI-TA 复合物可改善SPI 抗氧化活性和凝胶特性,且碱处理后,复合物中的色氨酸含量降低,共价结合率提高。Nie 等[26]发现在碱性和加热条件下,单宁的掺入导致肌原纤维蛋白的聚合,并会产生具有较高拉伸强度和较低水蒸气透过率的薄膜,此外,还发现氧化的单宁和肌原纤维蛋白之间的主要相互作用是形成非二硫键的共价键。Chen 等[27]发现在碱性及有氧条件下,氧化的单宁酸与猪血浆蛋白水解产物通过共价键发生相互作用。其中单宁酸的C–S 或C–N 键与多肽的巯基或氨基侧链形成了二聚体或共价共轭物。目前,描述可逆相互作用的研究数量多于不可逆相互作用,主要是由于缺乏合适的方法来定量分子间共价键,因此单宁酸与蛋白质的共价相互作用机理探究将是未来的研究方向之一。
2 单宁酸与蛋白质相互作用的影响因素
单宁酸和蛋白质相互作用类型受条件的影响(图8),进而影响蛋白质的功能特性以及单宁酸的活性。此外,单宁酸与蛋白质的相互作用很大程度上取决于蛋白质和单宁酸的构象或类型以及环境条件。不同种类的蛋白质氨基酸组成、疏水性和等电点均不同,这会影响蛋白质与多酚的结合能力[10]。根据Yildirim-Elikogl 等[28]的发现,未折叠的天然蛋白质对多酚的亲和力比致密和球形的蛋白质强,这是因为氨基酸残基与多酚相互作用的可能性更高。不同的酚类化合物在分子量,羟基化,甲基化,氢化和糖基化上有不同的变化,这强烈影响蛋白质与多酚的相互作用。此外,还包括一些环境因素,如温度、酸碱度、离子强度和加工条件等。温度会影响氢键并导致疏水键的形成;不同的pH 会改变蛋白质的构象以及蛋白质和多酚的电荷,从而影响蛋白质与多酚之间相互作用的程度和类型[23]。此外,蛋白质和单宁酸之间的亲和力会随离子强度的增加而增加。

图8 单宁酸与蛋白质相互作用影响因素图Fig.8 Influence factors of tannic acid-protein interaction
2.1 蛋白质的类型
蛋白质的结构、分子量、疏水性和氨基酸序列强烈影响其与单宁酸的结合亲和力[29]。不同结构的蛋白质与单宁酸的结合亲和力不同。Xie 等[30]研究了牛血清白蛋白、β-乳球蛋白、卵清蛋白与单宁酸的复合,发现三种蛋白质对单宁酸的结合亲和力为牛血清白蛋白>β-乳球蛋白>卵清蛋白,因为牛血清蛋白相比其他两种蛋白质有更多的结合位点与单宁酸结合。具有灵活、无规则卷曲结构的蛋白质比球状的蛋白质更容易与单宁酸结合[6]。Girard 等[31]研究表明谷蛋白由于具有较大分子量、开放的结构、脯氨酸含量较高更易与单宁酸相互作用。缩合单宁(原花青素)与疏水性不同的蛋白质相互作用时,表现出的相互作用强度不同。Prigent 等[32]发现牛血清白蛋白比α-乳清蛋白和溶菌酶更疏水,与原花青素的结合亲和力更高[33]。另外,蛋白质表面上脯氨酸的含量还决定了蛋白质与多酚之间的结合能力,蛋白质中脯氨酰残基的吡咯烷环能够作为结合位点,与多酚的没食子酸环结合[20]。序列中含有高比例脯氨酸残基的蛋白质,例如唾液蛋白质,与单宁酸的结合能力更强[20]。
2.2 单宁酸的结构
多酚的分子量、结构以及羟基的数量在蛋白质与多酚的相互作用中起着重要作用。研究表明,高分子量的单宁酸能够优先与蛋白质结合。Jakobek 等[34]发现聚合度和分子量较高的单宁酸沉淀蛋白质的能力会增强。Carvalho 等[35]研究发现缩合单宁比水解单宁结合蛋白质的能力更强。
单宁酸结构的灵活性也会影响单宁酸和蛋白质之间的相互作用。例如,没食子单宁具有柔韧性,通过分子内旋转,可以很容易地改变分子构象,能够适应蛋白质的结合口袋结构[36]。此外,单宁酸与蛋白质结合的顺序随着分子上羟基数量的增加而增加[37]。Amoako 等[38]研究发现单宁酸可以通过其羟基和芳香环在蛋白质表面充当多齿配体,并且二者的结合程度随着二者聚合度的增加而增加。
2.3 环境因素
2.3.1 温度 温度是影响酚类化合物与蛋白质结合亲和力的重要环境因素。在蛋白质与多酚的体系中,温度主要会影响氢键和疏水相互作用。当温度升高时,会引起蛋白质构象的改变,并暴露先前埋藏的疏水位点,引发与酚类化合物上非极性基团的疏水相互作用,疏水相互作用力增强,氢键作用力减弱甚至消失[13]。Prigent 等[37]发现在5、25 和60 ℃条件下,5-O-咖啡酰奎宁酸对葵花籽11S 蛋白和牛血清白蛋白的结合亲和力随温度升高而降低。
2.3.2 pH 另一个环境影响因素是pH。pH 直接影响单宁与蛋白质之间的相互作用,因为pH 会影响溶液离子化程度。通常,在低pH 和高pH 时,二者结合和沉淀的程度会降低,在接近等电点处,达到最大程度,此时蛋白质之间的静电排斥最小[22]。Bourvellec等[36]发现球状蛋白质,例如牛血清白蛋白在pH4.9时与TA 结合的亲和力比在pH7.8 时更高。在接近蛋白质等电点的pH 下,观察到蛋白质-单宁复合物的沉淀增加,因为这些复合物在该pH 下的溶解度较低[33]。粗单宁菜籽油提取物与牛血清白蛋白、胎球蛋白、明胶和溶菌酶结合后产生的沉淀,都在蛋白质的等电点附近观察到[33]。研究表明单宁酸和唾液蛋白在pH 为3.5 时结合,比在pH 为7 时结合,产生的涩味更强[37]。这是因为相互作用的分子的电荷或氢键形成位点结构的变化,从而导致涩味的变化。Jauregi等[39]将乳清蛋白与单宁络合,二者相互作用产生沉淀有效降低了涩味。
2.3.3 离子类型 离子类型也能够影响单宁和蛋白质之间的相互作用。随着离子强度的增加,蛋白质的疏水氨基酸残基可以暴露出来,增加了蛋白质和单宁之间的亲和力[40],此外离子浓度还会影响蛋白质的消化率。Elaine 等[33]观察到二价阳离子能够增加单宁酸和蛋白质的亲和力并影响蛋白质的消化率。其中Mg2+和Ca2+能够降低蛋白质消化率,而Mn2+使蛋白质的消化率增加了。Kaspchak 等[41]采用等温滴定量热法研究单宁酸与蛋白质的相互作用,结果表明在高离子强度条件下单宁酸和蛋白质的结合,降低了蛋白质的消化率。
2.3.4 加工条件 不同的加工条件对蛋白质和单宁酸复合物的影响效果依具体的反应条件而异。在不同的加工条件下,能够改变单宁酸的化学结构,从而改变生物活性[42]。研究表明高压处理能够增强多酚和蛋白质分子间的氢键和疏水相互作用,从而形成粒径更小、结构更紧密的复合物[43]。富含原花青素的葡萄籽提取物经高强度超声纯化后,原花青素的抗氧化活性显著提高[42]。此外,一些非热加工技术的使用,可以改善蛋白质的功能特性,有利于更好的应用在食品领域。经超声和高压均质处理后,蛋白质的溶解性、乳化性均有显著提高[44]。目前,大多数研究集中在其他酚类化合物和蛋白质的预处理,对单宁酸和蛋白质复合物进行不同加工条件预处理的研究较少,未来可考虑通过调节加工条件来改善单宁酸和蛋白质复合,使其更好的应用于食品领域。
2.3.5 其他环境因素 单宁酸-蛋白质的相互作用也可能受到其他环境因素的影响,例如当复合物体系中存在其他物质时,通过改变溶液的极性或是改变体系的表面活性等,也会相应影响单宁酸-蛋白质间的相互作用。例如溶液中含有乙醇能够改变溶液的极性。陈雨桐等[45]研究发现单宁酸与小麦醇溶蛋白溶解在乙醇-水溶剂中时,色氨酸的最大发射波长比在水溶液中有所偏移,这是由于乙醇的存在导致溶剂的极性降低,从而造成色氨酸最大发射波长蓝移。此外,有些表面活性剂可与蛋白质相互作用,吸附在气/水、油/水、乳状液等界面[46],进而改变蛋白质的功能性质。邹苑[47]通过制备玉米醇溶蛋白-单宁酸-十二烷基硫酸钠(Sodium dodecyl sulfate, SDS)复合体系,发现SDS 加入改善了复合物的起泡性和起泡稳定性,因此也可以通过添加表面活性剂等人工分子伴侣,介导单宁酸-蛋白质相互作用,进而优化蛋白乳液性质。
3 单宁酸对蛋白质结构与特性的影响
单宁酸通过共价或者非共价与蛋白质进行相互作用,二者之间互作受多种因素影响,且不同种类蛋白质的结构和功能性变化不同,二者复合后对蛋白质的结构、功能特性以及对单宁酸的生物利用率均会产生显著影响(图9),进而影响复合物在食品领域中的应用。

图9 单宁酸和蛋白质互作对蛋白质理化及功能特性影响概述Fig.9 Summary of the effects of tannic acid and protein interaction on physicochemical and functional properties of proteins
3.1 对蛋白质结构的影响
单宁与蛋白质相互作用对蛋白质结构性质的影响可以用荧光光谱、差示扫描量热法、圆二色谱、傅里叶红外变换光谱、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳等技术来研究。蛋白质游离氨基酸和巯基含量的变化可以反映蛋白质一级结构的变化。单宁酸含有大量的羟基,羟基转化为具有交联作用的醌,进而与巯基相互作用[48]。此外,羟基还可以与氨基相互作用,导致氨基含量的降低。有研究发现在鱼肌原纤维蛋白中添加单宁酸,单宁酸与肌原纤维蛋白通过共价结合,结合后复合物中氨基和巯基含量显著降低[49]。蛋白质二级结构的变化反映为α-螺旋、β-折叠、β-转角和无序卷曲结构的百分比变化。Wang 等[50]研究了单宁对面筋蛋白结构性质的影响,傅里叶变换红外光谱分析表明,添加单宁后面团中β-转角和α-螺旋构象增加,而β-折叠构象减少,表明单宁酸能够促进面筋蛋白的聚集从而改善面筋网络的微观结构。然而,有研究表明单宁的加入,会诱导蛋白质参与其他反应,因此不会改变或破坏大豆蛋白的二级结构[48]。Deng 等[51]发现原花青素与大豆铁蛋白质的相互作用,不能引起大豆铁蛋白质的二级结构的改变,这是因为原花青素与铁蛋白的交联,诱导蛋白与蛋白相互作用的发生,导致铁蛋白质聚集体产生。单宁酸与蛋白质发生相互作用时,蛋白质三级结构的变化可以反映为色氨酸及酪氨酸残基的极性变化。Xie 等[30]通过制备单宁酸-β-乳球蛋白复合物,发现β-乳球蛋白的荧光强度随着单宁酸浓度的增加而降低,荧光峰波长发生红移,表明Trp 残基周围极性增强,疏水性显著降低。综上所述,单宁酸与蛋白质互作会引起蛋白质结构发生不同程度的改变,具体的影响与蛋白质的种类有关。
3.2 对功能特性的影响
单宁酸和蛋白质复合会影响蛋白质的功能特性,如溶解性、起泡性、乳化性、抗氧化能力等,还可能会对产品感官品质以及贮藏特性产生影响。曹慧英等[52]将玉米黄粉蛋白(Corn Yellow Protein,CYP)与TA 复合,结果表明TA 的加入CYP 的溶解性和抗氧化活性显著提高。Wang 等[53]利用玉米蛋白水解酸(Corn Protein Hydrolytic Acid,CPH)与TA 的复合物来改善CPH 本身的发泡特性,与纯CPH 相比,CPH-TA 复合物保持了CPH 本身良好的发泡能力,且提高了其泡沫稳定性。用酚类化合物改性的蛋白质可用作食品体系中的乳化剂,以降低乳液稳定性并增加油滴的尺寸。单宁酸和蛋白质相互作用后可以使乳液具有良好的氧化稳定性,可用作乳化食品体系中的抗氧化剂和乳化剂。Li 等[54]将豌豆蛋白和单宁酸制成复合物,研究它们在亚麻籽水包油乳液中作为抗氧化剂和乳化剂的能力。结果表明,复合物能够增强亚麻籽油输送系统的氧化稳定性。Intarasirisawat等[55]研究发现氧化单宁酸与鱼卵蛋白水解物结合后,可以增强乳液的稳定性和氧化稳定性。一些发现表明,由于蛋白质表面的活性以及单宁酸的抗氧化活性,单宁酸与肉制品中的蛋白质相互作用,可以提高蛋白质结构稳定性,并改善肉类产品的质量。Zhong等[56]在腌制猪肚中添加不同浓度的单宁酸,研究肌原纤维蛋白的水分分布和结构特性的变化。结果表明,添加浓度为0.50 g/kg 的单宁酸可以抑制腌制过程中水分流失,并保持肌原纤维蛋白的结构稳定性。
3.3 对营养特性和消化率的影响
食物蛋白质的营养价值取决于几个因素,其中包括蛋白质来源、氨基酸组成、消化过程中对水解的敏感性等,单宁酸与蛋白质结合可能影响某些氨基酸的有效性,也可能改变蛋白质的结构,从而影响蛋白质的营养特性、消化率以及酶活性[37]。大豆蛋白与没食子酸、咖啡酸、槲皮素等几种酚类化合物作用后,赖氨酸、半胱氨酸、色氨酸含量降低[57]。高粱中缩合单宁与高粱中主要蛋白质发生络合作用会导致高粱蛋白消化率下降。原花青素也可以导致蛋白质沉淀和消化酶的抑制,从而改变蛋白质的消化率。Jing 等[17]将TA 与LF 复合,通过蛋白水解消化实验证明,TA 的加入降低了LF 的消化能力,根据这一特性可以改善生物复合物的消化稳定性,用于口服药物的功能成分。
此外,单宁酸与蛋白质相互作用后还会影响单宁酸的相关性质,如改变单宁酸的生物利用率。单宁酸与人血清白蛋白(Humanserum albumin, HSA)结合会降低单宁酸的生物利用度。HSA 是血浆中含量较多的蛋白质,主要用于结合一些重要的生物化合物,如胆红素。而当TA 进入人体代谢至血液中时,TA 和HSA 的相互作用能够影响人血清白蛋白的化学结构和结合能力。另一方面,二者结合会导致单宁从血液中清除,最终降低单宁酸的生物利用率[39]。
4 总结与展望
对于单宁酸和蛋白质相互作用的研究日渐增多,这些相互作用可以是非共价的,例如疏水相互作用或氢键等;也可以在单宁转变成醌或酚基形式后与蛋白质进行共价结合。二者之间互作受蛋白质的类型,酚类化合物的结构以及环境因素的影响,并会引起蛋白质理化及功能特性的改变,还会影响单宁酸的相关性质。更好地理解单宁酸与蛋白质的相互作用将有助于控制食品加工、运输和储存过程中蛋白质的功能特性,未来的研究应考虑对不同基质和不同加工条件下蛋白质与单宁酸的相互作用进行更深入的研究,以指导开发富含单宁酸的功能性食品,提高其营养和健康效益,进一步扩大其应用领域。
