9 种腹泻性贝类毒素的高效液相色谱-串联质谱测定方法的建立
2022-08-03赵晓野
王 婷,梁 琼,赵晓野,王 儒
(海南省食品药品检验所海口分所,海南海口 570311)
海洋生物毒素是一类存在于海洋生物体内的特殊高活性代谢产物,多存在于贝类及西甲鱼类中,其生物结构为生物碱和多肽,按其毒素毒性作用机制可分为麻痹性贝类毒素、腹泻性贝类毒素、失忆性贝类毒素及神经性贝类毒素。其中腹泻性贝类毒素(Diarrhetic Shellfish Poisoning,DSP)是一类大环内酯或聚醚的脂溶性化合物,主要是由原甲藻类和鳍藻等藻类产生[1-4]。DSP 毒素包括:米氏裸甲藻毒素(Gymnodimine,GYM)、螺环内酯毒(Spirolides,SPXs)、软海棉酸毒素(Okadaic acid,OA)及其衍生物鳍藻毒素(Dinophys-istoxin,DTX 毒素)、聚醚类毒素,如原多甲藻酸(Azaspir acid,AZAs),蛤毒素(Pectonotoxin,PTXs)和虾夷扇贝毒素[5-6]。贝类等虑食性动物通过滤食有毒藻类而使得DSP 在体内富集,危害食用者健康。当人们误食染毒的贝类后就会造成中毒,症状主要表现为腹泻,与一些普通腹泻症状相似,所以往往被人们忽视[7-8]。DSP 在全球沿岸海域均有分布,是世界范围内具有最严重威胁的赤潮藻毒素之一。由于腹泻性贝类中毒现象普遍存在,且分布较广、致毒性强,故被列为世界食品卫生学重要问题之一。
目前贝类毒素检测方法有小鼠生物测定法(MBA 法)、酶联免疫吸附测定(ELASA)法、高效液相色谱-荧光法、高效液相色谱-串联质谱法(HPLCMS/MS)等[9-14]。虽然MBA 法是腹泻性贝类毒素最普遍的检测方法,但该方法需大量使用小鼠,不符合“3R”的要求[15],而且灵敏度低、准确性和重现性差,具有易出现假阳性和无法确定毒素的成分、结构和含量等缺点;ELASA 试剂盒虽灵敏度高、操作简单,但其试剂盒昂贵,也有因类似物干扰作用,出现假阳性的情况[16],不适合日常监测使用;高效液相色谱-荧光法是国内外目前常用的贝类毒素检测方法,但是分析过程中使用的柱衍生试剂如ADAM 价格昂贵[17],背景干扰对试验结果影响大,操作繁琐,重复性差,因此其应用受到一定的限制;HPLC-MS/MS 测定是近年兴起的一种检测技术,比其他方法重复性好,不会出现假阳性,是一种能够准确定性定量,并能够提供准确的分子结构信息的新型分离技术[18]。在众多的分析测试方法中,HPLC-MS/MS 以其同时具备高特异性和高灵敏度的特点而被广泛应用于生物毒素研究领域。
此次研究以可食用新鲜贝类为研究对象,针对其中可能存在脂溶性贝类毒素的污染情况,开发了适用于腹泻性贝类毒素的检测方法,通过快速、高效的QuEChERS 和分散固相萃取技术进行净化,建立HPLC-MS/MS 法对9 种腹泻性贝类毒素进行定性和定量测定,以获得快速、准确的检验数据,为不安全贝类产品及其制品的毒素检测提供依据,为监管部门提供可靠的技术支撑和参考价值,保障广大消费者的生命健康安全。
1 材料与方法
1.1 材料与仪器
菲律宾蛤仔、魁蚶、栉江珧、波纹巴非蛤、华贵栉孔扇贝、裂纹格特蛤、翡翠贻贝、钝缀锦蛤、方斑东方螺、蛏子等,分别于海南省海口市、文昌市、琼海市、三亚市、儋州市、东方市五个取样点进行采样;甲醇、乙腈、正己烷、二氯甲烷 均为色谱纯,德国默克公司;无水硫酸钠、无水硫酸镁、氯化钠、氢氧化钠、盐酸 均为分析纯,广州化工;甲酸 色谱纯,美国ACS 公司;乙酸铵 色谱纯,美国Fisher 公司。
标准物质:大田软海绵酸(Okadaic acid, OA):8.4±0.4 μg/mL,鳍藻毒素1(Dinophys-istoxin, DTX1):8.5±0.7 μg/mL,鳍藻毒素2(Dinophys-istoxin, DTX2):3.83±0.25 μg/mL,扇贝毒素2(Pectonotoxin, PTX2):4.4±0.13 μg/mL,原多甲藻酸贝类毒素1(Azaspir acid,AZA1):1.3±0.07 μg/mL,原多甲藻酸贝类毒素2(Azaspir acid, AZA2):1.22±0.06 μg/mL,原多甲藻酸贝类毒素3(Azaspir acid, AZA3):1.18±0.25 μg/mL,米氏裸甲藻毒素(Gymnodimine, GYM):2.5±0.13 μg/mL,螺环内酯毒素1(Spirolides, SPX1):7.25±0.3 μg/mLNRC,加拿大海洋研究中心。
LC 1290-MS 6460 液相色谱-质谱联用仪 美国安捷伦科技有限公司;Multi Reax(EU)涡旋振荡器德国海道尔夫(Heidolph)公司;MS3 D S025 涡旋仪德国IKA 仪器设备有限公司;舒美KQ-50 超声仪昆山仪器;3-18K 离心机 德国SIGMA 公司;TTLDCII 氮吹仪 同泰公司;MSE125P-CE(感量为0.00001 g)天平 德国Sartorius 公司;PL602-L 天平(感量为0.01 g) 瑞士梅特勒-托利多公司;Milli-Q IQ7000 超纯水系统 美国默克密理博公司;Prime HLB 固相萃取小柱(6 cc,200 mg)、MCX 混合型阳离子柱(6 cc,200 mg)、C18固相萃取柱(6 cc,200 mg)美国Waters 公司;C18粉美国Agela 公司;腹泻性贝类毒素免疫亲和柱(3 mL) 美正生物。
1.2 标准溶液配制
精确量取一定量标准物质溶液,用乙腈配制成1 μg/mL 标准储备液;取1 mL 储备液,用乙腈定容至10 mL,得到100 ng/mL 标准使用液。称取阴性空白样品,按照前处理过程处理样品,得到空白基质。取一定量标准使用液,用空白基质配制成浓度梯度为0.5、1、2、5、10、20、50 ng/mL 的标准曲线[19-22]。
1.3 样品制备
样品用清水洗净外部泥沙,去壳取出贝肉,再将贝肉用超纯水清洗干净,沥干水分,将样品剪碎后用均质机均质备用。样品制备完成后,放置-20 ℃冷冻储存,测定前将其室温解冻。
1.4 样品处理方法
样品经80%乙腈水提取,利用QuEChERS 和分散固相萃取技术进行净化,具体操作如下:称取2.00 g 样品,加入10 mL 80%乙腈水溶液,再加入1 g 无水硫酸镁和0.5 g 氯化钠,涡旋振荡5 min,5000 r/min离心5 min,取上清液40 ℃氮吹近干,甲醇定容至1 mL,再加入125 μL 氢氧化钠溶液(2.5 mol/L),于76 ℃下温育40 min 后冷却至室温,再加入125 μL 盐酸溶液(2.5 mol/L),所得水解液中加入0.05 g C18粉和0.1 g 无水硫酸镁,涡旋振荡,5000 r/min 离心5 min,过0.22 μm 有机滤膜,上机检测。
1.5 分析条件
1.5.1 液相色谱条件 色谱柱:Waters ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm)。流动相A相为5 mmol/L 乙酸铵0.1%甲酸水溶液,B 相为乙腈,梯度洗脱程序见表1。流速:0.3 mL/min。柱温:30 ℃。进样量:5 μL。

表1 梯度洗脱程序Table 1 The gradient elution program
1.5.2 质谱条件 离子源:AJS ESI;扫描方式:Positive/Negative;检测方式:多重反应监测(MRM);毛细管电压:4000 V;雾化器压力:35 psi;离子源温度:300 ℃;氮气作为鞘气和碰撞气,其中鞘气为11.5 L/min,辅助气为1.65 L/min。各组分监测的MRM 参数见表2。

表2 MRM 参数Table 2 MRM parameters
1.6 方法学验证
本研究采用外标法进行定量,根据目标物所建立标准曲线,计算各目标化合物的线性范围、检出限。同时称取空白样品进行样品加标回收实验,每个样品做6 个平行样,计算目标物的回收率和精密度。
1.7 数据处理
本文图谱采用安捷伦Qualitative Analysis B.07.00>绘制。数据处理采用安捷伦QQQ Quantitative Analysis 软件进行标准曲线建立、实验结果计算、信噪比计算。提取液选择中的回收率的计算、不同净化方法回收率的计算均采用两个平行样品取平均值计算。精密度选择三个浓度梯度,每个浓度梯度取连续采集6 针数据的峰面积进行相对标准偏差RSD值的计算。方法检出限按照检出限公式:检出限=3×对照品浓度×样品稀释体积/信噪比/取样量,计算出目标物检出限。
2 结果与分析
2.1 质谱条件优化
根据9 种DSP 的分子量以及化学电离性质,分别在正、负离子扫描模式下进行母离子全扫描,筛选相应较高的离子对。对目标物浓度为1 μg/mL 标准液进行一级离子扫描,扫描结果显示OA、DTX-1、DTX-2 在负离子模式下响应更高,其余化合物在正离子模式下响应更优。在获得分子离子峰后,进行二级质谱扫描,选择多反应监测(MRM)扫描,对Fragmentor 电压和碰撞能(Collision Energy)等质谱参数进行优化,最终得到表2 的质谱参数。在该仪器条件下对浓度为50 ng/mL 的9 种DSP 混合标准溶液进行测定,单个物质色谱图如图1~图9所示,9 种DSP 总离子流图如图10所示,所有物质均在9 min 前完成出峰,响应值均在103以上。

图1 大田软海绵酸色谱图Fig.1 Acid chromatogram of okadaic acid

图2 鳍藻毒素1 色谱图Fig.2 Acid chromatogram of dinophysistoxin-1

图9 螺环内酯毒素1 色谱图Fig.9 Acid chromatogram of spirolides
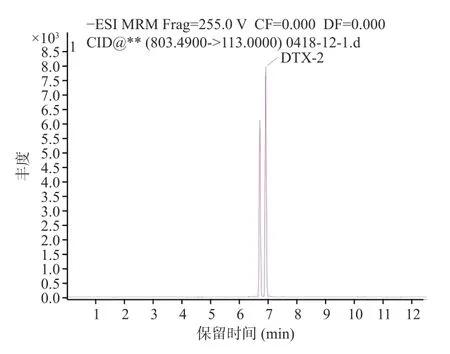
图3 鳍藻毒素2 色谱图Fig.3 Acid chromatogram of dinophysistoxin-2
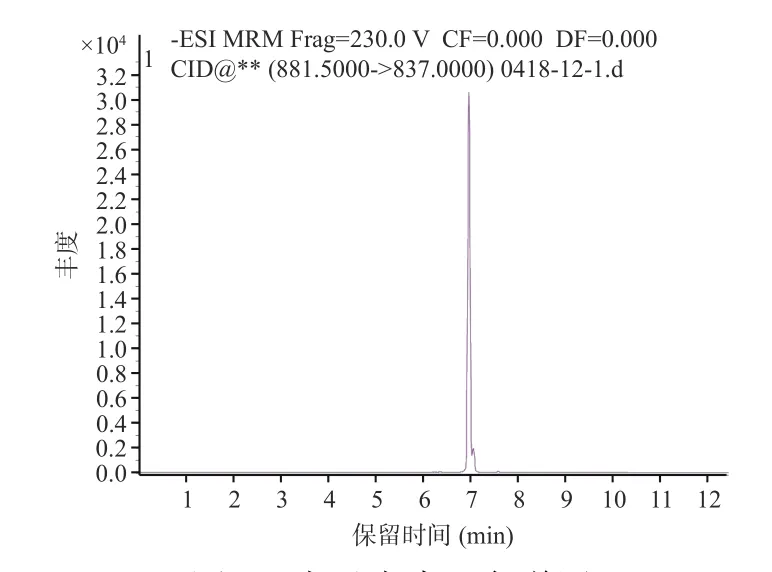
图4 扇贝毒素2 色谱图Fig.4 Acid chromatogram of pectonotoxin-2
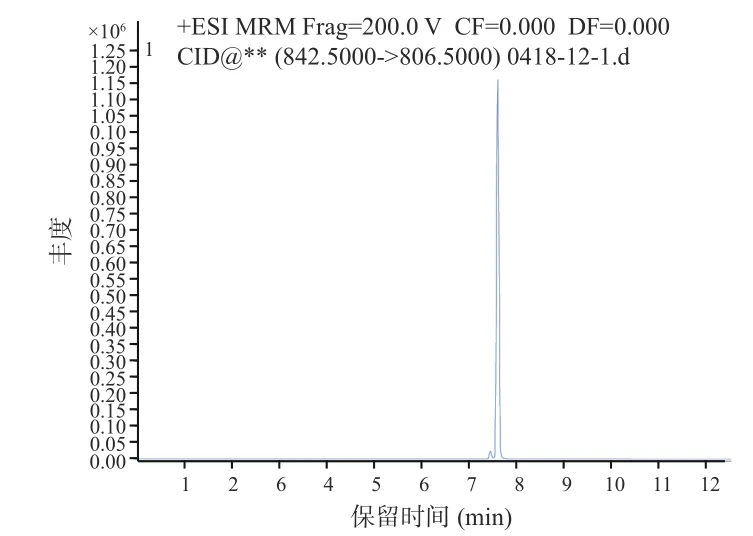
图5 原多甲藻酸贝类毒素1 色谱图Fig.5 Acid chromatogram of azaspir acid-1

图6 原多甲藻酸贝类毒素2 色谱图Fig.6 Acid chromatogram of azaspir acid-2
2.2 液相条件优化
DSP 属于亲脂性海洋生物毒素,在理化性质方面呈现多样性,如其含有羧酸、磺酸、氨基和亚氨基官能团[23-28]。DSP 毒素有一定的复杂性,根据碳骨架结构将这些成分分为酸性成分、中性成分以及碱性成分[29-30]。因此,实验过程中流动相选择、样品前处理和净化洗脱都要考虑到目标物的属性。
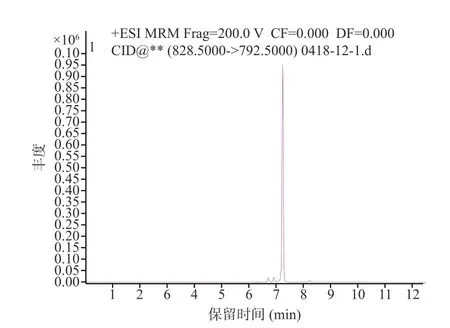
图7 原多甲藻酸贝类毒素3 色谱图Fig.7 Acid chromatogram of azaspir acid-3

图8 米氏裸甲藻毒素色谱图Fig.8 Acid chromatogram of gymnodimine
2.2.1 色谱柱选择 本实验采用了比较常见的C18反相色谱柱。研究比较了ACQUITY UPLC BEH C18色谱柱和ACQUITY UPLC HSS T3色谱柱分离效果的差异[31]。比较图10 和图11 发现,C18分离效果相较T3柱更好,因此选用Waters ACQUITY UPLC BEH C18的液相色谱柱对其余毒素进行采集分离。实验中发现C18柱不仅对软海棉酸(OA)类毒素的分离效果好,对其他DSP 也能够完全分离,没有毛峰,而且灵敏度也较高,满足实验需要。
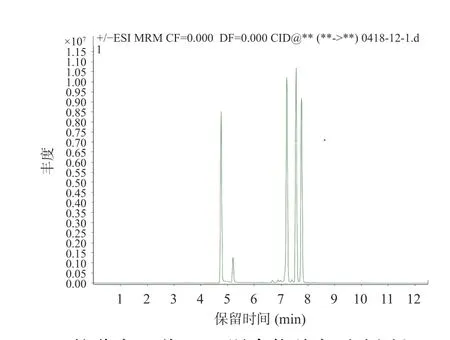
图10 C18 柱分离9 种DSP 混合物总离子流图(50 ng/mL)Fig.10 Total ion flow diagram of separation of 9 DSP mixtures on C18 column(50 ng/mL)
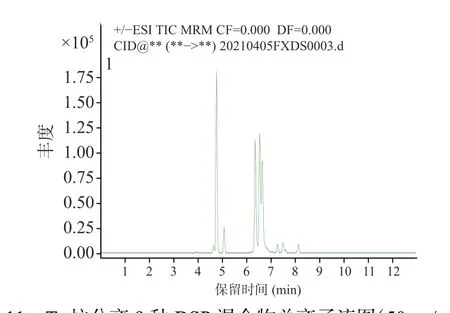
图11 T3 柱分离9 种DSP 混合物总离子流图(50 ng/mL)Fig.11 Total ion flow diagram of separation of 9 DSP mixtures on T3 column(50 ng/mL)
2.2.2 流动相的选择 因DSP 是一种脂溶性物质,且9 种目标物中存在酸性成分、中性成分和碱性成分。根据其不同的性质以及9 种目标物在质谱上正、负离子不同扫描模式不同,在流动相中添加甲酸,使得H+浓度增加,增强离子化效率,在正离子扫描模式下提高响应;同时在流动相中添加弱碱性的缓冲盐溶液,增强分离度,提高负离子扫描模式下的响应。所以选择5 mmol/L 乙酸铵水溶液(加0.1%甲酸)和乙腈为流动相,通过改变流动相的比例对DSP 混合标准溶液进行分离实验,最终采用梯度洗脱方法将9 种DSP 毒素完全分开,并且灵敏度较高,峰形尖锐平滑对称,最佳的洗脱条件见表1。
2.3 前处理步骤优化
2.3.1 提取液选择 目前常用的提取剂有乙腈、甲醇、丙酮等[32-33]。本实验对比纯甲醇、80%甲醇水溶液、80%乙腈水溶液进行提取。在同一加标水平,三种提取液提取效果见表3。结果显示纯甲醇的总体回收率较差,因甲醇对脂肪具有一定的溶解性,会降低提取效果;80%乙腈水溶液比80%甲醇水溶液总体回收率略高,因乙腈比甲醇使蛋白质变性的能力更强,为降低基质影响,最后选择80%乙腈水溶液作为提取液。

表3 不同提取液回收率比较Table 3 Comparison of recovery rates of different extracts
2.3.2 酯化态DSP(DTX-3)水解释放 据所查阅资料,对DSP 提取方法研究大多数都未涉及到DTX-3。DTX-3 是OA、DTX-1、DTX-2 的酯化态形式,存在于贝类样品中[33-34],本身对人体无害,但其在碱性条件下可以水解释放出有毒的OA、DTX-1、DTX-2,致人中毒。因此实验前处理中加入水解一步,这样更能准确定量贝类中DSP 的含量。
2.3.3 净化方法的选择 贝类样品基质复杂,富含蛋白质和脂肪等,待测样品净化不足极易污染离子源,导致HPLC-MS/MS 的检测易被杂质干扰,从而灵敏度下降,定量偏低,所以净化方法对结果影响很大。为了降低基质效应,应选择适当的净化方法。本实验比较了液液萃取、固相萃取(包括Prime HLB 固相萃取小柱、MCX 固相萃取小柱、腹泻性贝类毒素免疫亲和柱)和QuECHERS 净化方法对DSP 的加标回收效果如下表4所示。

表4 不同净化方法比较Table 4 Comparison of different purification methods
液液萃取技术试剂用量大,操作繁杂,并且实验过程中容易产生乳化现象,降低提取效率;Waters Prime HLB 固相萃取小柱,无需活化,实验步骤简单易操作,并且净化脂肪、蛋白质等大分子物质能力较强,通用能力较强,但是对毒素吸附性较强,不易洗脱干净,导致大部分毒素回收率偏低至50%以下,对实验准确度影响较大;Waters MCX 混合型阳离子交换柱,由于具有磺酸基基团,所以对碱性化合物具有很高的选择性和灵敏度。交换柱对于GYM、SPX、OA、PTX2、AZA-1 净化效果尚佳,回收率范围为82.4%~107.3%,但对其他毒素净化效果较差,回收率范围为72.6%~79.7%,整体偏低;腹泻性贝类毒素免疫亲和柱回收率在90.2%~104.7%间,回收效果很好,但操作复杂,成本非常昂贵,不适合大批量检测。
因C18可以有效去除脂类和碳水化合物,所以采用以C18粉和无水硫酸镁的混合物对腹泻性贝类毒素进行净化的QuEChERS 方法。但过量使用C18也会降低回收率。多次试验后发现,如果预先加入0.1 g无水硫酸镁,再加入0.05 g 净化吸附剂C18,即可获得最高的回收率。9 种毒素回收率均在87%~112%的范围为内,净化效果较好。对于基质较为复杂的样品,无需增加额外的处理,即可达到满意的净化效果,同时节省了实验的时间和成本,因此实验前处理选择QuECHERS 净化方法。
2.4 方法学验证
2.4.1 方法的线性范围和检出限 为消除基质效应对分析结果的影响,将100 ng/mL 标准使用液用空白基质配制成线性范围为0.5~50 ng/mL 的标准曲线。以各目标化合物的浓度(ng/mL)为横坐标,响应值的峰面积为纵坐标建立标准曲线。将阴性样品中添加9 种腹泻性贝类毒素混合标准使用液,使得上机检测理论浓度为0.5 ng/mL,在优化的色谱条件下进回收试验,经测定信噪比(S/N)均大于3,按照检出限公式:检出限=3×对照品浓度×样品稀释体积/信噪比/取样量,计算出目标物检出限。相应的线性方程、相关系数和检出限见表5。
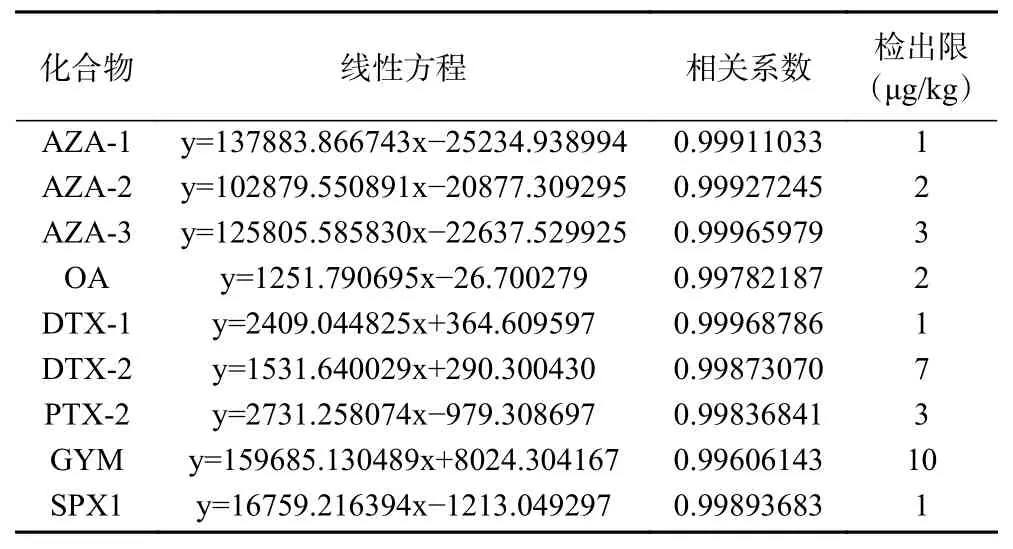
表5 标准物质线性方程、相关系数、检出限Table 5 Linear equation of reference material, decision coefficient, detection limit
由表5可知,9 种腹泻性贝类毒素标准方程的线性相关系数均在0.996~0.999 之间,线性良好,可以满足实验要求。欧盟对于亲脂性海洋生物毒素AZA-1、 AZA-2、 AZA-3、 OA、 DTX-1、 DTX-2、PTX-2 的限制浓度为160 μg OA 当量/kg,GYM 的限制浓度为200 μg OA 当量/kg,SPX1 的限制浓度为100 μg OA 当量/kg[33,35-37],本方法的检出限比欧盟管制毒素规定浓度的0.05 倍还低,仍可获得大于3 的信噪比,说明检测灵敏度良好。
2.4.2 方法的平均回收率和精密度 分别在空白样品中加入不同浓度的9 种腹泻性贝类毒素混合标准使用液,按照优化方法条件进行处理和检测,每个目标物添加三个浓度梯度,重复测定6次,计算低、中、高三个浓度梯度的回收率和相对标准偏差,以考察方法的准确度和精密度(RSD)。
由表6 数据可知,9 种化合物三个浓度梯度的回收率在 87.2%~111.2%之间,相对标准偏差均小于10%,由此可以说明该方法的准确度和精密度均符合实际分析检测的要求。

表6 回收率和精密度Table 6 Recovery rate and precision
2.5 实际贝类样品测定
用本实验建立的方法检测海南省五个城市市售的菲律宾蛤仔、魁蚶、华贵栉孔扇贝等约十个品种的贝类,对检出率和超标率进行分析(表7)。我国大部分沿海海域,如广东沿海、江浙海域均有DSP 的污染存在,个别海域超标率竟达77%[38-43]。此次实验发现,海南省近岸海域贝类腹泻性贝类毒素的污染概率较大,但是超标率不高。

表7 不同海域中DSP 的检出率和超标率Table 7 Detection rate and over - standard rate of DSP in different sea areas
3 结论
贝类毒素种类繁多、结构复杂、样本基质较为复杂,为尽量避免或减少假阳性结果出现,研究开发高分辨率质谱测定技术,能够快速、准确进行大批量样品检测,多种毒素同时定性定量的检测技术是非常必要的。本方法可同时检测9 种DSP,OA、DTX1、DTX2、PTX2、GYM、SPX1、AZA1、AZA2、AZA3在质量浓度0.5~50 ng/mL 的范围内,其线性相关系数均在0.996 以上,检出限为1~10 μg/kg,远远低于欧盟立法机构所确定的限量要求,回收率为87.2%~111.2%,相对标准偏差为2.8%~9.2%。本方法的线性相关系数、检出限、回收率、精密度均能满足腹泻性贝类毒素的日常检测需要,并且一个样品从前处理到上机检测,最多只需要2 h 就可以完成。结果表明,在众多方法中HPLC-MS/MS 可满足多种毒素同时检测需求,操作简便快捷、特异性高、灵敏度较高、重复性好、准确性高,实验过程中损失较小,稳定性重现性均良好,而且节约成本,适合大批量检验。
