刺梨中质量标记物的提取工艺优化及其含量同时测定
2022-08-03李良群严艳芳陈发菊谭云飞杨礼寿罗忠圣李齐激杨小生
汪 涛,李良群,严艳芳,田 强,陈发菊,谭云飞,杨 娟,彭 梅,杨礼寿,罗忠圣,李齐激,杨小生,3,
(1.贵州中医药大学研究生院,贵州贵阳 550025;2.贵州省中国科学院天然产物化学重点实验室,贵州贵阳 550014;3.贵州医科大学天然产物化学重点实验室,贵州贵阳 550014)
刺梨(Rosa roxburghii)是一种蔷薇科蔷薇属多年生灌木,是我国西南地区特有的一种野生药用植物,集中分布于贵州、云南、四川等地区[1]。刺梨的利用迄今已有400 多年的历史,具有很高的营养和药用价值。刺梨的根、茎、叶、果实均可入药,有健胃、消食、滋补的作用[2-3]。研究表明,刺梨富含维生素C、五环三萜、黄酮类、多糖类、有机酸类、其他类化合物如超氧化物歧化酶(SOD)等化学成分[4-8],具有抗凋亡作用、降血糖、抗氧化、减轻炎症作用、增强免疫功能、调节小鼠结肠菌群等多种生物活性[9-13];因此刺梨被广泛应用于食品、医药、保健品等行业。
中药质量标志物(Q-marker)是用于评价中药质量的新概念,2016 年由刘昌孝院士首次提出,为药材、饮片、制剂等方面建立了可参照的质量评价和质量控制模式,对形成质量和风险控制的“药材-饮片-成药”全过程质量追溯系统、建立全新的质量管理体系具有实践应用价值[14-15]。现代药理学研究表明,刺梨三萜类物质在抗抑郁、消炎、对海马神经元的保护及机体免疫调节等方面具有较好的药理活性[16-19],此外,刺梨三萜提取物对酒精性肝损伤的小鼠具有很好的治疗效果[20],并且刺梨总三萜(主要含刺梨苷、野蔷薇苷、蔷薇酸和委陵菜酸)还可以改善机体免疫抑制[21]。基于刺梨三萜成分的活性以及其在刺梨植物体内中的较高含量,因此可以作为刺梨质量标志物。
迄今,有关刺梨三萜的研究主要集中于总三萜含量检测或者2 种三萜的含量测定。南莹等[22]研究了贵州龙里地区的刺梨果实中总三萜的含量;代甜甜等[23]测定了贵州松桃地区野生刺梨中总三萜的含量;刘英枭等[24]研究了刺梨果渣中蔷薇酸的提取工艺;李齐激等[25-26]使用HPLC 测定了刺梨中刺梨苷或蔷薇酸和1-β-羟基蔷薇酸的含量。在提取工艺研究方面,刺梨三萜的提取方法主要有超声提取[27]和乙醇回流提取[28],但是普遍存在提取效率不高,损失较大的问题。特别是近几年来,贵州省将刺梨产业打造成富民和乡村振兴的大产业,大面积种植刺梨和开发高附加值的刺梨产品是贵州促进经济发展的主要方式之一。如能以刺梨中含有的功能性三萜类物质为基础开发高附加值的产品,将会创造更大的经济效益。因此,对刺梨中质量标记物的提取工艺进行优化及其含量同时的测定进行研究,具有较强的新颖性和实际应用价值。本研究以贵州惠水野生刺梨为原材料,以4 个化合物即蔷薇酸、委陵菜酸、刺梨苷、野蔷薇苷为质量标志物建立HPLC 同时测定方法并优化提取工艺,分析刺梨根、茎叶、果四个不同部位中4 种化合物的含量,为其开发利用与质量评价提供重要参考。
1 材料与方法
1.1 材料与仪器
刺梨根、茎、叶、果 采自贵州省黔南布依族苗族自治州惠水县212 国道(经度:106.673411,纬度:26.197517),经贵州中医药大学孙庆文教授鉴定为蔷薇科蔷薇属植物缫丝花的根、茎、叶、果实,标本(凭证202106001)保存于贵州省、中国科学院天然产物化学重点实验室;三萜化合物标准品(蔷薇酸,刺梨苷,野蔷薇苷自制,经HPLC 检测测定纯度≥98%);乙醇(分析级) 国药集团化学试剂有限公司;甲醇、乙腈(HPLC 级) 上海阿拉丁生化科技股份有限公司;三氟乙酸(分析级) 天津市科密欧化学试剂有限公司。
BJ-400T 型粉碎机 陕西现代医药有限公司;SB25-12DTD 型超声波清洗器 宁波新芝生物科技股份有限公司;FA2004N 型电子天平(万分之一)上海菁海仪器有限公司;DKN612C 型电热鼓风干燥箱 上海雅马拓科技贸易有限公司;DK-98-Ⅱ型水浴锅 天津市泰斯特仪器有限公司;Eppendor f 5427R型高速冷冻离心机 北京龙跃生物科技发展有限公司;Agilent-1260 型高效液相色谱仪 上海连桥生物科技有限公司。
1.2 实验方法
1.2.1 质量标志物的提取工艺 参照刘伟等[29]的方法,略改:将刺梨根置于65 ℃的烘箱中烘干,粉碎,过3 号筛。精密称定2.00 g 刺梨根粉末,按照料液比1:25 加入体积分数70%的乙醇,先放入超声仪中25 ℃、250 W 超声30 min,再将料液进行加热回流2 h,连续提取3次,得到刺梨总质量标志物提取液。以同样的方法对刺梨茎、叶、果进行提取。
1.2.2 试样制备
1.2.2.1 标准品溶液配制 精密称定刺梨苷标准品10.00 mg,置于10 mL 容量瓶中,用75%甲醇完全溶解,定容至刻度线,即得刺梨苷标准溶液(刺梨苷浓度为1.022 mg/mL)。按照同样的方法配制浓度为1.020 mg/mL 的野蔷薇苷标准品溶液,浓度为1.192 mg/mL 的蔷薇酸标准品溶液和浓度为1.098 mg/mL的委陵菜酸标准溶液。
1.2.2.2 供试品溶液配制 精密称定刺梨根、茎、叶、果粉末样品2.00 g,置于具塞锥形瓶中,装入250 mL锥形瓶中,按1:25 g/mL 的比例加入50 mL 70%乙醇。先放入超声仪中25 ℃、250 W 超声30 min,再将料液进行加热回流2 h,重复提取3次,合并提取液,低温浓缩后用75%甲醇定容至25 mL 量瓶中,0.45 μm微孔滤膜过滤,然后以刺梨苷、野蔷薇苷、蔷薇酸和委陵菜酸4 个质量标志物的含量为指标,用HPLC进行检测。
1.2.3 提取方法
1.2.3.1 超声提取 精密称定2.00 g 预处理后的刺梨根粉末,装入250 mL 锥形瓶中,按1:20 g/mL 的比例加入40 mL 100%乙醇。 放入超声仪中25 ℃、250 W超声30 min 后将料液过滤,取滤液,过0.45 μm 微孔滤膜装入2 mL 螺纹样品瓶中,待HPLC 检测使用。
1.2.3.2 乙醇回流提取 精密称定2.00 g 预处理后的刺梨根粉末,装入250 mL 锥形瓶中,按1:20 g/mL的比例加入40 mL 100%乙醇,加热回流2 h,过滤,取滤液,过0.45 μm 微孔滤膜装入2 mL 螺纹样品瓶中,待 HPLC 检测使用。
1.2.3.3 超声辅助乙醇回流提取 精密称定2.00 g预处理后的刺梨根粉末,装入250 mL 锥形瓶中,按1:20 g/mL 的比例加入40 mL 100%乙醇。放入超声仪中25 ℃、250 W 超声30 min 后加热回流2 h,取滤液,过0.45 μm 微孔滤膜装入2 mL 螺纹样品瓶中,待 HPLC 检测使用。
1.2.4 单因素实验
1.2.4.1 溶剂用量对各质量标志物含量的影响 精密称定2.00 g 预处理后的刺梨根粉末,装入250 mL锥形瓶中,以不同溶剂用量(1:10、1:15、1:20、1:25、1:30 g/mL)加入100%乙醇。放入超声仪中25 ℃、250 W 超声30 min 后加热回流2 h,以4 个刺梨质量标志物的含量为指标,用HPLC 进行检测。
1.2.4.2 乙醇浓度对各质量标志物含量的影响 精密称定2.00 g 预处理后的刺梨根粉末,装入250 mL锥形瓶中,按1:25 的比例加入50 mL 不同的乙醇体积分数(60%、70%、80%、90%和100%)乙醇。放入超声仪中25 ℃、250 W 超声30 min 后加热回流2 h,然后以4 个刺梨质量标志物的含量为指标,用HPLC 进行检测。
1.2.4.3 回流时间对各质量标志物含量的影响 精密称定2.00 g 预处理后的刺梨根粉末,装入250 mL锥形瓶中,按1:25 的比例加入50 mL 70%乙醇。放入超声仪中25 ℃、250 W 超声30 min 后分别加热回流(0.5、1、1.5、2 和2.5 h),然后以4 个刺梨质量标志物的含量为指标,用HPLC 进行检测。
1.2.4.4 提取次数对各质量标志物含量的影响 精密称定2.00 g 预处理后的刺梨根粉末,装入250 mL锥形瓶中,按1:25 的比例加入50 mL 70%乙醇。放入超声仪中25 ℃、250 W 超声30 min 后加热回流2 h(分别加热1、2、3、4 和5次),然后以4 个刺梨质量标志物的含量为指标,用HPLC 进行检测。
1.2.5 响应面试验 本研究使用Design Export 8.0软件中的Box-Behnken 中心组合设计优化提取条件(表1),在上述单因素实验基础上,考察溶剂用量(A)、乙醇浓度(B)和回流时间(C)3 个因素对刺梨三萜质量标志物含量的影响,从而确定刺梨中三萜质量标志物的最适提取工艺。
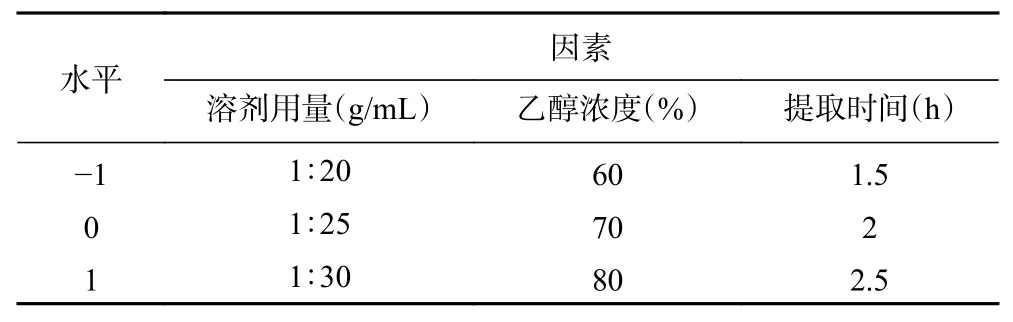
表1 响应面试验因素与水平Table 1 Design and results of response surface method
1.2.6 刺梨根、茎、叶、果中4 个标志物的提取及含量测定
1.2.6.1 样品处理 通过单因素与响应面试验,得到提取刺梨质量标志物的最佳条件,在最佳条件下继续提取刺梨根、刺梨茎、刺梨叶、刺梨果实中的质量标志物。然后采用高效液相色谱法对从刺梨中提取到的质量标志物含量进行分析。各质量标志物的含量等于各质量标志物的量/刺梨原料质量(单位mg/g),以4 种质量标志物的百分含量总和即总三萜化合物百分含量为评价指标。
1.2.6.2 仪器参数 Thermo C18色谱柱(250 mm×4.6 mm,5 μm);检测波长203 nm;柱温20 ℃;流速为1 mL/min;进样体积为10 μL;流动相A 为0.05%三氟乙酸水,B 为乙腈;梯度洗脱条件为0~15 min,25% A~30% A;15~20 min,30% A~35% A;20~60 min,35% A 等度洗脱。
1.3 数据处理
每个实验重复3次,结果表示为Mean±SD,未做特殊说明差异显著性分析限定为P=0.05,利用Excel 2010 对实验数据进行分析,采用Origin 2018 64Bit 软件进行绘图。
2 结果与分析
2.1 系统适用性考察
吸取“1.2.3.1”项下标准品溶液适量,在“1.2.2”项色谱条件下进样,结果见图1。由此表明,理论塔板数以刺梨苷、野蔷薇苷、蔷薇酸、委陵菜酸峰计,分别为30592、40063、30163、34065,分离度均大于1.5,各基线分离良好。
2.2 方法学考察
2.2.1 线性关系考察 吸取“1.2.2.1”项下标准品溶液适量,在“1.2.6.2”项色谱条件下进样。进样体积依次为2、4、6、8、10、20 μL,以质量浓度与进样体积的乘积为横坐标(X),峰面积为纵坐标(Y)进行回归并分析,结果各成分的r都在三个9 以上,表明各成分峰面积和质量浓度与进样体积的乘积呈良好线性关系(见表2)。
2.2.2 日内和日间精密度试验 吸取“1.2.2.1”项下标准品溶液适量,在“1.2.6.2”项色谱条件下连续进样6次,连续3 d,测得刺梨苷、野蔷薇苷、蔷薇酸、委陵菜酸的日内精密度RSD 分别为1.20%、1.80%、1.20%、1.40%;日间精密度分别为1.79%、0.89%、1.26%、1.23%,表明仪器日内和日间精密度良好。
2.2.3 稳定性试验和重复性试验 吸取“1.2.2.1”项下标准品溶液适量,于0、2、4、8、12、24 h 在“1.2.6.2”项色谱条件下进样,测得刺梨苷、野蔷薇苷、蔷薇酸、委陵菜酸的精密度RSD 分别为1.44%、0.96%、0.96%、1.47%,表明溶液在24 h 内稳定性良好。精密称取同一批刺梨根粉末6 份,按“1.2.2.2”项下方法制备供试品溶液,在“1.2.6.2”项色谱条件下进样,测得刺梨苷、野蔷薇苷、蔷薇酸、委陵菜酸的精密度RSD 分别为1.40%、1.48%、1.65%、1.78%,表明该方法重复性良好。
2.2.4 加样回收试验 精密称定刺梨根粉末样品6 份,每份1.00 g,精密称定,每份样品分别加入相对应标准品(刺梨苷4.61 mg、野蔷薇苷5.02 mg、蔷薇酸4.88 mg、委陵菜酸3.24 mg),按“1.2.2.2”项下方法制备供试品溶液,测得4 种成分加样回收率,结果见表3。
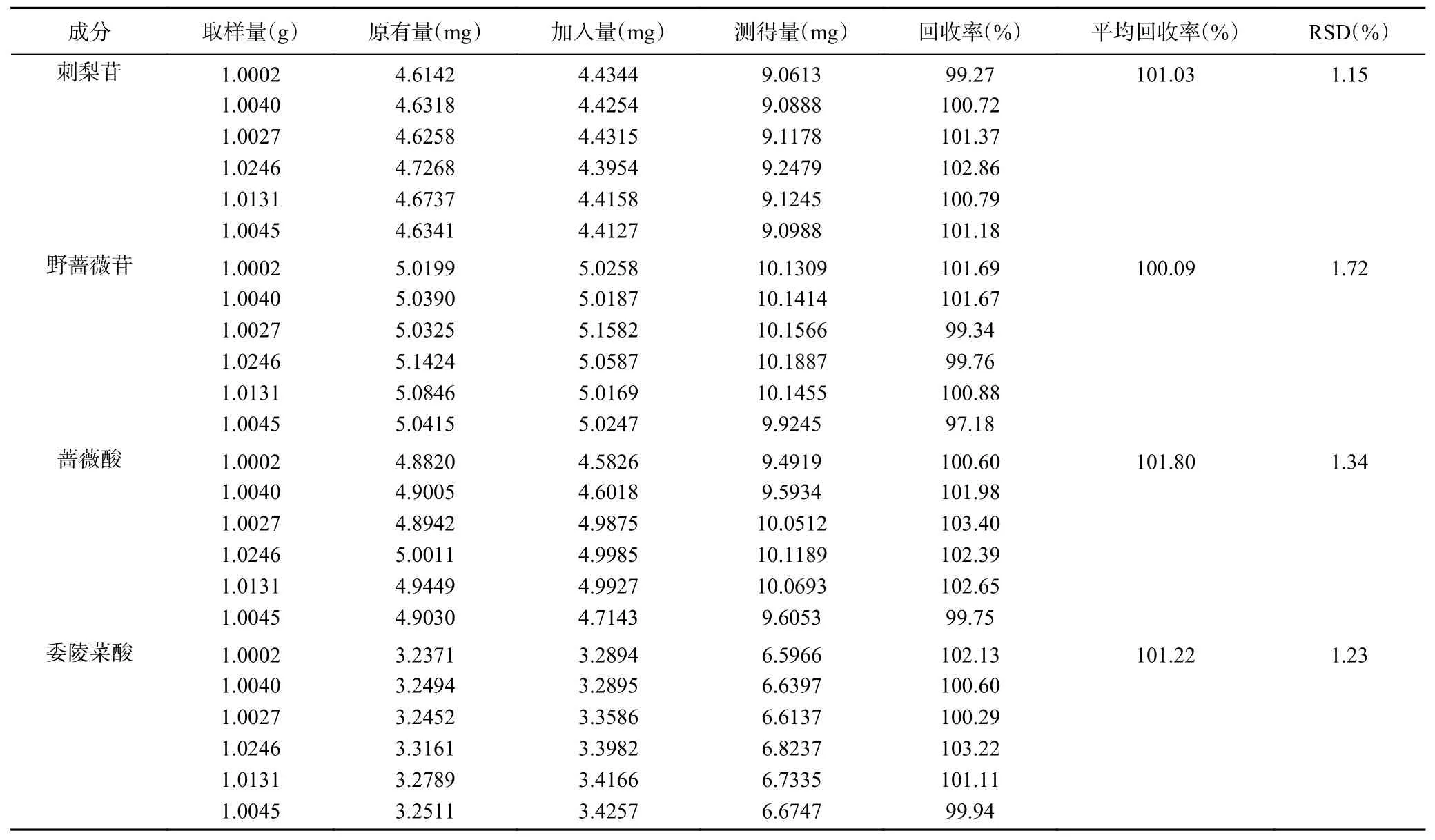
表3 各成分加样回收率试验结果(n=6)Table 3 Results of recovery tests for various constituents (n=6)
2.3 刺梨中各质量标志物提取方法比较结果
首先以刺梨根为提取原料,对比超声提取法、乙醇回流提取法及超声-乙醇回流法三种提取工艺,以刺梨质量标志物化合物类型为横坐标,质量标志物含量为纵坐标,其结果如图2所示。由图2可知,先超声再乙醇回流结合方法优于单独超声提取法与单独乙醇回流提取法;其二是超声加乙醇回流得到的刺梨各质量标志物含量分别为,刺梨苷0.43%,野蔷薇苷0.55%,蔷薇酸0.22%,委陵菜酸0.26%。因此,接下来的试验都以超声-乙醇回流法提取刺梨根、刺梨茎、刺梨叶和刺梨果中质量标志物。
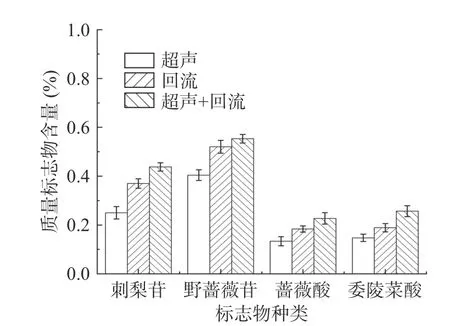
图2 三种提取方法效率对比图Fig.2 Comparison of three extraction methods
2.4 单因素实验结果
溶剂用量、乙醇浓度、提取时间及提取次数等是影响刺梨中4 个质量标志物含量的主要因素[30]。因此,基于超声-乙醇回流法,考察溶剂用量、乙醇浓度、回流时间以及提取次数对刺梨中4 个质量标志物含量的影响。
2.4.1 溶剂用量对刺梨中各质量标志物含量的影响溶剂用量对刺梨根中各质量标志物含量的影响结果见图3。由图3可知:当料液比从1:10~1:25 时,刺梨中三萜化合物的含量呈现增大的趋势,可能由于随着溶剂用量的增大,刺梨三萜在乙醇中的溶解度也增大,在1:25 的时候刺梨三萜的溶解度达到最大,各三萜化合物的含量也达到最大(刺梨苷0.40%、野蔷薇苷0.58%、蔷薇酸0.18%、委陵菜酸0.24%);当料液比从1:25~1:30 时,刺梨苷和野蔷薇苷明显降低,委陵菜酸和蔷薇酸的含量逐渐下降,这可能是由于其他醇溶性成分溶出,使得刺梨三萜的含量下降。选定料液比1:20、1:25、1:30 作为响应面试验水平。
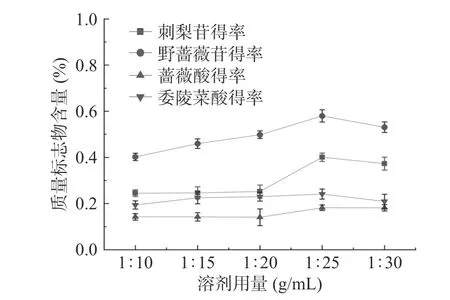
图3 溶剂用量对刺梨根中质量标志物含量的影响Fig.3 Effects of solvent dosage on the contents of Q-marker in R. roxburghii root
2.4.2 乙醇浓度对刺梨中各质量标志物含量的影响乙醇浓度对刺梨根中各质量标志物含量的影响结果见图4。由图4可知:当乙醇体积分数从60%升到70%时,刺梨苷的含量增大,其含量从0.52%增加到0.55%,提高了5.77%;当乙醇体积分数从60%升到70%时,野蔷薇苷的含量缓慢上升,其含量从0.59%增加到0.63%,提高了6.78%;而当乙醇体积分数从80%升到100%时,两者的含量呈现快速下降的趋势;当乙醇浓度从60%升到80%时,蔷薇酸的含量呈现缓慢上升的趋势,从0.11%增加到0.21%,提高了90.90%;委陵菜酸的含量增加到最大(2.37 mg/g),而乙醇浓度在80%以后两者的含量开始下。这可能是由于刺梨苷和野蔷薇苷在乙醇浓度为70%的时候的溶出率较好,因此在此时的含量较高;而蔷薇酸和委陵菜酸则在乙醇浓度为80%的时候溶出率较好。综合四者的总含量考虑,选定乙醇浓度60%、70%、80%作为响应面试验水平。
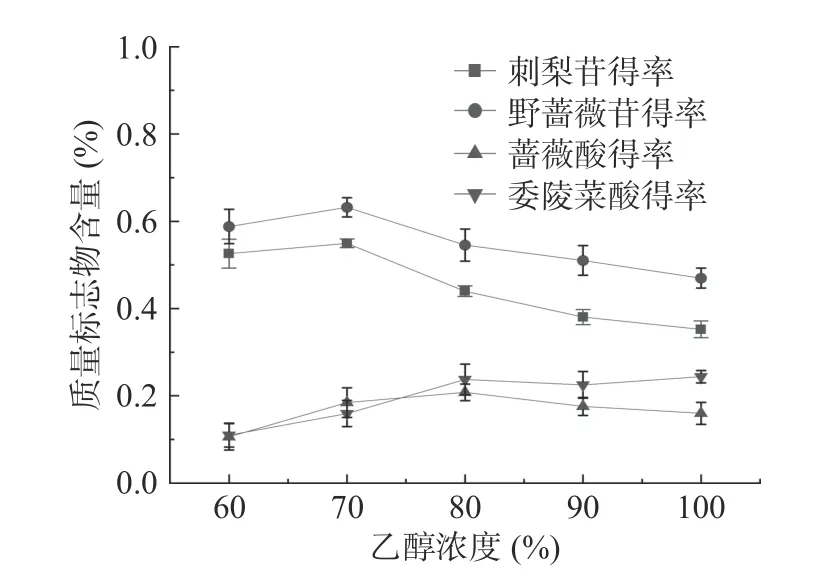
图4 乙醇浓度对刺梨根中质量标志物含量的影响Fig.4 Effects of ethanol concentration on the contents of Q-marker in R. roxburghii root
2.4.3 回流时间对刺梨中各质量标志物含量的影响回流时间对刺梨根中各质量标志物含量的影响结果见图5。提取时间过短会造成原料提取不完全,时间过长且在较高的温度下会导致成分破环。由图5可知:在30 min 时,提取不够完全,刺梨三萜浸出不完全,因此含量较低;随着回流时间的增加,刺梨苷、野蔷薇苷和委陵菜酸的含量均呈上升趋势,在回流时间为2 h 时,两者的含量达到最高(刺梨苷0.87%、野蔷薇苷0.98%、委陵菜酸0.26%),随后刺梨苷的含量呈现下降的趋势,而野蔷薇苷和委陵菜酸的含量基本变化不大;在回流时间从0.5 h 到1.5 h 时,蔷薇酸的含量缓慢上升,达到最大值(0.34%);当继续增加回流时间时,蔷薇酸的含量变化基本不大,这表明提取液已基本饱和,刺梨中蔷薇酸已不易再渗出至溶液中,野蔷薇苷和委陵菜酸亦是如此。本研究结果和高伟城等[31]采用 响应面法优化枇杷叶三萜酸类成分的提取工艺中提取时间研究结果相一致,结合四者的总含量考虑,选定提取时间1.5、2、2.5 h 作为响应面试验水平。
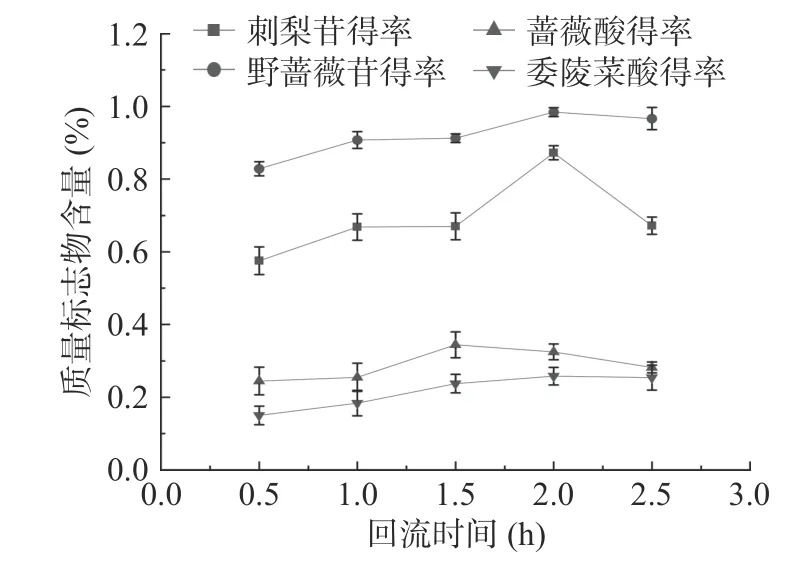
图5 回流时间对刺梨根中质量标志物含量的影响Fig.5 Effect of reflux time on the contents of Q-marker in R.roxburghii root
2.4.4 提取次数对刺梨中各质量标志物含量的影响提取次数对刺梨根中各质量标志物含量的影响结果见图6。由图6可知,当提取次数逐渐增加到3次时,刺梨苷的含量从0.17%到0.22%、野蔷薇苷的含量从0.27%到0.36%,而蔷薇酸和委陵菜酸的含量差别不大;提取3次以上,刺梨中各质量标志物含量几乎无增加,因此在后续实验中将提取3次。而在实际生产中考虑到生产成本的问题,提取次数因根据实际情况而定。考虑到提取次数对提取刺梨质量标志物的影响不大,将不作为响应面优化的影响因素。
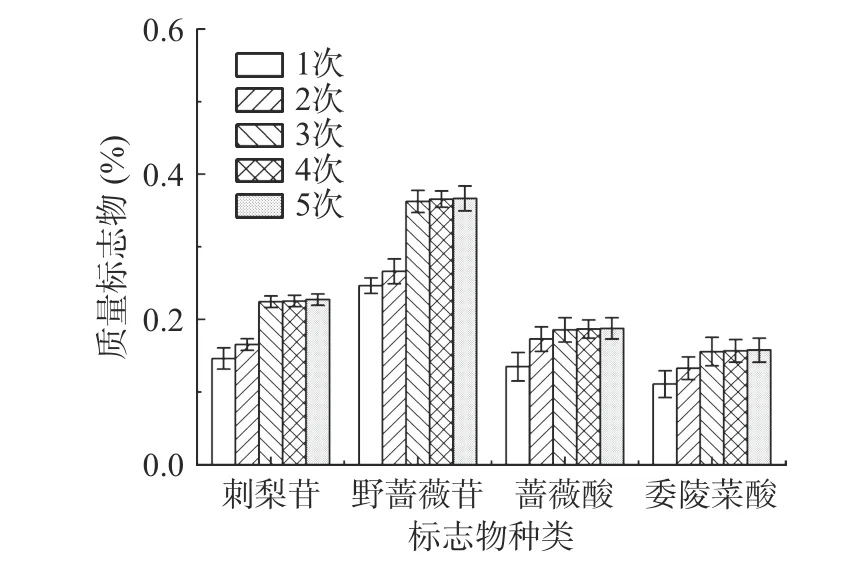
图6 提取次数对刺梨根中质量标志物物含量的影响Fig.6 Effect of extraction times on the contents of Q-marker in R. roxburghii root
2.5 响应面试验结果
2.5.1 试验设计与结果 参考刺梨质量标志物提取单因素实验结果,设计响应面试验考察溶剂用量、乙醇浓度及提取试剂对刺梨中4 个三萜化合物含量的影响,结果见表4。
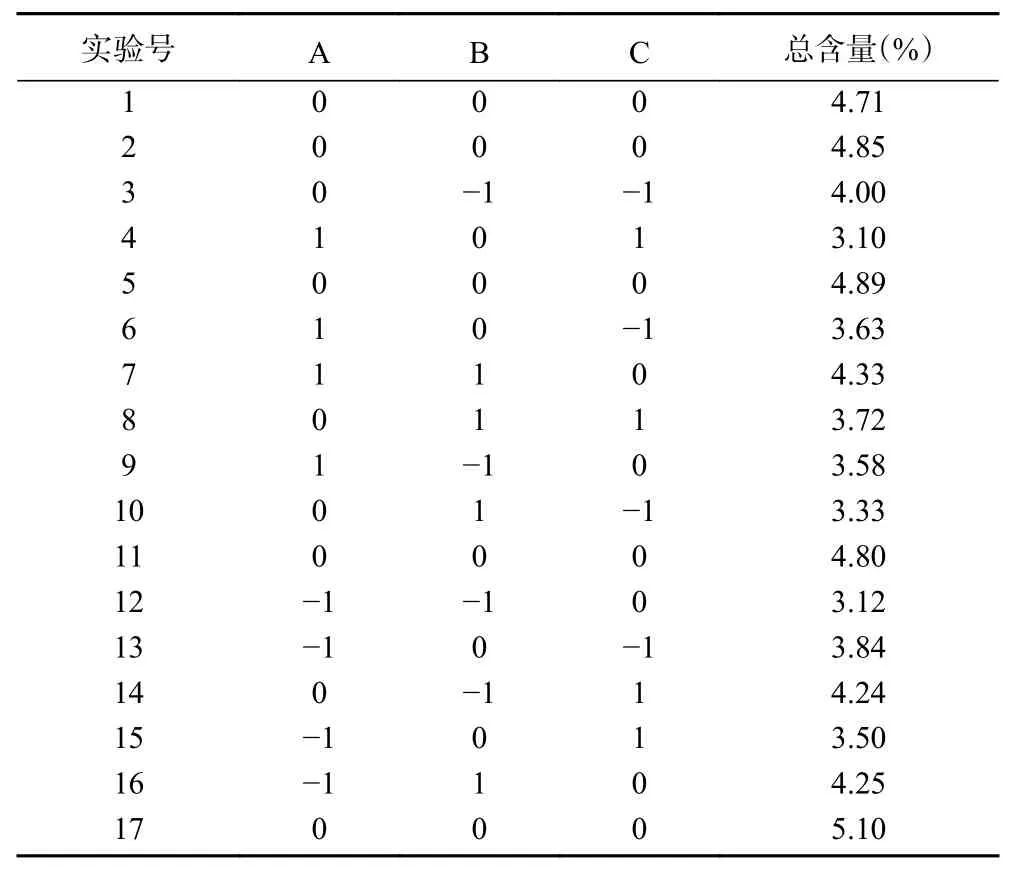
表4 响应面法试验结果Table 4 Design and results of response surface method
通过对表4 试验数据进行二次回归分析,得出多项式回归方程如下:Y=0.096+(1.200E-003)A-(1.325E-003)B+(3.050E-003)C+(4.975E-003)AB-(1.975E-003)AC-(2.250E-004)BC-0.017A2-(5.558E-003)B2-(9.507E-003)C2,式中Y 为三萜化合物得率,A、B、C 分别为溶剂用量、乙醇浓度及提取时间,R2=0.8834。
2.5.2 响应面结果分析 由表5 回归模型方差分析结果可以看出,实验设计模型P<0.05,具有显著差异,三萜化合物与3 个变量之间有显著的线性关系。失拟项P>0.05 不显著,表明所建立的二次回归模型能有效的对响应值进行预测。通过表5 回归模型系数显著性检验结果可知,A2、C2对刺梨4 个三萜化合物含量的影响显著。回归优化响应面图见图7、图8、图9,响应值与各因素的等高线图、三维空间响应面图可直观地展现各因素之间的交互作用对刺梨三萜含量的影响,通过等高线的密集程度判断两因素交互的影响程度[32]。由图7a可知,等高线沿乙醇浓度密集,乙醇浓度对刺梨三萜化合物含量的影响大于溶剂用量。由图7b可知,乙醇浓度固定不变时,增大溶剂用量,刺梨三萜化合物的含量先增大后减小;溶剂用量固定不变时,乙醇浓度增加,刺梨三萜化合物的含量先增大后减小;由图8a可知,等高线沿溶剂用量密集,溶剂用量对刺梨三萜含量的影响大于回流时间。由图8b可知,溶剂用量固定不变时,回流时间增加,刺梨三萜化合物的含量先增大后减小;回流时间固定不变时,溶剂用量增加,刺梨三萜化合物的含量先增大后减小;由图9a可知,等高线沿乙醇浓度密集,乙醇浓度对刺梨三萜含量的影响大于回流时间。由图9b可知,乙醇浓度固定不变时,回流时间增加,刺梨三萜化合物的含量先增大后减小;回流时间固定不变时,乙醇浓度增加,刺梨三萜化合物的含量先增大后减小。综上,3 个因素对刺梨三萜化合物含量影响为乙醇浓度>溶剂用量>提取时间。
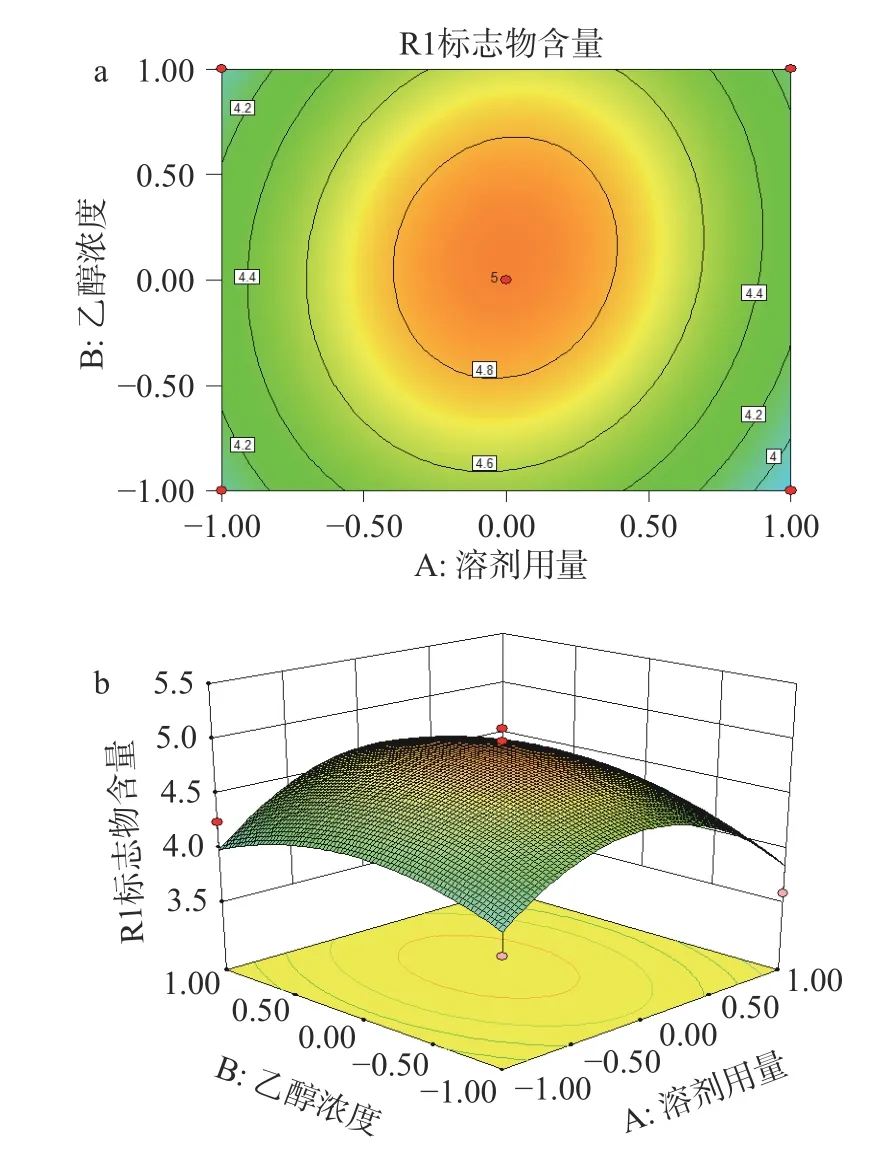
图7 溶剂用量和乙醇浓度交互作用对刺梨根中质量标志物含量的影响Fig.7 Effect of solvent dosage and ethanol concentration on the contents of Q-marker in R. roxburghii root
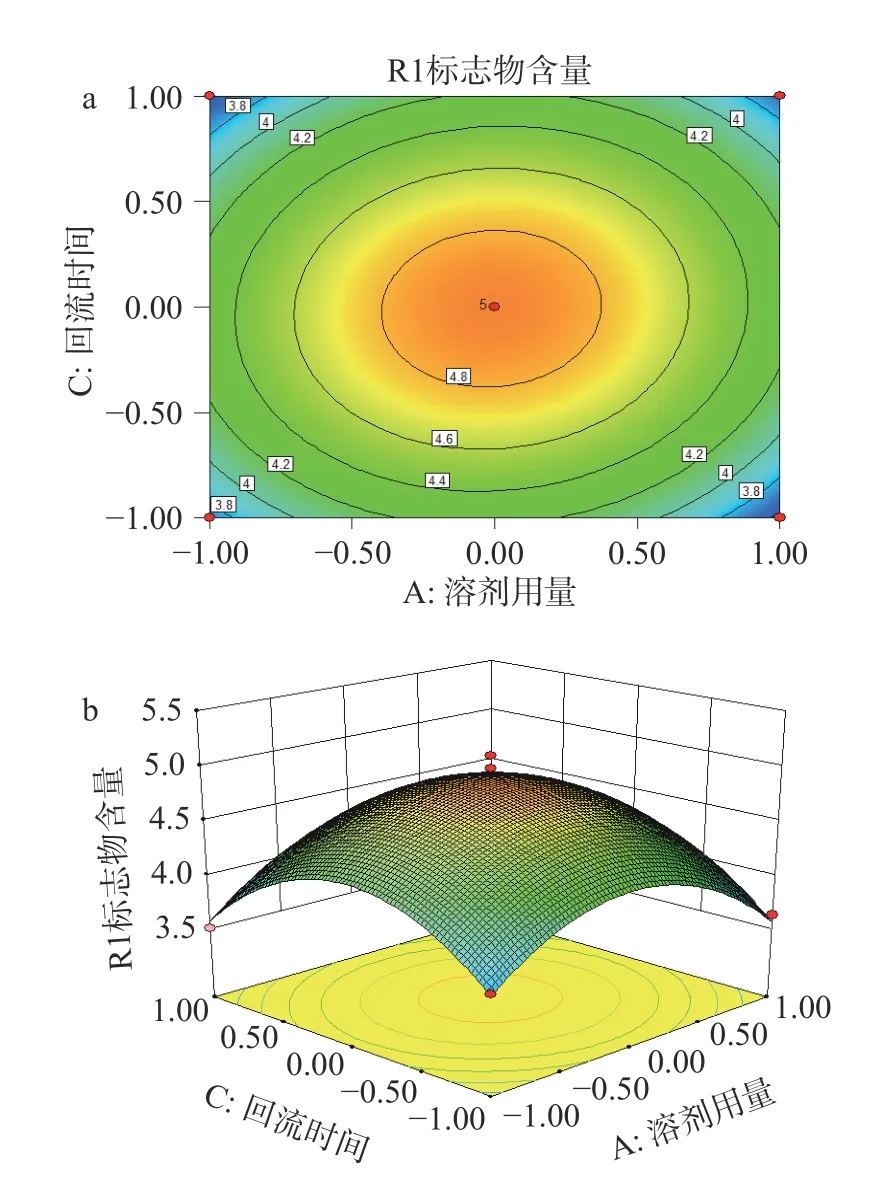
图8 溶剂用量和回流时间交互作用对刺梨根中质量标志物含量的影响Fig.8 Effect of solvent dosage and reflux time on the contents of Q-marker in R. roxburghii root
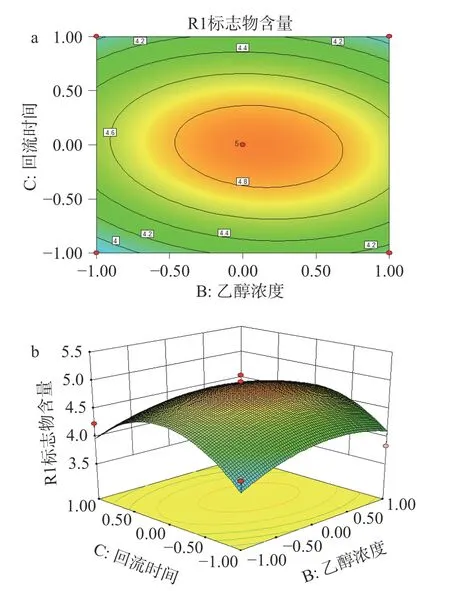
图9 乙醇浓度和回流时间交互作用对刺梨根中质量标志物含量的影响Fig.9 Effect of ethanol concentration and reflux time on the contents of Q-marker in R. roxburghii root
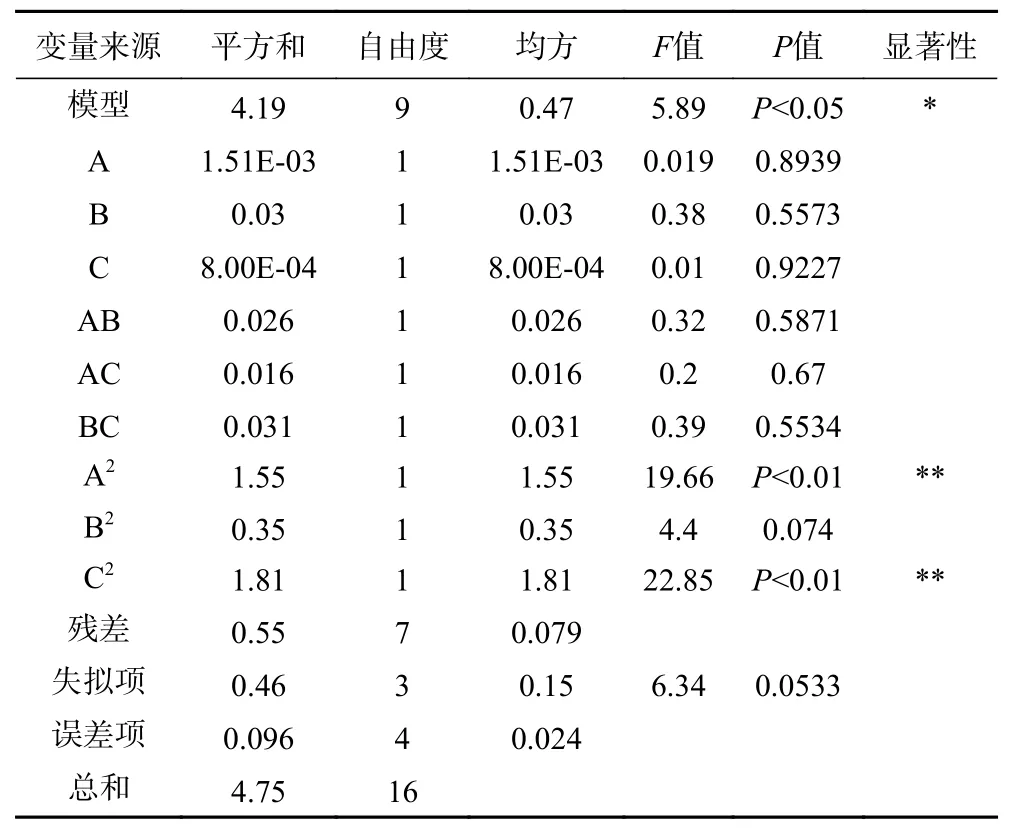
表5 回归模型的方差分析和回归系数的显著性检验Table 5 Analysis of variance for the established regression model and significance test of each regression coefficient
2.5.3 提取工艺优化及验证 通过Design-Expert 8.0软件中Numerical 优化模块得到预测值,给出模型预测最佳提取条件为溶剂用量为1:25(g/mL)、乙醇浓度70.11%、提取时间1.98 h;在此优化条件下刺梨质量标志物的总含量为4.89%。因试验仪器精度限制,采用溶剂用量为1:25(g/mL)、乙醇浓度70%、提取时间2 h 的提取条件进行3次平行实验,测得刺梨质量标志物的平均含量5.12%±0.02%,RSD 为1.923%,说明响应面模型具有可行性。
2.6 刺梨中不同部位4 个质量标志物的含量测定
全面考察4 个标志物在刺梨各部位的分布情况,使用最适的条件和方法,经HPLC 测定刺梨根、茎、叶和果中4 个标志物的含量,结果见表6。由表6可知:刺梨苷在叶子中的含量较高,这可能是由于叶片的光合作用或其转化产物是次生代谢产物的底物,叶片光合作用旺盛,产生的底物多,所以合成的次生代谢产物也多[33],而刺梨苷的合成底物可能在叶片较多,则在叶片的含量较其他部位高;野蔷薇苷在茎中的分布较高;蔷薇酸和委陵菜酸则较多的分布于果实中,这可能是由于在合成、运输的过程中产生了一定的差异。4 个标志物在刺梨不同部位的总含量分别为刺梨叶2.64%、刺梨根2.41%、刺梨茎2.40%、刺梨果2.23%。由此可见,刺梨的不同部位中4 个标志物的总含量(从大到小)顺序为刺梨叶、刺梨根、刺梨茎、刺梨果。
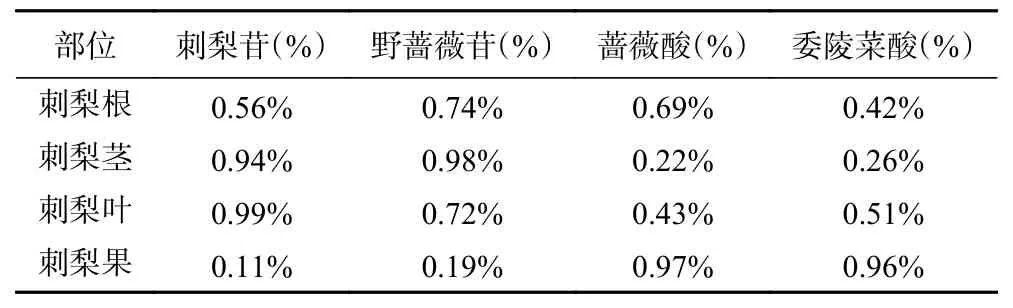
表6 刺梨不同部位的含量Table 6 Contents of different parts of R. roxburghii
3 结论与讨论
迄今,国内外对刺梨成分工艺的研究主要集中在刺梨中多糖和黄酮类物质的提取工艺优化以及刺梨果酒的工艺优化[34-37],也有部分研究是关于刺梨多酚[38]和刺梨膳食纤维的工艺优化[39],而对刺梨中三萜提取条件的优化研究较少。本实验的单因素实验结果表明,采用超声-回流的方法以高收率获得刺梨质量标志物,该方法可以作为刺梨质量标志物的提取工艺方式。据相关文献报道[34],溶剂用量、乙醇浓度与提取时间是影响刺梨质量标志物提取效率最主要的因素。实验过程中,随着溶剂用量的增加,刺梨三萜化合物的含量会增加;但是如果乙醇的添加量太少,会导致其无法浸润整个刺梨根粉末,影响刺梨三萜的提取,也会为后续过滤、检测等工艺增加一定的难度。此外,本研究在对刺梨根质量标志物的提取过程中发现:从回流时间来看,回流2 h 可提高刺梨三萜的含量,但是当超过2 h 后,刺梨三萜的含量呈现下降的趋势,这可能是由于在一定时间后,提取过程中的原料和溶剂达到了饱和状态。根据本研究中的响应面试验结果,可以得出影响提取工艺效率大小,依次为乙醇浓度>溶剂用量>提取时间。提取刺梨中质量标志物的最佳工艺为:按照料液1:25(g/mL)加入70%的乙醇,先放入超声仪25 ℃、250 W 超声30 min,再将料液进行加热回流2 h,连续提取3次。在此条件下,所得到的刺梨叶中质量标志物的总含量为2.64%,分别为刺梨苷含量为0.99%、野蔷薇苷含量为0.72%、蔷薇酸含量为0.43%和委陵菜酸含量为0.51%。考虑到实际生产中需要成本问题,应当适当地降低乙醇浓度和提取次数以提高经济效益。
与此同时,采用HPLC 法同时测定刺梨中4 种质量标志物的研究尚未见报道。本研究探索了HPLC 同时测定刺梨4 种质量标志物的含量分析检测方法,以Thermo C18色谱柱(250 mm×4.6 mm,5 μm);检测波长203 nm;柱温20 ℃;流速为1 mL/min;进样体积为10 μL;流动相A 为0.05%三氟乙酸水,B 为乙腈;梯度洗脱条件为0~15 min,25% A~30%A;15~20 min,30% A~35% A;20~60 min,35% A 等度洗脱作为检测条件,能够较好同时测定4 种质量标志物。以此条件,采用HPLC 测定了刺梨不同部位的质量标志物,发现刺梨三萜总含量在刺梨中的(从大到小)顺序为刺梨叶、刺梨根、刺梨茎、刺梨果。而目前刺梨常用的药用部位为根、茎和果实,叶片利用较少,因此可以将叶片作为开发三萜类化合物的新选择。刺梨中质量标记物的提取工艺及其含量HPLC 同时测定的研究将为刺梨质量评价和开发及生产利用提供科学依据。
