Cu-K-CoOx@Al2O3催化氧化氯化氢制氯气
2022-08-03陈琪炯郑伟中孙伟振
陈琪炯,郑伟中,孙伟振,赵 玲,2
(1.华东理工大学 化学工程联合国家重点实验室,上海 200237;2.新疆大学 化学化工学院,新疆 乌鲁木齐 830046)
氯气是一种重要的基础化工原料,在聚氨酯、化肥、氯碱、氟化工、医化等众多涉氯行业中均有着广泛的应用[1-2]。但在以氯气为原料的许多化工产业中,往往会伴随着大量副产物氯化氢的产生,导致严重的环境污染[3-4]。为此,学者们提出了多种解决方案,包括电解法[5-7]、直接氧化法[8]、催化氧化法等。电解法存在能耗大、产物气体杂质多、电解液制备难度大等问题[9-10];直接氧化法效率低且反应条件苛刻;催化氧化法具有操作简单、能耗低等优点,逐渐成为实现氯资源循环利用的新途径[11-16]。
Amrute等[17]通过研究铜催化剂上产物出现的时间,发现在CuO表面进行的氯化氢催化氧化反应遵循M-K机制。氯化氢先以较低的活化能吸附在CuO表面,形成中间体(如Cu(OH)Cl,Cu2OCl2等);然后O2通过在CuO表面吸附解离,将中间体氧化为CuO,Cl2作为产物脱附离开CuO表面。但O2的解离活化能与Cl2的脱附活化能较高,导致催化反应效率下降。
研究人员希望通过引入不同的助催化剂形成不对称的反应单元结构来提高反应的催化效率[17-19]。向催化剂中加入V,Be,Mg,Bi,Sb等金属作为助催化剂可以提高催化剂的活性[20]。Mondelli等[21-22]以铜铁矿为基础,研究了一系列负载不同助金属催化剂的Cu系催化剂,发现催化剂的寿命和活性均提高。Over等[23]以氧的离解能作为描述符,提出了氯化氢催化氧化反应的火山曲线,指出Cu和Co的协同效应能进一步提高铜系催化剂的催化活性;Honkala等[24]发现,来自火山型曲线两边元素的混合物可以进一步提高催化剂的性能。但针对氯化氢催化氧化反应,通过双金属助催化剂掺杂改善Cu系催化剂的报道较少,对双金属助催化剂的协同作用认识不深入。
本工作在γ-Al2O3载体负载传统氧化铜的基础上,通过添加K与Co金属氧化物作为双金属助催化剂,进一步提高催化剂的稳定性、催化效率与使用寿命,考察了K和Co双金属助剂的协同作用。
1 实验部分
1.1 试剂
γ-Al2O3:AR,上海凌峰化学试剂有限公司;Cu(NO3)2·6H2O:AR,萨恩化学技术(上海)有限公司;KNO3:AR,国药集团有限公司;Co(NO3)2·6H2O:AR,永华化学科技(江苏)有限公司。
1.2 催化剂的制备
采用过量浸渍法制备Cu-K-CoOx@Al2O3复合氧化物催化剂。称取一定质量的Cu(NO3)2·6H2O,KNO3,Co(NO3)2·6H2O,用少量去离子水加热溶解,将γ-Al2O3载体浸渍在溶液中,搅拌均匀,静置14 h取出,于120 ℃下烘干5 h,并于管式炉中500 ℃焙烧3 h,所得试样即为目标催化剂。其中,Cu含量为10%(w),K含量为5%(w),Cu/Co摩尔比为10∶5,10∶3,10∶2,10∶1的试样分别记为 Cu10K5Co5@Al2O3,Cu10K5Co3@Al2O3,Cu10K5Co2@Al2O3,Cu10K5Co@Al2O3,制备的催化剂平均粒径在1 mm左右。
1.3 催化剂的表征
催化剂形貌采用美国赛默飞公司Talos F200X型高分辨透射电子显微镜分析。XRD分析采用德国布鲁克斯公司D8 Advance型X射线衍射仪,最大输出功率为18 kW,扫描范围2θ=5°~90°,扫描步长和速率为0.02°和2(°)/min。N2吸附-脱附表征采用美国麦克集团公司ASAP2020型比表面和孔结构分析仪,试样在200 ℃下真空预处理3 h。TG分析采用美国PerkinElmer公司TGA-4000型热重分析仪,将未煅烧的催化剂研磨成粉末状,取一定量粉末置于坩埚中,在120 ℃下恒温30 min,除去多余水分;待质量稳定后,以10 ℃/min的升温速率从120 ℃升温至500 ℃。
1.4 催化剂的活性评价
催化剂评价流程如图1所示,采用内径为24 mm的固定床反应器,三段控温方案。催化剂用量为10 g,上下分别装填空白载体。转化率测定采用碘量滴定法,反应获得的产物以KI溶液吸收,再以Na2S2O3溶液与NaOH溶液分别滴定测得Cl2与氯化氢的含量,计算得氯化氢的转化率。

图1 氯化氢催化氧化制氯气工艺流程Fig.1 Process flow for catalytic oxidation of hydrogen chloride to chlorine.
2 结果与讨论
2.1 催化剂的表征结果
图2为催化剂的XRD谱图。从图2可看出,催化剂在2θ=35.2°,38.4°处均具有明显的CuO特征衍射峰;而在2θ=45.2°,67.3°处观察到归属于Al2O3的特征衍射峰。通过Scherrer公式计算得到催化剂的平均晶粒尺寸分别为11.37,11.63,11.57,10.85 nm。未出现明显的K2O或CoO的特征峰。由此可以推测,该催化剂上K2O或CoO颗粒粒径小于5.0 nm,并高度分散于催化剂中或以无定形态存在[25-26]。

图2 催化剂的XRD谱图Fig.2 XRD patterns of catalysts.
Cu10K5Co5@Al2O3催化剂的活性组分颗粒大小及分布规律见图3。从图3a可看出,催化剂载体呈片状分布,且活性组分在载体表面均匀分布。从图3b可看出,Cu,K,Co元素均匀分布在催化剂表面,进一步验证了XRD表征结果。

图3 Cu10K5Co5@Al2O3催化剂的TEM(a)及高角环形暗场SEM(b)照片Fig.3 TEM(a) and high-angle annular dark field(HAADF) SEM(b) images of Cu10K5Co5@Al2O3 catalyst.
图4为催化剂的N2吸附-脱附等温线。从图4可看出,催化剂的N2吸附-脱附等温线均属于Ⅳ型,在相对分压较高(0.6~1.0)处出现H1型回滞环,表明所有催化剂试样均具有介孔结构。

图4 催化剂的N2吸附-脱附等温线Fig.4 N2 adsorption-desorption isotherm of catalysts.
图5为催化剂的TG曲线。从图5可看出,温度从120 ℃升高到350 ℃,催化剂不断失重,这可能是催化剂制备过程中的水分未完全去除,或者是催化剂在焙烧过程中有部分硝酸盐前体未完全分解。而当温度超过350 ℃时催化剂质量基本保持不变,确保了催化剂在工业使用温度范围(350~430℃)内不会因为温度过高而导致活性组分流失,进而影响催化效率。

图5 催化剂的TG曲线Fig.5 TG curves of catalysts.
表1为催化剂的结构参数。

表1 催化剂的结构参数Table 1 Structural properties of catalysts
从表1可看出,与空白γ-Al2O3相比,负载了活性组分的催化剂的比表面积与孔体积都有一定程度的减小。除此之外,随Co活性组分含量的增加,催化剂的比表面积略有降低。催化剂具有较大的比表面积和孔径,有利于活性组分在载体上的分散及反应物分子在催化剂中的扩散,也使催化剂具有较多的催化位点和较好的催化活性。
2.2 催化剂评价结果
图6为反应温度对氯化氢转化率的影响。由图6可知,随反应温度的上升,催化剂的活性先增加后下降,当反应温度为410 ℃时,催化剂的活性最高。随Co/Cu摩尔比的增加,催化剂的催化活性也基本呈上升趋势,因此,最佳反应温度为410 ℃,在此温度下,Co/Cu摩尔比的增加有利于提高催化剂的活性。

图6 温度对氯化氢转化率的影响Fig.6 Effect of temperature on HCl conversion.
图7为反应时间对氯化氢转化率的影响。由图7可看出,随反应时间的延长,氯化氢转化率呈现先急速下降后趋于平缓的趋势,这可能是因为反应初期催化剂中大量氧化态活性组分的存在使氯化氢的消耗量增加。反应3 h后,氯化氢转化率趋于平缓,且在10 h内,催化剂的催化性能基本保持不变。因此,选取最佳反应时间为3 h。其中,Cu10K5Co5@Al2O3催化剂的活性较好,氯化氢转化率约为75.2%

图7 反应时间对氯化氢转化率的影响Fig.7 Effect of reaction time on HCl conversion.
以Cu10K5Co5@Al2O3为催化剂考察了重时空速(WHSV)对氯化氢转化率的影响,结果见图8。由图8可知,在WHSV从240 h-1上升到360 h-1时,氯化氢转化率变化较小;而当WHSV大于360 h-1时,氯化氢转化率随WHSV的升高而显著减小。考虑到催化剂的利用效率,选用WHSV为360 h-1。

图8 WHSV对氯化氢转化率的影响Fig.8 Effect of WHSV on HCl conversion.
以Cu10K5Co5@Al2O3为催化剂,考察了O2/HCl摩尔比对氯化氢转化率的影响,结果见图9。由图9可知,当O2/HCl摩尔比为1∶1时,氯化氢转化率较高;当O2/HCl摩尔比小于1∶2时,氯化氢转化率明显较低,而当O2/HCl摩尔比大于等于2∶1时,氯化氢转化率较O2/HCl摩尔比为1∶1时变化较小。考虑到后续产物气体中O2分离工艺的简化,选取反应的最佳O2/HCl摩尔比为1∶1。

图9 O2/HCl摩尔比对氯化氢转化率的影响Fig.9 Effect of O2/HCl molar ratio on HCl conversion.
将制备的Cu10K5Co5@Al2O3催化剂与其他文献中铜基催化剂的催化效果进行比较,结果见表2。从表2可看出,所制备的Cu10K5Co5@Al2O3催化剂与以La,Ce,Cr为助催化剂的铜基催化剂相比,具有更优异的催化性能。
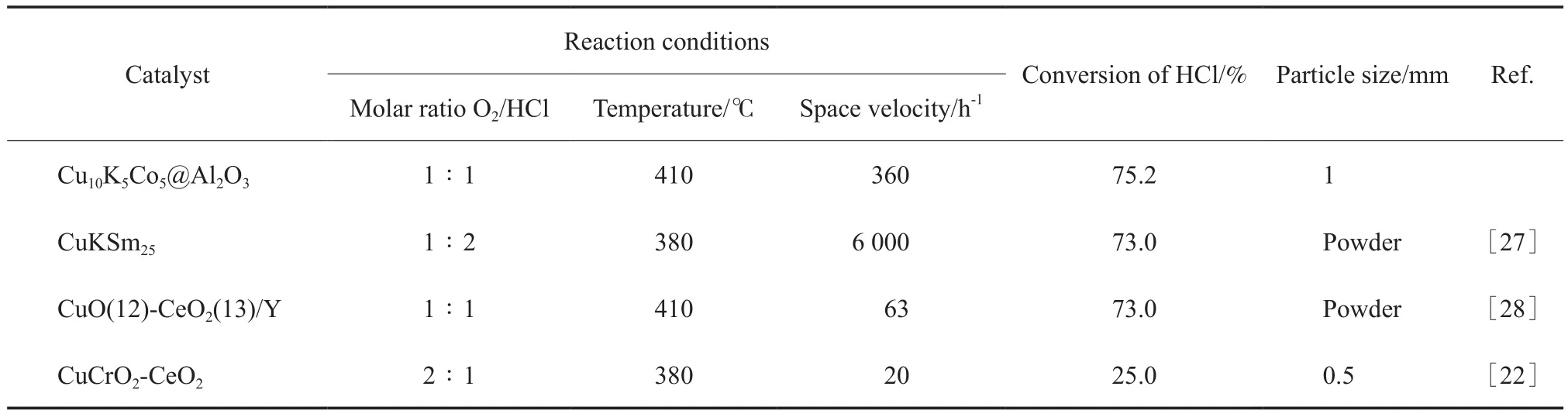
表2 不同铜基催化剂对氯化氢氧化的催化性能Table2 The catalytic performance of different CuO-based catalysts for HCl oxidation
考察了Cu10K5Co5@Al2O3催化剂的使用寿命,结果见图10。从图10可知,催化剂使用的120 h,氯化氢的转化率基本保持稳定。由此可见,相较于传统的铜基催化剂,所制备的Cu10K5Co5@Al2O3催化剂在稳定性和催化活性方面都有一定程度的提高,且所制备的催化剂又具备较大的粒径,适用于大型的催化反应装置,具有更好的工业应用前景。

图10 Cu10K5Co5@Al2O3催化剂的使用寿命Fig.10 Life evaluation of Cu10K5Co5@Al2O3 catalyst.
3 结论
1)采用过量浸渍法制备了一系列Cu-KCoOx@Al2O3催化剂,表征结果显示,活性组分均匀分布在载体表面,催化剂为典型的介孔结构,在工业使用温度范围内(350~430 ℃)稳定性良好。
2)常压下,催化剂催化氧化氯化氢反应的最优工艺条件为:410 ℃,WHSV =360 h-1,O2/HCl摩尔比为1∶1,反应时间为3 h。在此条件下,氯化氢转化率为75.2%。
3)与传统的铜基催化剂相比,所制备的Cu10K5Co5@Al2O3催化剂具有较高的转化率,具备较大的粒径。
