基于PI3K靶点的芹菜素衍生物设计、合成及分子对接研究
2022-08-03何贝桥高雅婷梁丽娜张园园
何贝桥,高雅婷,梁 淼,梁丽娜,张园园*,王 波
(1.北京中医药大学中药学院,北京 102400;2.宁夏回族自治区人民医院药学部,宁夏 银川 750000)
磷脂酰肌醇-3-激酶(phosphoinositide 3-kinase,PI3K)是与细胞增殖、分化和凋亡等过程密切相关的重要靶点[1]。其中,Ⅰ型PI3K(PI3Kα、PI3Kβ、PI3Kδ、PI3Kγ)常被发现于多种实体瘤、淋巴肿瘤、炎症及免疫疾病中[2-6]。目前,以PI3K为靶点的小分子抗肿瘤药物主要包括广谱型PI3K抑制剂(pan-PI3K inhibitors)、亚型特异性PI3K抑制剂(isoform-specific PI3K inhibitors)和PI3K/mTOR双重抑制剂(dual PI3K and mTOR inhibitors)。作为第一个人工合成的广谱型PI3K抑制剂LY294002,虽然不能应用于临床,但其骨架和活性基团仍有被挖掘为新型高效低毒抑制剂的潜力[7-8]。
芹菜素(apigenin)是一种在自然界中含量非常丰富的黄酮类成分,在水果、蔬菜、药用植物及红酒中均有发现[9-11]。天然来源的芹菜素毒性低,具有抗肿瘤、抗菌和抗阿尔茨海默症等药理活性,其中抗肿瘤潜能尤为明显[12]。同时,芹菜素拥有与LY294002类似的结构,且可经PI3K/Akt通路抑制A549、HeLa细胞的增殖[13-14]。为解决芹菜素自身药用的缺点和天然来源不足的问题,增强与PI3Kα、PI3Kβ、PI3Kδ和PI3Kγ蛋白的亲和力,作者设计合成芹菜素单糖苷,为其进一步开发为新型高效低毒的PI3K抑制剂提供理论依据。
1 实验
1.1 试剂与仪器
芹菜素(>97%)、超干N,N-二甲基甲酰胺(99.9%)、甲醇钠(99%)、33%氢溴酸(33% in acetic acid)、碳酸银(99%)、D-葡萄糖(>98%)、D-半乳糖(>98%)、D-阿拉伯糖(>98%),北京伊诺凯科技有限公司;浓硫酸、乙酸酐(>96%),Acros公司。
78-1型磁力搅拌器,常州荣华仪器制造有限公司;N-1300型旋转蒸发仪,上海爱朗仪器有限公司;ASCEND-400型核磁共振仪,瑞士Bruker公司;柱层析硅胶(200~300目),青岛海洋化工厂。
1.2 目标化合物的合成路线
芹菜素的骨架与LY294002的核心骨架相似,且7位羟基活泼性最强。因此,在 7位引入不同的单糖基片段可明显提高化合物的极性,改善溶解度;同时,由于糖基在药物的转运和靶向性中发挥着重要作用,设计的化合物与PI3K蛋白的亲和力增强。目标化合物7-O-β-D-芹菜素葡萄糖苷的合成路线见图1。
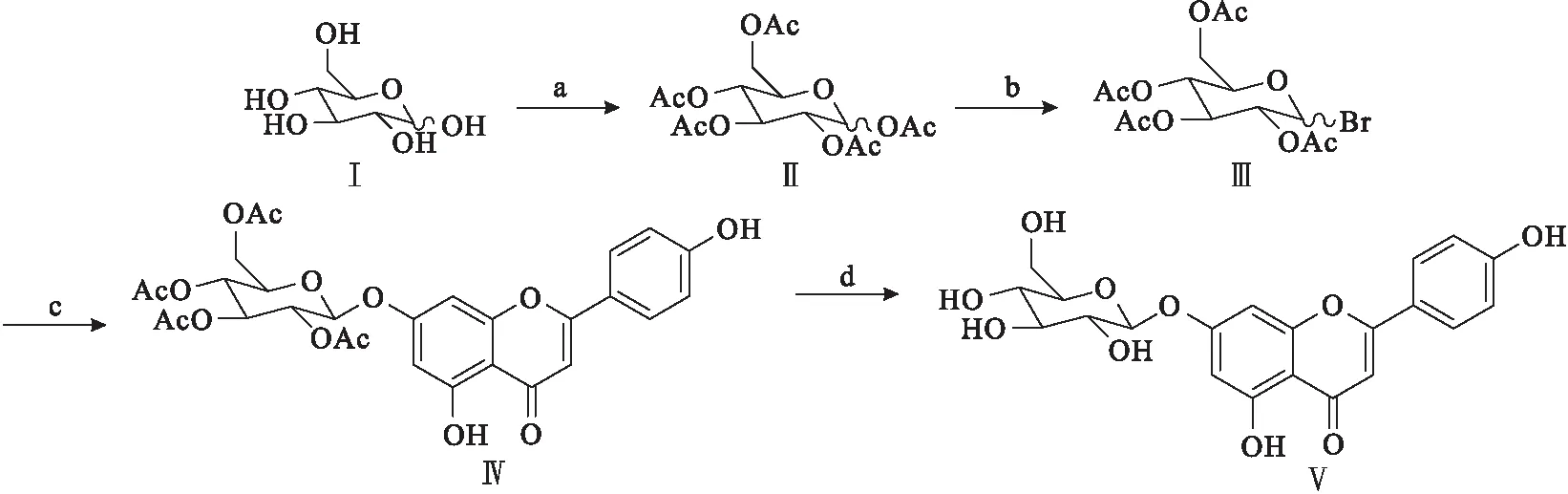
a:浓H2SO4,(CH3CO)2O,4 h b:33%HBr/AcOH,4 h c:芹菜素,Ag2CO3,DMF,24 h d:CH3ONa,CH3OH,4 h
1.3 合成方法
1.3.1 单糖的全乙酰化
1.3.1.1 1,2,3,4,6-五-O-乙酰基-α-D-吡喃葡萄糖(Ⅱ)的合成
量取16.0 mL乙酸酐于150 mL圆底烧瓶中,在冰浴条件下加入30.0 μL浓硫酸,低温下分批加入4.00 g D-葡萄糖(Ⅰ,0.02 mol);50 min后,在常温下继续反应190 min至反应完全;反应液用约60 mL二氯甲烷萃取3次,收集合并有机相,并依次用稀NaOH溶液、水、饱和NaCl溶液洗涤至中性,无水硫酸钠干燥,过滤,浓缩,得到7.07 g无色糖浆状液体化合物Ⅱ,产率为90.5%。
1.3.1.2 1,2,3,4,6-五-O-乙酰基-α-D-吡喃半乳糖的合成
将D-葡萄糖替换为D-半乳糖,合成方法同1.3.1.1,得到6.72 g无色糖浆状液体1,2,3,4,6-五-O-乙酰基-α-D-吡喃半乳糖,产率为86.0%。
1.3.1.3 1,2,3,4-四-O-乙酰基-α-D-呋喃阿拉伯糖的合成
将D-葡萄糖替换为D-阿拉伯糖,合成方法同1.3.1.1,得到8.61 g无色糖浆状液体1,2,3,4-四-O-乙酰基-α-D-吡喃阿拉伯糖,产率为90.2%。
1.3.2 溴代
1.3.2.1 2,3,4,6-四-O-乙酰基-α-D-溴代吡喃葡萄糖(Ⅲ)的合成
将化合物Ⅱ(7.07 g,0.02 mol)溶于10 mL二氯甲烷中,加入33%HBr/AcOH溶液4 mL,室温反应4 h,TLC监测反应进程。反应完全后,将反应液分散于8 mL冰水中,并用10 mL二氯甲烷萃取3次,收集合并有机相,依次用稀NaOH溶液、冰水洗涤至中性;无水硫酸钠干燥,过滤,浓缩,经石油醚-乙酸乙酯(4∶1,体积比,下同)柱层析,得到7.76 g无色糖浆状液体化合物Ⅲ,产率为94.4%。
1.3.2.2 2,3,4,6-四-O-乙酰基-α-D-溴代吡喃半乳糖的合成
将化合物Ⅱ替换为1,2,3,4,6-五-O-乙酰基-α-D-吡喃半乳糖,合成方法同1.3.2.1,得到5.52 g无色糖浆状液体2,3,4,6-四-O-乙酰基-α-D-溴代吡喃半乳糖,产率为79.0%。
1.3.2.3 2,3,4-三-O-乙酰基-α-D-溴代吡喃阿拉伯糖的合成
将化合物Ⅱ替换为1,2,3,4-四-O-乙酰基-α-D-吡喃阿拉伯糖,合成方法同1.3.2.1,得到8.07 g无色糖浆状液体2,3,4-三-O-乙酰基-α-D-溴代吡喃阿拉伯糖,产率为88.0%。
1.3.3 芹菜素7位单糖苷衍生物的合成
1.3.3.1 7-O-β-D-芹菜素葡萄糖苷(Ⅴ)的合成
将芹菜素(0.11 g,0.40 mmol)溶于8 mL DMF中,加入化合物Ⅲ6 mL、碳酸银(0.33 g,1.20 mmol)避光反应24 h;每隔12 h加入6 mL化合物Ⅲ;24 h后,过滤碳酸银,水洗DMF,经石油醚-乙酸乙酯(9∶5)柱层析,得到0.15 g黄色固体化合物Ⅳ7-O-β-D-芹菜素乙酰葡萄糖苷,产率为62.5%。
将化合物Ⅳ(0.15 g,0.25 mmol)溶于15 mL甲醇中,加入适量甲醇钠至pH值为 9~10,室温反应4 h;然后加入适量阳离子树脂使反应体系呈中性,过滤,经乙酸乙酯-甲醇(5∶1)柱层析,得到0.10 g淡黄色固体化合物Ⅴ,产率为90.9%。
1.3.3.2 7-O-β-D-芹菜素半乳糖苷的合成
将化合物Ⅲ替换为2,3,4,6-四-O-乙酰基-α-D-溴代吡喃半乳糖,合成方法同1.3.3.1,得到0.08 g淡黄色固体7-O-β-D-芹菜素半乳糖苷,产率为84.2%。
1.3.3.3 7-O-β-D-芹菜素阿拉伯糖苷的合成
将化合物Ⅲ替换为2,3,4-三-O-乙酰基-α-D-溴代吡喃阿拉伯糖,合成方法同1.3.3.1,得到0.11 g淡黄色固体7-O-β-D-芹菜素阿拉伯糖苷,产率为91.7%。
1.4 分子对接
选择PI3Kα蛋白(PDB:4jps)、PI3Kβ蛋白(PDB:4bfr)、PI3Kγ蛋白(PDB:5g2n)和PI3Kδ蛋白(PDB:5ngb)作为研究对象,依次提取蛋白中的原始配体,利用原始配体确定分子对接的活性位点并验证对接的准确性。利用AutoDock Vina软件分别将预处理好的蛋白与配体进行分子对接。
2 结果与讨论
2.1 目标化合物的表征
7-O-β-D-芹菜素葡萄糖苷:1HNMR(400 MHz,DMSO-d6),δ:12.96(s,1H,OH-5),10.32(s,1H,OH-4′),7.95(d,J=8.6 Hz,2H,H-2′,H-6′),6.96(d,J=8.7 Hz,2H,H-3′,H-5′),6.85(s,1H,H-3),6.84~6.82(m,1H,H-8),6.44(d,J=1.9 Hz,1H,H-6),5.07(d,J=7.4 Hz,1H,H-1″),4.22(t,J=6.6 Hz,1H,OH-2″),3.51~3.43(m,4H,H-2″,OH-3″,4″,6″),3.36~3.24(m,5H,H-3″,4″,5″,6″);13CNMR(101 MHz,DMSO-d6),δ:182.08(C=O),167.06(C-7),164.41(C-2),163.06(C-O),161.63(C5-OH),157.04(C-4′),128.67(C-2′,C-6′),121.00(C-1′),116.14(C-3,C-5′),105.43(C-3),103.14(C-(C5-OH)),100.02(C-1″),99.62(C-6),94.94(C-8),77.26(C-2″),73.21(C-3″),69.65(C-5″),65.11(C-4″),60.69(C-6″);ESI-MS,m/z:433.112 95[M+H]+。
7-O-β-D-芹菜素半乳糖苷:1HNMR(400 MHz,DMSO-d6),δ:12.96(s,1H,OH-5),10.41(s,1H,OH-4′),7.95(d,J=8.8 Hz,2H,H-2′,H-6′),6.94(d,J=8.8 Hz,2H,H-3′,H-5′),6.86(s,1H,H-3),6.82(d,J=2.1 Hz,1H,H-8),6.45(d,J=2.1 Hz,1H,H-6),6.20(d,J=2.0 Hz,1H,H-1″),5.28~5.22(m,1H,OH-4″),5.02(d,J=7.7 Hz,1H,OH-3″),4.71(d,J=5.0 Hz,1H,OH-2″),4.56(d,J=4.6 Hz,1H,OH-6″),3.70~3.67(m,2H,H-2″,H-3″),3.67~3.53(m,4H,H-4″,H-5″,H-6″);13CNMR(101 MHz,DMSO-d6),δ:182.09(C=O),164.34(C-7),163.17(C5-OH),161.46(C-O),157.04(C-4′),128.70(C-2′,C-6′),121.13(C-1′),116.10(C-3′,C-5′),105.38(C-3),103.20(C-1″),100.60(C-(C5-OH)),99.58(C-6),94.89(C-8),75.81(C-5″),73.26(C-3″),70.15(C-2″),68.17(C-4″),60.38(C-6″);ESI-MS,m/z:433.113 04[M+H]+。
7-O-β-D-芹菜素阿拉伯糖苷:1HNMR(400 MHz,DMSO-d6),δ:12.95(s,1H,OH-5),10.39(s,1H,OH-4′),7.96(d,J=8.7 Hz,2H,H-2′,H-6′),6.94(d,J=8.7 Hz,2H,H-3′,H-5′),6.86(s,1H,H-3),6.81(d,J=1.7 Hz,1H,H-8),6.41(d,J=1.8 Hz,1H,H-6),5.30(d,J=5.1 Hz,1H,H-1″),5.04(d,J=6.8 Hz,2H,OH-2″,OH-4″),4.89(d,J=5.6 Hz,1H,OH-3″),4.70(d,J=3.9 Hz,1H,H-2″),3.75~3.62(m,4H,H-3″,H-4″,H-5″);13CNMR(101 MHz,DMSO-d6),δ:182.10(C=O),164.35(C-7),162.91(C5-OH),161.19(C-O),157.07(C-4′),128.74(C-2′,C-6′),121.13(C-1′),116.09(C-3′,C-5′),105.38(C-3),103.17(C-1″),100.29(C-(C5-OH)),99.58(C-6),94.75(C-8),72.45(C-2″),70.13(C-3″),67.56(C-4″),65.99(C-5″);ESI-MS,m/z:403.102 14[M+H]+。
2.2 分子对接结果
目标化合物与PI3K蛋白的结合能见表1,目标化合物与PI3K蛋白的对接结果见表2。
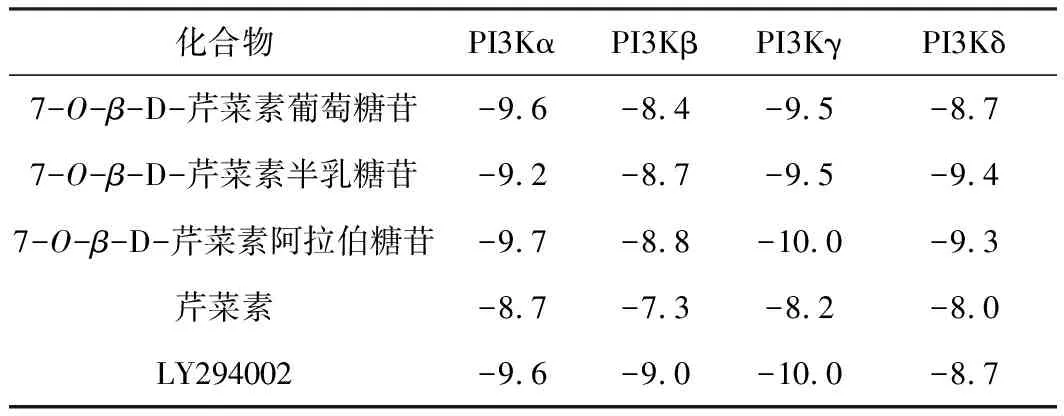
表1 目标化合物与PI3K蛋白的结合能/(kcal·mol-1)

表2 目标化合物与PI3K蛋白的对接结果
由表1可知,目标化合物与PI3K蛋白的结合能(-10.0~-8.4 kcal·mol-1)均明显低于芹菜素,与阳性对照LY294002相当。由表2可知,目标化合物在活性口袋中与更多氨基酸形成氢键和疏水作用。
2.3 讨论
在药物设计方面,LY294002的结构与黄酮类相似,提示黄酮类有被开发为新型PI3K抑制剂的潜能。同时,芹菜素具有来源丰富、毒性低和抗肿瘤作用明显等优势,是设计为新型高效低毒PI3K抑制剂的良好先导化合物。糖基化修饰既可改善芹菜素本身的溶解度,也能增强目标化合物与PI3K蛋白的亲和力,提高活性。在合成方面,利用Koenigs-Knorr法合成了7-O-β-D-芹菜素葡萄糖苷、7-O-β-D-芹菜素半乳糖苷和7-O-β-D-芹菜素阿拉伯糖苷,反应条件温和,操作简单,为芹菜素单糖苷的进一步研究提供物质基础。
在亲和力研究方面,综合考虑结合能、氢键和疏水作用,目标化合物与PI3Kα、PI3Kβ、PI3Kγ和PI3Kδ蛋白的亲和力均高于芹菜素的。其中,目标化合物对PI3Kβ蛋白的亲和力稍弱于其它蛋白,这可能与PI3Kβ蛋白活性位点的氨基酸有关。
3 结论
基于广谱型PI3K抑制剂LY294002的结构,以芹菜素为母核,设计合成了3个目标化合物7-O-β-D-芹菜素葡萄糖苷、7-O-β-D-芹菜素半乳糖苷和7-O-β-D-芹菜素阿拉伯糖苷,结构经1HNMR、13CNMR和ESI-MS表征;并通过分子对接研究了目标化合物与PI3Kα、PI3Kβ、PI3Kγ和PI3Kδ蛋白的亲和力。目标化合物与PI3K蛋白的亲和力均高于芹菜素的。设计合成的3个目标化合物有被进一步开发为PI3K抑制剂的潜力。
