滇西北地区鱼腥草抗氧化活性研究
2022-08-03靖恒烨高玉婷杨晓燕
倪 俊,靖恒烨,高玉婷,佘 容,杨晓燕,3,4*
(1.大理大学 天然抗氧化剂和抗氧化炎症研究院,云南 大理 671003;2.大理大学 东喜玛拉雅研究院,云南 大理 671003;3.中国三江并流区域生物多样性协同创新中心,云南 大理 671003;4.大理大学 三江并流区域生物多样性保护与利用云南省创新团队,云南 大理 671003)
随着人们生活水平的提高,抗氧化研究成为当今的研究热点。目前,已发现了大量抗氧化物质,其中不乏一些效果优良的抗氧化物质,如水溶性的VC和脂溶性的VE,但随着研究的不断深入,发现长期服用VC或VE会对人体产生副作用[1]。因此,在大健康时代,开发无毒、无害、易降解、对人体副作用更小、功效更持久的抗氧化物质成为抗氧化研究领域的主流趋势[2]。
鱼腥草(HouttuyniacordataThunb.),又名折耳根,属三百草科(Saururaceae)蕺菜属(Houttuynia),广泛分布于云南、四川和贵州等地[3],是卫生部确定的药食同源植物之一[4]。现代研究表明,鱼腥草中的挥发油、多糖、多酚和黄酮等物质均具有较强的抗氧化活性[5]。但是由于各地区生境不同,各地区的鱼腥草在外观、营养成分和含量上都会存在差异[6]。滇西北位于云南省西北部横断山区核心区域,是青藏高原至云贵高原的过渡地带,拥有独特的地形地貌和复杂的气候条件[7]。为此,作者分别采用石油醚、乙酸乙酯、正丁醇、95%乙醇和水等溶剂对滇西北地区鱼腥草的活性成分进行提取,通过DPPH法、ABTS法、FRAP法对其抗氧化活性进行综合评价,并与其它地区鱼腥草的抗氧化活性进行比较,探究滇西北地区鱼腥草作为天然抗氧化物质的可能性和优势,也为抗氧化物质产地的筛选提供参考。
1 实验
1.1 材料、试剂与仪器
新鲜滇西北地区鱼腥草,购于大理古城菜市场。
石油醚、乙酸乙酯、正丁醇、无水乙醇、DPPH、VC、ABTS、过二硫酸钾、无水醋酸钠、冰乙酸、HCl、FeSO4、TPTZ(三吡啶三嗪)等均为分析纯。
722N型可见分光光度计,上海菁华科技仪器有限公司;RE-2000A型旋转蒸发器,上海亚荣生化仪器厂;SCIENTZ-10N型冷冻干燥机、SB25-12DTD型超声波清洗机,宁波新芝生物科技股份有限公司;HWS-26型电热恒温水浴锅,上海一恒科学仪器有限公司;PX224ZH型电子天平,奥豪斯仪器有限公司;DZG-303A型超纯水机,成都艾柯水处理设备有限公司;GZX-9070 MBE型数显鼓风干燥箱,上海博迅实业有限公司。
1.2 鱼腥草提取物的制备
将滇西北地区鱼腥草洗净,置于40 ℃鼓风干燥箱中干燥至恒重,粉碎,过60目筛,-20 ℃保存备用。准确称取 5份鱼腥草粉末各50 g,置于500 mL锥形瓶中,按料液比1∶10(g∶mL)分别加入石油醚、乙酸乙酯、正丁醇、95%乙醇、蒸馏水,30 ℃、60 Hz超声提取1 h,过滤,滤液减压浓缩至干,用无水乙醇或反渗透纯水溶解,再冷冻干燥至恒重。
1.3 鱼腥草提取物的抗氧化活性评价
1.3.1 DPPH自由基清除能力的测定
DPPH自由基工作液的配制:精确称取DPPH粉末1 g,用无水乙醇溶解后定容至1 L,得浓度为1 g·L-1的DPPH自由基储备液,置于4 ℃冰箱冷藏,备用。吸取DPPH自由基储备液2 mL,加入无水乙醇18 mL,配制100 mg·L-1的DPPH自由基工作液。
DPPH自由基标准曲线的绘制:用无水乙醇将DPPH自由基工作液稀释成梯度浓度100 mg·L-1、80 mg·L-1、60 mg·L-1、40 mg·L-1、20 mg·L-1、10 mg·L-1、5 mg·L-1,测定517 nm处吸光度,每个浓度设置6个重复;以DPPH自由基浓度为横坐标、517 nm处吸光度为纵坐标绘制标准曲线。
DPPH自由基清除率的测定[8]:取适量鱼腥草提取物,用无水乙醇依次稀释成浓度(g·L-1)分别为2、1.5、1、0.5、0.25、0.125、0.062 5的样品溶液;分别将不同浓度的样品溶液与100 mg·L-1DPPH自由基工作液按体积比1∶1混匀,37 ℃水浴0.5 h后,测定517 nm处吸光度,每个浓度设置6个重复;以等浓度VC为阳性对照,同时设置样品对照和空白对照。按式(1)计算DPPH自由基清除率:
(1)
式中:A1为样品溶液+DPPH自由基工作液的吸光度;A2为样品溶液+无水乙醇的吸光度;A0为无水乙醇+DPPH自由基工作液的吸光度。
1.3.2 ABTS自由基清除能力的测定
ABTS自由基工作液的配制:将7 mmol·L-1ABTS自由基溶液和4.9 mmol·L-1K2S2O8溶液按体积比1∶1混匀,避光反应16 h,即为ABTS自由基母液,置于4 ℃冰箱冷藏,备用。取适量ABTS自由基母液,用无水乙醇稀释至其在734 nm处的吸光度为0.70±0.02,即为ABTS自由基工作液。
ABTS自由基清除率的测定[9]:取适量鱼腥草提取物,用无水乙醇依次稀释成浓度(g·L-1)分别为1、0.75、0.5、0.25、0.125、0.062 5、0.031 25、0.015 625的样品溶液;分别将不同浓度的样品溶液与ABTS自由基工作液按体积比1∶1混匀,室温下反应6 min后,测定734 nm处吸光度,每个浓度设置6个重复;以等浓度VC为阳性对照,同时设置样品对照和空白对照。按式(2)计算ABTS自由基清除率:
(2)
式中:A1为样品溶液+ABTS自由基工作液的吸光度;A2为样品溶液+无水乙醇的吸光度;A0为无水乙醇+ABTS自由基工作液的吸光度。
1.3.3 总抗氧化能力的测定
FRAP工作液的配制:将0.3 mol·L-1醋酸缓冲液(pH值3.6)、10 mmol·L-1TPTZ溶液、20 mmol·L-1FeCl3溶液按体积比10∶1∶1混匀,即为FRAP工作液。
FeSO4标准曲线的绘制:取0.1 mL 0.1~1.6 mmol·L-1的FeSO4标准溶液与2.4 mL FRAP工作液混匀,37 ℃水浴10 min后,测定593 nm处吸光度;以FeSO4浓度为横坐标、593 nm处吸光度为纵坐标绘制标准曲线。
总抗氧化能力的测定[10]:取适量鱼腥草提取物,用无水乙醇依次稀释成浓度(g·L-1)分别为20、15、10、5、2.5、1.25、0.625、0.312 5的样品溶液。取0.1 mL不同浓度的的样品溶液与2.4 mL FRAP工作液混匀,37 ℃水浴10 min后,测定593 nm处吸光度,每个浓度设置6个重复;同时设置空白对照。以FRAP值表征总抗氧化活性,以1 mmol·L-1FeSO4溶液为标准,当样品的总抗氧化活性达到同样吸光度时为一个FRAP值。按式(3)计算FRAP值:
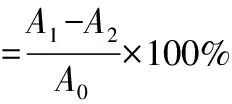
(3)
式中:A1为样品管的吸光度;A2为空白对照管的吸光度;A0为1 mmol·L-1FeSO4溶液的吸光度。
1.4 数据分析
采用GraphPad Prism 7.00软件和Excel软件绘制鱼腥草提取物浓度与抗氧化活性的关系曲线,并采用SPSS 20.0软件计算各提取物和VC对DPPH和ABTS自由基的清除能力(IC50),最后通过计算提取物与VC 的IC50比值得到提取物的比活性。
2 结果与讨论
2.1 DPPH自由基清除能力
2.1.1 DPPH自由基标准曲线(图1)
由图1可知,DPPH自由基浓度在5~100 mg·L-1范围内时,与吸光度线性关系较好,线性回归方程为:y=0.0198x-0.0433,R2=0.998。
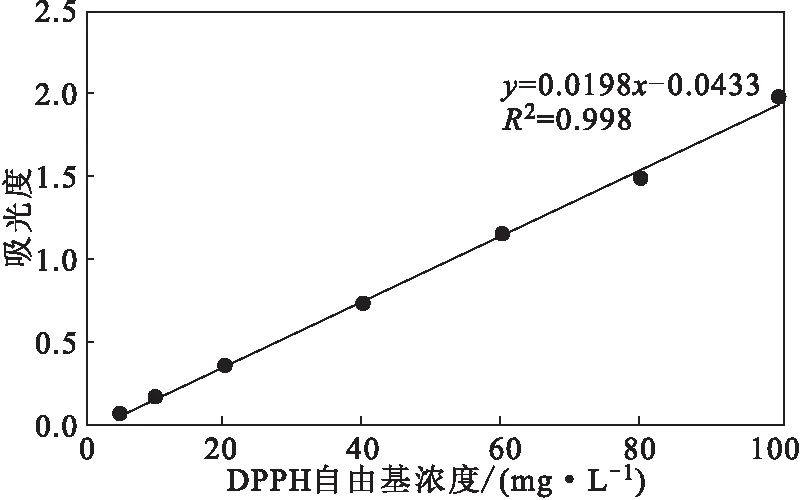
图1 DPPH自由基标准曲线
2.1.2 鱼腥草不同溶剂提取物对DPPH自由基的清除能力(图2)
由图2可知,鱼腥草不同溶剂提取物对DPPH自由基的清除率均随提取物浓度的增加逐渐升高,但对DPPH自由基的清除能力各异。相比较而言,95%乙醇提取物对DPPH自由基的清除能力最强(IC50值为0.45 g·L-1,相对于VC的比活性为1.4%)。在相同条件下,各提取物对DPPH自由基清除能力的强弱顺序为:95%乙醇提取物>水提取物>正丁醇提取物>石油醚提取物>乙酸乙酯提取物。

图2 鱼腥草不同溶剂提取物对DPPH自由基的清除能力
通过对鱼腥草不同溶剂提取物对DPPH自由基的清除率进行差异性分析(图3)发现,95%乙醇提取物、石油醚提取物和乙酸乙酯提取物分别与其它4种提取物的IC50值均存在显著性差异,水提取物与正丁醇提取物的IC50值差异不显著,但与其它3种提取物的IC50值均存在显著性差异。
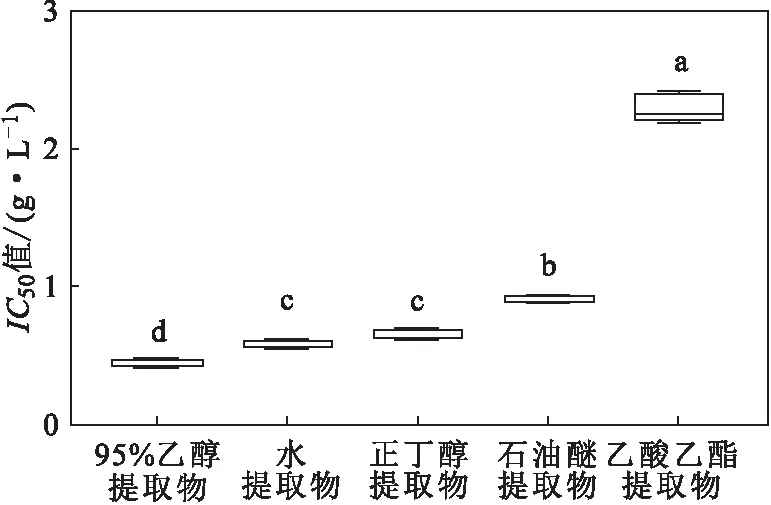
图3 鱼腥草不同溶剂提取物对DPPH自由基清除率的差异性分析
2.2 ABTS自由基清除能力(图4)
由图4可知,鱼腥草不同溶剂提取物对ABTS自由基的清除率均随提取物浓度的增加逐渐升高,呈剂量效应关系,但对ABTS自由基的清除能力各异。95%乙醇提取物对ABTS自由基的清除能力最强(IC50值为0.025 6 g·L-1,相对于VC的比活性为28.6%)。在相同条件下,各提取物对ABTS自由基清除能力的强弱顺序为:95%乙醇提取物>乙酸乙酯提取物>正丁醇提取物>石油醚提取物>水提取物。
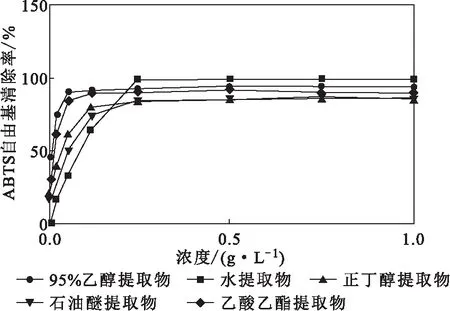
图4 鱼腥草不同溶剂提取物对ABTS自由基的清除能力
通过对鱼腥草不同溶剂提取物对ABTS自由基的清除率进行差异性分析(图5)发现,石油醚提取物和水提取物分别与其它4种提取物的IC50值均存在显著性差异,乙酸乙酯提取物与正丁醇提取物、95%乙醇提取物的IC50值差异不显著,但乙酸乙酯提取物、正丁醇提取物、95%乙醇提取物与其它2种提取物的IC50值均存在显著性差异。
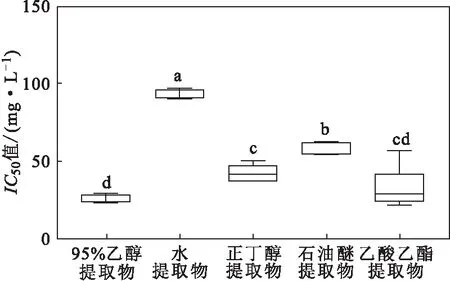
图5 鱼腥草不同溶剂提取物对ABTS自由基清除率的差异性分析
2.3 总抗氧化能力
2.3.1 FeSO4标准曲线(图6)

图6 FeSO4标准曲线
由图6可知,FeSO4溶液浓度在0.1~1.6 mmol·L-1范围内时,与吸光度线性关系较好,线性回归方程为:y=0.6012x+0.0429,R2=0.9937。
2.3.2 鱼腥草不同溶剂提取物的总抗氧化能力(图7)
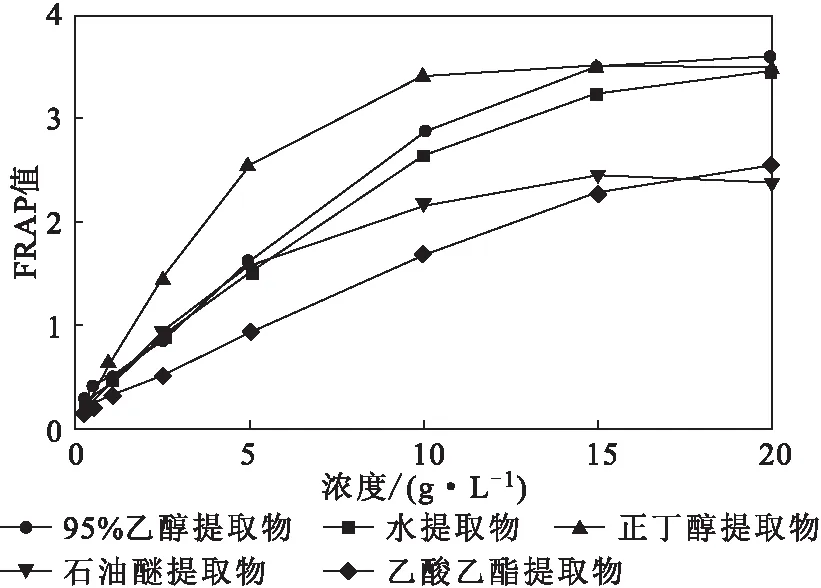
图7 鱼腥草不同溶剂提取物的总抗氧化能力
由图7可知,鱼腥草不同溶剂提取物的总抗氧化能力存在差异,整体均随提取物浓度的增加逐渐升高。当浓度为20 g·L-1时,95%乙醇提取物的总抗氧化能力最强,FRAP值达到了3.59。在浓度为20 g·L-1下,各提取物的总抗氧化能力强弱顺序为:95%乙醇提取物>正丁醇提取物>水提取物>乙酸乙酯提取物>石油醚提取物。
通过对鱼腥草不同溶剂提取物的总抗氧化能力进行差异性分析(图8)发现,乙酸乙酯提取物、石油醚提取物和水提取物分别与其它4种提取物的FRAP值均存在显著性差异,95%乙醇提取物与正丁醇提取物的FRAP值差异不显著,但与其它3种提取物的FRAP值均存在显著性差异。
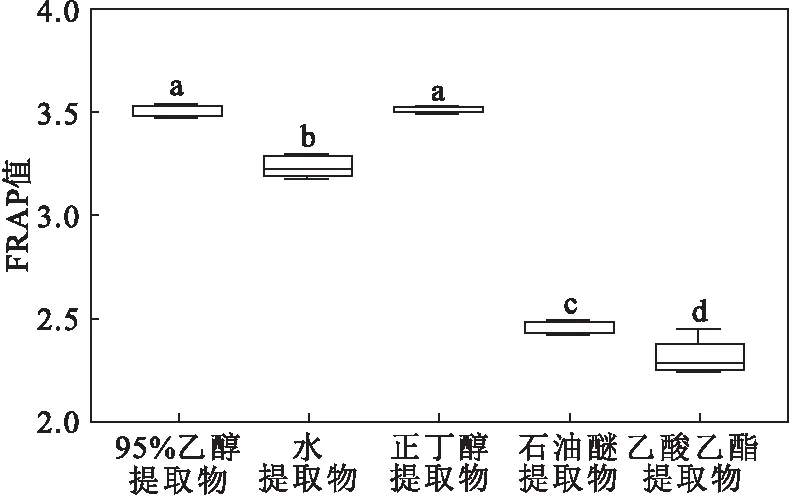
图8 鱼腥草不同溶剂提取物总抗氧化能力的差异性分析
2.4 讨论
2.4.1 滇西北地区鱼腥草与其它地区鱼腥草的抗氧化活性比较
在中药材活性成分的研究中,产地是其活性的关键影响因素之一。对相关研究报道进行比较分析发现,滇西北地区鱼腥草95%乙醇提取物的抗氧化能力略低于鄂西北地区鱼腥草的[11],略强于湖南鱼腥草的[12];其水提取物的抗氧化能力低于广西鱼腥草的[13],强于四川鱼腥草的[14];其石油醚提取物的抗氧化能力强于江西鱼腥草的[15]。由此可见,地区差异会影响鱼腥草的抗氧化活性成分,整体来说滇西北地区鱼腥草的抗氧化活性较高,这可能是由于,滇西北地区的高海拔、强光照、低氧含量和昼夜温差大等条件提高了该地区鱼腥草的抗氧化活性。因此,云贵高原地区和青藏高原地区可能是天然抗氧化物质筛选的理想产地。当然,本研究结果仅是粗提物的评估结果,粗提物成分复杂,无法确定活性物质,同时粗提物中可能存在影响实验结果的物质。如需进一步阐明不同地区鱼腥草的抗氧化活性差异,还需对粗提物进行分离纯化,确定其发挥抗氧化效果的有效成分及其含量差异等。
2.4.2 提取溶剂对鱼腥草抗氧化活性评价的影响
现阶段对鱼腥草抗氧化活性的研究多集中在鱼腥草的石油醚提取物的挥发油成分[15]、乙醇提取物多酚成分[16]和水提取物多糖成分[17]。从本研究结果来看,鱼腥草5种提取物均具有较强的抗氧化活性且存在差异,其中95%乙醇提取物的抗氧化活性最强。一方面可能是由于,鱼腥草多酚含量高,而多酚易溶于乙醇[18],导致其粗提物中多酚含量高;另一方面,也可能是由于多酚的抗氧化活性高于其它提取溶剂所得活性成分,如茶多酚的抗氧化能力是VE的10~20倍,是VC的100倍[19]。本研究中,乙酸乙酯提取物和正丁醇提取物也表现出了较强的抗氧化活性,而这2种提取物主要含黄酮和苷类化合物[20],而糖苷类化合物和花青苷类化合物均具有抗癌、抗炎和抗氧化等功效[21]。
2.4.3 抗氧化活性评价指标的选择探究
从本研究结果来看,鱼腥草同种提取物对DPPH自由基和ABTS自由基的清除能力存在差异,如95%乙醇提取物对DPPH自由基和ABTS自由基的IC50值分别为0.45 g·L-1和0.025 6 g·L-1。主要是因为,DPPH自由基的反应机制是基于氢原子转移机制,而ABTS自由基的反应机制同时包括了氢原子转移机制和单电子转移机制[22],因此,在相同浓度下,ABTS自由基活性高于DPPH自由基的[23]。另外,乙酸乙酯提取物对ABTS自由基的清除能力高于水提取物的,但乙酸乙酯提取物对DPPH自由基的清除能力却低于水提取物的。这说明对于成分复杂样品的抗氧化活性评价不应基于单一的抗氧化模型,应进行几种体外抗氧化实验来综合评价样品的抗氧化活性[24]。同时,DPPH、ABTS自由基都属于氮自由基[25-26]且是非人体自由基[27],若要对样品进行综合、有效的评价,则需增加如羟基自由基、超氧阴离子自由基等人体自由基指标。故建议对于样品抗氧化能力的测定应采用多种指标综合评价。
3 结论
采用DPPH法、ABTS法、FRAP法对滇西北地区鱼腥草石油醚提取物、乙酸乙酯提取物、正丁醇提取物、95%乙醇提取物和水提取物的抗氧化活性进行评价。结果表明,鱼腥草5种提取物均具有一定的抗氧化活性,其中95%乙醇提取物对DPPH自由基和ABTS自由基的清除能力最强,IC50值分别为0.45 g·L-1、0.025 6 g·L-1,与VC的比活性分别为1.4%、28.6%;95%乙醇提取物的总抗氧化能力也最强,FRAP值为3.59。3种评价结果显示滇西北地区鱼腥草具有较强的体外抗氧化活性,可作为天然抗氧化物质开发的优选对象。
