二氢槲皮素对IgA肾病大鼠肾脏保护的机制
2022-08-03师旭辉于建军曲矿云刘风勋
师旭辉 ,于建军 ,秦 洋 ,曲矿云* ,刘风勋
1.黄河三门峡医院肾脏内科,三门峡 472000;2.郑州大学第一附属医院肾内科,郑州 450000
IgA 肾病(IgA nephropathy,IgAN)是一种慢性进展性疾病,多数患者最终发展为肾功能衰竭[1]。目前对终末期肾病患者,除肾脏替代治疗外,尚无特异性治疗手段,因此,探寻延缓IgAN 进展、减轻肾脏病理变化的治疗方法十分必要[2]。二氢槲皮素(dihydroquercetin,DHQ)存在于花旗松、落叶松等植物中,属于二氢黄酮类化合物,具有抗炎、抗氧化、调节免疫、抗肿瘤等生物效应[3]。磷脂酰肌醇-3激酶(phosphatidylinositide 3-kinase,PI3K)/丝氨酸-苏氨酸蛋白激酶(protein kinase B,Akt)信号通路参与细胞分化、凋亡、增殖等生命活动[4-5],上调PI3K/Akt信号通路的表达,可加重肾小管上皮细胞炎性损伤[6],表明PI3K/Akt信号通路与肾脏疾病的发展密切相关。本研究通过建立IgAN 大鼠模型,分析DHQ 对IgAN 大鼠肾脏的保护作用及其对PI3K/Akt信号通路的作用机制,为临床治疗提供实验与理论依据。
1 仪器与材料
1.1 仪器
7600-020型全自动生化分析仪(日立公司);DYCZ-20G 型电泳仪(北京六一生物科技有限公司);1000-液晶型超声细胞破碎仪(南京赛飞生物科技有限公司);TGL20M 型台式超低温离心机(河南信陵仪器设备有限公司)。
1.2 试药
牛血清白蛋白(bovine serum albumin,BSA,质量分数为97%)、Masson染色液均购自北京索莱宝科技有限公司;四氯化碳(CCl4)、HE 染色液均购自上海阿拉丁生化科技股份有限公司;蓖麻油(北京伊诺凯科技有限公司);脂多糖(大连美仑生物技术有限公司);二氢槲皮素(DHQ,质量分数≥98%)和740Y-P(质量分数>96%),均购自上海麦克林生化科技有限公司);TLR4 荧光一抗以及Akt、p-Akt、PI3K 及p-PI3K 抗体均购自美国Abcam 公司
1.3 动物
SPF清洁级SD 雄性大鼠78只,8周龄,体质量为(175±25) g,购自北京唯尚立德生物科技有限公司,许可证号为SCXK(京)2016-0009,用普通饲料进行适应性喂养,自由进食、饮水,喂养1周,实施封闭管理。
2 方法
2.1 建立IgA 肾病大鼠模型
将78 只大鼠分为对照组(15 只)与干预组(63只),对照组不进行任何干预,干预组灌服BSA溶液(20 g BSA+500 mL 生理盐水,制成质量浓度为40 mg·mL-1的BSA 溶液),隔日1 次,连续处理6周;每周予以0.1 mL CCl4+0.5 mL蓖麻油皮下注射,连续处理9周;并于第6周、第8周时,于大鼠尾静脉注射0.05 mg脂多糖(将10 mg脂多糖充分溶解于1 mL生理盐水中,再取脂多糖溶液500 μL+生理盐水100 mL 混匀),直接免疫荧光染色显示系膜区有大量IgA 沉积为造模成功[7]。
2.2 动物分组与干预
干预组纳入造模成功的大鼠58只,随机分为模型组(14只)、740Y-P组(14只)、DHQ组(15只)、740Y-P+DHQ 组(15 只)。DHQ 组每日用100 mg·kg-1的DHQ溶液(用体积分数0.4%羧甲基纤维素钠配制)灌胃;740Y-P组腹腔注射740Y-P溶液0.02 mg·kg-1,每日1次;740Y-P+DHQ 组大鼠每日用100 mg·kg-1DHQ溶液灌胃,并腹腔注射740Y-P溶液0.02 mg·kg-1;对照组、模型组用等量生理盐水灌胃及腹腔注射。上述5组均连续处理12周。
2.3 酶联免疫吸附法(ELISA)检测大鼠血清炎性因子水平
末次干预后2 h,将各组大鼠用戊巴比妥钠腹腔麻醉,采集5 mL 腹主动脉血,以3 000 r·min-1离心20 min(离心半径为10 cm),取血清,用ELISA 检测大鼠血清炎性因子,按照说明书中的步骤稀释后加样。设置空白孔与样本孔,样本孔加酶标试剂,封板后于37 ℃温育30 min,加洗涤液,静置30 s后弃去,重复5次,拍干,加入显色剂,37 ℃避光显色10 min,加入终止液终止反应,检测450 nm 处各孔的吸光度,计算大鼠血清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-6(interleukin-6,IL-6)水平。
2.4 全自动生化分析仪测定大鼠肾功能
于末次给药前24 h收集大鼠尿液,去沉渣,用双缩脲法测定各组大鼠24 h尿蛋白定量(24 hours urinary protein quantitative,24 h pro);末次干预后取腹主动脉血标本,以3 000 r·min-1离心20 min(离心半径为10 cm)后,用全自动生化分析仪测定血清肌酐(serum creatinine,Scr)及血尿素氮(blood urea nitrogen,BUN)水平。
2.5 HE染色检测大鼠肾组织变化
采血完毕,处死大鼠,摘取两侧肾脏,用体积分数4%多聚甲醛固定(24 h)左肾组织,冲去肾组织表面的结晶,用体积分数70%、85%、95%、100%、100%乙醇脱水,每梯度30 min,二甲苯透明,浸蜡包埋,切成厚度3 μm 的病理切片;将切片依次放入二甲苯脱蜡15 min(3次),无水乙醇水化,滴加苏木素染液染色8 min,用自来水冲洗,擦干多余水分,滴加分化液3~4 s,流水冲洗,滴加伊红染料2 min,乙醇浸润,切片组织稍干后用中性树胶封片,置于显微镜下观察肾组织变化。
2.6 Masson染色观察大鼠肾纤维化
将4 μm石蜡切片放置于60 ℃烤箱,放置3~5 h,脱蜡水化,将Masson 复合染色液适量滴加在组织上,30 s后用蒸馏水冲洗,加入磷钼酸盐(5 min),甩干磷钼酸盐,滴加苯胺蓝染色(5 min),用蒸馏水冲洗,滴加分化液2次,45 s后甩干;将组织玻片依次放入体积分数为95%的乙醇溶液(1次)、乙醇(2次)浸润10 s,浸入二甲苯2 min(2次),玻片稍干后封片,置于显微镜下观察染色情况。
2.7 直接免疫荧光染色检测IgA 沉积
将6 μm 冰冻切片用体积分数4%甲醛固定(10 min),用PBS冲洗,插入玻片架,用柠檬酸盐缓冲液浸润,高压抗原修复3 min,取出玻片,冷却至室温,用PBS冲洗3次,每次5 min,滴加TLR4荧光一抗(FITC标记),置于4 ℃冰箱中避光孵育;次日用PBS冲洗3次,每次5 min,稍干后滴加抗荧光淬灭剂(50~100 μL),封片,于-20 ℃保存。
2.8 Western blot测定大鼠Akt、p-Akt、PI3K 和p-PI3K 蛋白的表达水平
取保存于液氮中的右肾,加入蛋白裂解液1 mL,用超声细胞破碎仪破碎细胞(3 min),以12 000 r·min-1离心10 min,提取总蛋白,用蛋白质定量法检测各组大鼠右肾蛋白质量浓度,用SDS-聚丙烯酰胺凝胶电泳分离蛋白,转膜,用Tween-20磷酸盐缓冲液封闭(含质量浓度为5 g·L-1的脱脂奶粉)1 h,加入Akt、p-Akt、PI3K 和p-PI3K 一抗(1∶1 000)4 ℃孵育过夜,次日用TBST洗膜,加入IgG 二抗(1∶5 000)孵育2 h,ECL曝光,置于凝胶成像分析系统,以β-actin为内参,分析目的蛋白的表达水平。
2.9 统计学方法
用Image-Pro plus 6.0软件采集与分析图像,用SPSS 22.0软件分析数据,计量资料以()表示,多组间比较用单因素方差分析,进一步两两比较用LSD-t检验,P<0.05表示差异有统计学意义。
3 结果
3.1 DHQ 对IgA 肾病大鼠炎性因子含量的影响
与对照组比较,模型组大鼠血清IL-1β、TNF-α和IL-6 的含量升高(P<0.05);与模型组比较,740Y-P组大鼠血清IL-1β、TNF-α和IL-6的含量升高,DHQ 组、DHQ+740Y-P 组大鼠血清IL-1β、TNF-α和IL-6 的含量降低(P<0.05);与DHQ+740Y-P组比较,DHQ 组血清IL-1β、TNF-α和IL-6的含量降低(P<0.05)。结果见表1。
表1 DHQ 对IgA肾病大鼠血清IL-1β、TNF-α 和IL-6水平的影响 ()Tab.1 Effect of dihydroquercetin on serum IL-1β,TNF-α and IL-6 levels in rats with IgA nephropathy ()

表1 DHQ 对IgA肾病大鼠血清IL-1β、TNF-α 和IL-6水平的影响 ()Tab.1 Effect of dihydroquercetin on serum IL-1β,TNF-α and IL-6 levels in rats with IgA nephropathy ()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与740Y-P组比较,cP<0.05;与DHQ 组比较,dP<0.05。
3.2 DHQ 对IgA 肾病大鼠肾功能的影响
与对照组比较,模型组24 h pro、Scr和BUN 水平升高(P<0.05);与模型组比较,740Y-P 组24 h pro、Scr和BUN 水平升高,DHQ 组、DHQ+740Y-P组24 h pro、Scr和BUN 水平降低(P<0.05);与DHQ+740Y-P 组比较,DHQ 组24 h pro、Scr 和BUN 水平降低(P<0.05)。结果见表2。
表2 DHQ 对IgA肾病大鼠24 h pro、Scr和BUN 水平的影响 ()Tab.2 Effect of dihydroquercetin on the levels of 24 h pro,Scr and BUN in rats with IgA nephropathy ()

表2 DHQ 对IgA肾病大鼠24 h pro、Scr和BUN 水平的影响 ()Tab.2 Effect of dihydroquercetin on the levels of 24 h pro,Scr and BUN in rats with IgA nephropathy ()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与740Y-P组比较,cP<0.05;与DHQ 组比较,dP<0.05。
3.3 DHQ对IgA肾病大鼠肾脏HE染色结果的影响
对照组大鼠肾小球正常,肾间质未见炎性浸润,几乎无肾小球萎缩;模型组肾小球基底膜增厚,炎性细胞浸润,肾小球萎缩;740Y-P组炎性细胞浸润及肾小球明显萎缩,小血管硬化,较模型组大鼠肾脏病理表现加重;DHQ 组病理损伤减轻,肾小球趋于正常,有少量炎性浸润,较模型组及740Y-P 组改善明显;DHQ+740Y-P组炎性浸润、肾小球萎缩有所改善,但程度远不及DHQ 组。结果见图1。
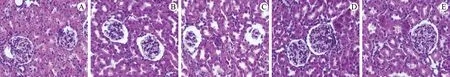
图1 大鼠肾组织HE染色结果Fig.1 HE staining results of rat kidney tissue
3.4 DHQ 对IgA 肾病大鼠肾纤维化的影响
由表3可知,Masson染色显示对照组大鼠肾内未见明显蓝色胶原蛋白沉积,肾脏无纤维化;模型组、740Y-P组均沉积较多蓝色胶原蛋白,纤维化程度加重,且740Y-P组更为明显;DHQ 组蓝色胶原蛋白沉积最少,肾纤维化程度减轻,而DHQ+740Y-P组蓝色胶原蛋白沉积有所减轻,但纤维化程度高于DHQ 组。由图2可见,与对照组比较,模型组阳性区占观察视野面积比升高(P<0.05);与模型组比较,740Y-P组面积比升高,DHQ 组、DHQ+740Y-P组面积比降低(P<0.05);与DHQ+740YP组比较,DHQ 组面积比降低(P<0.05)。结果见表3、图2。
表3 DHQ 对IgA肾病大鼠胶原纤维阳性区占观察视野面积比和IgA综合密度的影响 ()Tab.3 Effect of dihydroquercetin on the ratio of collagen fiberpositive area to the observation field and the comprehensive density of IgA in rats with IgA nephropathy ()

表3 DHQ 对IgA肾病大鼠胶原纤维阳性区占观察视野面积比和IgA综合密度的影响 ()Tab.3 Effect of dihydroquercetin on the ratio of collagen fiberpositive area to the observation field and the comprehensive density of IgA in rats with IgA nephropathy ()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与740Y-P组比较,cP<0.05;与DHQ 组比较,dP<0.05。

图2 肾组织Masson染色结果Fig.2 Masson staining results of kidney tissue
3.5 DHQ 对IgA 肾病大鼠直接免疫荧光染色结果与IgA 沉积的影响
由图3可知,对照组大鼠肾内无绿色荧光;模型组、740Y-P组可见大量IgA 绿色荧光沉积,且740Y-P组更甚;DHQ组仅有微量IgA绿色荧光沉积,而DHQ+740Y-P组IgA绿色荧光沉积程度高于DHQ组。由表3可知,与对照组比较,模型组IgA 密度值升高(P<0.05);与模型组比较,740Y-P组IgA密度值高于模型组,DHQ 组、DHQ+740Y-P组IgA 密度值降低(P<0.05);与DHQ+740Y-P组比较,DHQ组IgA 密度值降低(P<0.05)。结果见表3、图3。

图3 肾组织直接免疫荧光染色Fig.3 Direct immunofluorescence staining of kidney tissue
3.6 DHQ 对IgA 肾病大鼠Akt、p-Akt、PI3K、p-PI3K 蛋白表达水平的影响
与对照组比较,模型组p-Akt、p-PI3K 蛋白的表达水平升高(P<0.05);与模型组比较,740Y-P 组p-Akt和p-PI3K 蛋白的表达水平升高,DHQ 组、DHQ+740Y-P组p-Akt和p-PI3K 蛋白的表达水平降低(P<0.05);与DHQ+740Y-P组比较,DHQ 组p-Akt和p-PI3K 蛋白的表达水平降低(P<0.05)。结果见表4、图4。
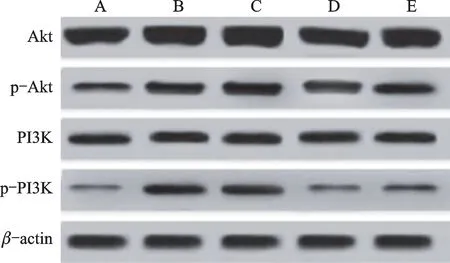
图4 肾组织Akt、p-Akt、PI3K 和p-PI3K 蛋白的表达水平Fig.4 Akt,p-Akt,PI3K and p-PI3K protein expression in kidney tissue
表4 DHQ 对IgA肾病大鼠Akt、p-Akt、PI3K 和p-PI3K 蛋白表达的影响 ()Tab.4 Effect of dihydroquercetin on the protein expression of Akt,p-Akt,PI3K,and p-PI3K in rats with IgA nephropathy ()

表4 DHQ 对IgA肾病大鼠Akt、p-Akt、PI3K 和p-PI3K 蛋白表达的影响 ()Tab.4 Effect of dihydroquercetin on the protein expression of Akt,p-Akt,PI3K,and p-PI3K in rats with IgA nephropathy ()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与740Y-P组比较,cP<0.05;与DHQ 组比较,dP<0.05。
4 讨论
目前研究认为[8]IgAN 的发病与免疫炎症学、遗传学等机制相关,其发病伴随着趋化因子、炎性因子、免疫诱导等的炎症级联反应,引起机体炎症浸润,细胞因子、活性氧等表达量增加,引起系膜区以IgA 为主的复合物沉积[9-10],病情进展下逐渐诱导肾小球硬化与肾间质纤维化,导致肾功能发生不可逆损伤。因此探寻有效药物来阻断、延缓IgAN 病情的进展,或可阻断不可逆损伤的发生,从而改善患者的预后。
DHQ 又称花旗松素,结构特殊,生物效用广泛,抗氧化能力强于普通黄酮类化合物,研究表明,其具有抑制肿瘤、舒张血管、治疗高血压等作用[11-12],且DHQ 还具有抑制细胞增殖、降低炎症水平与氧化应激的作用[13]。有学者将DHQ 应用于糖尿病肾病大鼠,结果显示DHQ 可减轻大鼠模型症状,起到保护肾脏的作用[14]。IgAN是一种炎症性肾脏疾病,机体多种细胞因子表达紊乱,如IL-1β、TNF-α及IL-6等炎性因子持续作用可激发内皮因子释放,引起肾小球系膜增生,肾小球内皮细胞通透性增大,进而使大分子蛋白滤出肾小球,且炎性因子还可影响氮质代谢废物排泄,导致肾功能发生进展性损伤[15],调节炎性因子水平可使肾脏病理损伤减轻[16]。本研究结果显示,模型组血清IL-1β、TNF-α和IL-6 水平以及24 h pro、Scr和BUN 的水平高于对照组,提示IgAN 大鼠血清炎性因子过量表达,肾功能受损,而用DHQ处理后上述血清炎性因子与肾功能指标明显下降,说明DHQ 在减轻IgAN 大鼠炎症反应方面效果确切,可调节肾小球滤过作用,促进Scr、BUN 排出,改善大鼠肾功能。此外,观察HE、Masson、直接免疫荧光染色结果发现,对照组肾小球正常,肾间质未见炎性浸润,肾脏无纤维化,无IgA 绿色荧光沉积,而造模后大鼠肾小球萎缩,肾脏纤维化程度加强,肾内可见大量IgA 绿色荧光沉积,用DHQ 处理后造模大鼠病理情况均有明显改善,说明DHQ 能减少IgA 沉积,减轻炎症因子表达,缓解肾脏纤维化,以改善大鼠肾功能。
PI3K/Akt通路是细胞内重要的信号转导系统,因其能调节细胞骨架、影响细胞迁移而受到重视,其中PI3K 由调节亚基p85与催化亚基p110组成,可接收G 蛋白连接受体传递的信号,Akt是PI3K 下游的直接靶蛋白,接收PI3K 触发的表达信息,磷酸化下游诸多功能蛋白等效应因子,参与细胞凋亡、分化、存活等生理过程的调控,进而调控机体细胞的活性[17-18]。研究发现,PI3K/Akt通路与肾脏缺血再灌注损伤[19]及肾纤维化[20]有关。为明确DHQ 治疗IgAN 大鼠的作用机制,本研究用Western blot检测PI3K/Akt通路及其相关蛋白表达水平的变化,结果发现,模型组p-Akt、p-PI3K 蛋白的表达水平高于对照组,表明IgAN 大鼠机体PI3K/Akt通路异常活化,参与IgAN 病情进展;在造模基础上使用激动剂740Y-P处理,结果显示,740Y-P组p-Akt和p-PI3K蛋白的表达水平高于模型组,表明肾病理损伤越严重,p-Akt 和p-PI3K 蛋白的表达水平越高;而用DHQ 处理后,DHQ 组p-Akt和p-PI3K 蛋白的表达水平明显低于740Y-P组、DHQ+740Y-P组,提示即使在740Y-P抵消DHQ 部分作用的情况下,DHQ 仍可下调p-Akt和p-PI3K 蛋白的表达水平,由此证实DHQ 可抑制PI3K/Akt信号通路相关分子的表达,调节IgAN 大鼠肾功能,改善预后。
综上所述,DHQ 应用于IgAN 大鼠,可降低大鼠血清炎性因子表达水平,明显减少胶原蛋白与IgA沉积,减轻病理损伤,改善大鼠肾功能,这可能与DHQ 抑制PI3K/Akt通路有关,可为后续实验研究及临床治疗提供参考依据。
