基于HPLC指纹图谱及多成分含量的化学模式识别法评价小血藤质量
2022-08-03肖会敏黄新文罗欢欢党学德王四旺
肖会敏 ,杨 旭 ,黄新文 ,罗欢欢 ,刘 洋 ,李 捷 ,党学德*,王四旺*
1.陕西含光生物科技有限公司研发部,西安 710077;2.西北大学生命科学与医学部,西安 710069;3.江西中医药大学,南昌 330004;4.西北农林科技大学,杨凌 712100;5.空军军医大学中药与天然药物教研室,西安 710032
小血藤[Schisandrapropinqua(Wall.) Baill.var.sinensisOliv.]又称铁箍散、香巴戟、血糊藤、钻岩尖等,为五味子科五味子属植物,全草入药,10~11月采收,分布于陕西、甘肃、湖北、湖南、四川、云南、贵州等地,具有行气止痛、活血散瘀等功效,常用于治疗风湿麻木、筋骨疼痛、跌打损伤等[1-3]。其主要含有芦丁、β-谷甾醇、对羟基苯乙醇苷等成分[4-9],其中芦丁具有广泛的药理活性[10-11]。目前,针对小血藤的研究主要为化学成分的提取与鉴定及生物活性的分析[12-13],关于小血藤指纹图谱与化学模式识别的研究尚未见报道。将指纹图谱和化学模式识别技术结合具有良好的评价功能,广泛应用于中药鉴别、质量控制等领域[14-18]。本研究用高效液相色谱二极管阵列器法(high performance liquid chromatography photodiode array,HPLC-PDA)指纹图谱技术建立24批不同产地的小血藤的综合质量评价模式,对指纹图谱数据进行主成分分析(principal component analysis,PCA)和正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA),以筛选其质量差异标志物。同时,测定小血藤中芦丁、紫云英苷、槲皮素3种成分的含量,旨在从生产源头确保药材品质,亦为完善小血藤质量评价标准提供依据。
1 仪器与试药
1.1 仪器
Prominence UFLC型高效液相色谱仪(配SPDM20A 二极管阵列检测器)、LC/Labsoluion 色谱工作站、Shim-pack Scepter C18液相色谱柱(250 mm×4.6 mm,5 μm),均购自日本岛津公司;十万分之一电子分析天平(型号MD200,德国赛多利斯公司);KQ-5200DE台式数控超声波清洗器(上海虔钧科学仪器有限公司)。
1.2 试药
对照品:芦丁(批号B20771,质量分数≥98%),紫云英苷(批号B21704,质量分数≥98%),槲皮素(批号B20527,质量分数≥98%),均购自上海源叶生物科技有限公司;甲醇、乙腈为色谱纯;水为纯净水。
24批不同产地小血藤(编号S1~S24),经党学德高级工程师鉴定,均为五味子科植物五味子属小血藤[Schisandrapropinqua(Wall.) Baill.var.sinensisOliv.]的干燥藤叶。样品信息见表1。

表1 小血藤样品信息Tab.1 Sample information of Schisandra propinqua var.sinensis samples
2 方法与结果
2.1 HPLC指纹图谱的建立
2.1.1 色谱条件 色谱柱:Shim-pack Scepter C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-1 mL·L-1磷酸水溶液(B),按表2中的程序进行梯度洗脱;记录时间:80 min。流速:0.8 mL·min-1;柱温:30 ℃;检测波长:300 nm;进样量:20 μL。
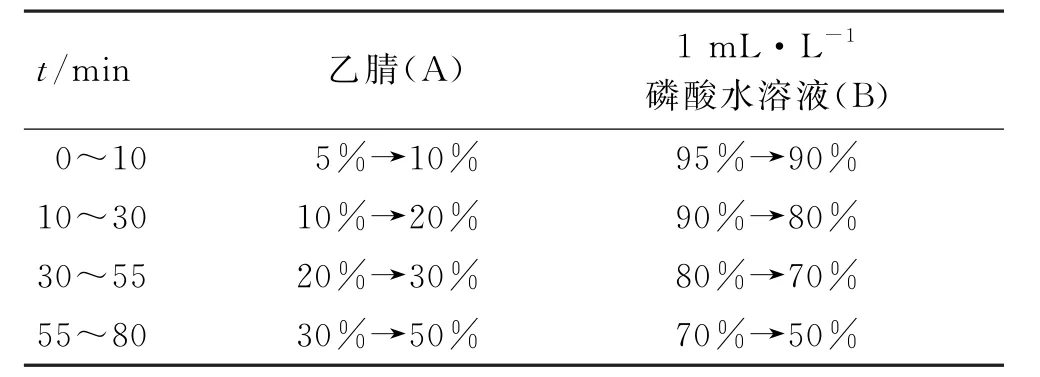
表2 梯度洗脱程序Tab.2 Gradient elution procedure
2.1.2 供试品溶液的制备 取样品适量,粉碎(过4号药典筛),精密称定上述粉末1.0 g,加入体积分数为50%的甲醇25 mL,称定质量,超声(功率为250 W,频率为33 kHz)45 min,放凉,再次称定质量,用体积分数为50%的甲醇补足减失的质量,混匀,经0.45 μm微孔滤膜过滤,取续滤液,即得供试品溶液。
2.1.3 混合对照品溶液的制备 分别精密称取对照品芦丁12.00 mg、紫云英苷14.00 mg、槲皮素16.60 mg,置于100 mL量瓶中,加甲醇制成3种成分质量浓度分别为117.60、137.20、162.68 μg·mL-1的混合对照品溶液,作为储备液。
2.1.4 精密度实验 取供试品溶液(S6),按2.1.1项下色谱条件连续进样测定6次,以芦丁为对照,记录各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰相对保留时间的RSD 值均小于2%,相对峰面积的RSD值均小于3%,表明方法的精密度良好。
2.1.5 稳定性实验 取供试品溶液(S6),分别于室温下放置0、4、8、12、16、24 h,按2.1.1项下色谱条件进样测定,以芦丁为对照,记录各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰相对保留时间的RSD值均小于2%,相对峰面积的RSD值均小于3%,表明供试品溶液于室温下放置24 h内稳定性良好。
2.1.6 重复性实验 取药材样品(S6)6份,按2.1.2项下方法制备供试品溶液,再按2.1.1项下色谱条件进样测定,以芦丁为对照,记录各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰相对保留时间的RSD 值均小于2%,相对峰面积的RSD 值均小于3%,表明方法的重复性良好。
2.1.7 指纹图谱的生成 取24 批药材样品,按2.1.2项下方法制备供试品溶液,再按2.1.1项下色谱条件进样测定,用“中药色谱指纹图谱相似度评价系统(2012A 版)”,以S1为参照图谱,建立24批小血藤样品的指纹图谱。叠加指纹图谱见图1,对照指纹图谱见图2。

图1 24批样品(S1~S24)和对照品(R)的HPLC 叠加指纹图谱Fig.1 HPLC fingerprints of 24 batches of samples (S1-S24)and references (R)
2.1.8 共有峰的指认 通过将24批样品的特征峰与混合对照品色谱峰比对,指认12 号峰为芦丁,14号为紫云英苷,16号为槲皮素,见图2。研究确认小血藤中芦丁的含量较高,峰形稳定且分离度较好,故将其作为对照峰,计算其他峰的相对保留时间和相对峰面积。结果显示,24批样品相对保留时间的RSD值均小于2.0%,相对峰面积的RSD值均小于99.82%。
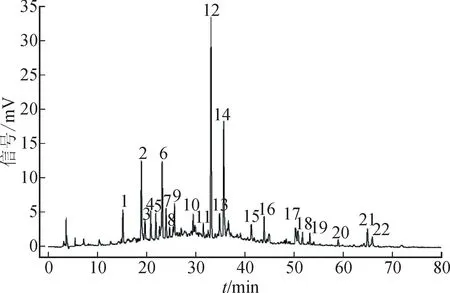
图2 样品的HPLC对照指纹图谱Fig.2 HPLC control fingerprint of samples
2.1.9 相似度分析 用“中药色谱指纹图谱相似度评价系统(2012A 版)”,以软件生成的小血藤的共有模式图为对照图谱,进行相似度评价,见表3。结果显示,陕南产样品S1~S12的相似度均大于0.92,其余样品的相似度均在0.745~0.912范围内,表明不同产地小血藤的化学成分存在一定差异。
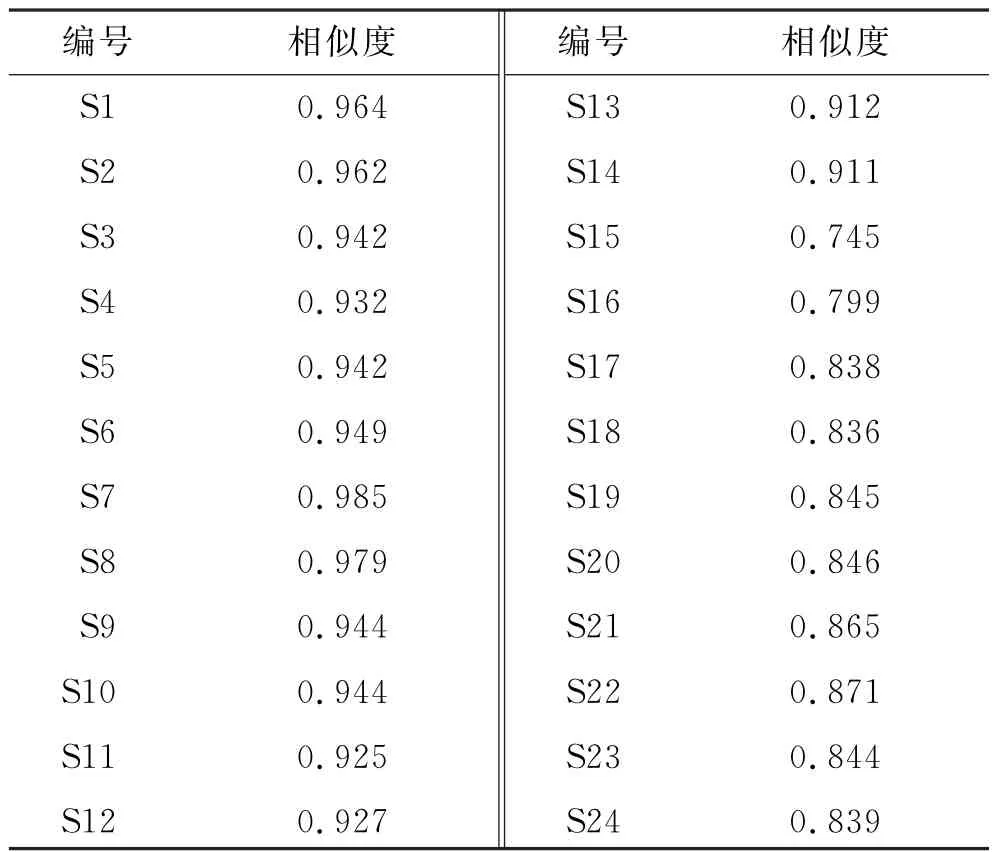
表3 相似度评价结果Tab.3 Results of similarity evaluation
2.2 聚类分析
以24批小血藤样品的各共有峰峰面积为变量,用SPSS 26.0统计软件,以组间联接平方欧氏距离为测度进行聚类分析[19-20],见图3。由图3可知,24批药材样品可聚为2类,S1~S16、S21、S22聚为Ⅰ类,Ⅰ类又可聚为2 类,S15、S16 为Ⅰa 类,S13、S14、S21、S22、S1~S12为Ⅰb类;S17~S19、S23、S24聚为Ⅱ类,Ⅱ类也可聚为2类,S19、S20为Ⅱa类,S17、S18、S23、S24为Ⅱb类。结果表明,陕南、甘肃产区及中部地区(湖南、湖北)与西南地区(四川、广西、云南)产小血藤存在较明显的地域差异。

图3 24批样品的聚类分析树状图Fig.3 Hierarchical cluster analysis for 24 batches of samples
2.3 PCA 分析
以共有峰的峰面积为变量,用SIMCA 14.1统计软件进行主成分分析。结果显示,前5种主成分的方差贡献率分别为36.16%、19.03%、17.47%、10.93%、8.30%,累积方差贡献率为91.89%,表明前5种主成分可揭示药材来源与22种共有成分的相关性,可反映药材中大部分的差异信息。24批小血藤主成分分析得分图见图4。由图4可见,不同产区的小血藤能够较好地区分开,S1~S12分布于得分图的右侧、S13~S24分布于得分图的左侧,且S19~S20分布在外侧。表明不同产区小血藤的化学成分存在差异,该结果与聚类分析的结果一致。结果见图4、图5。
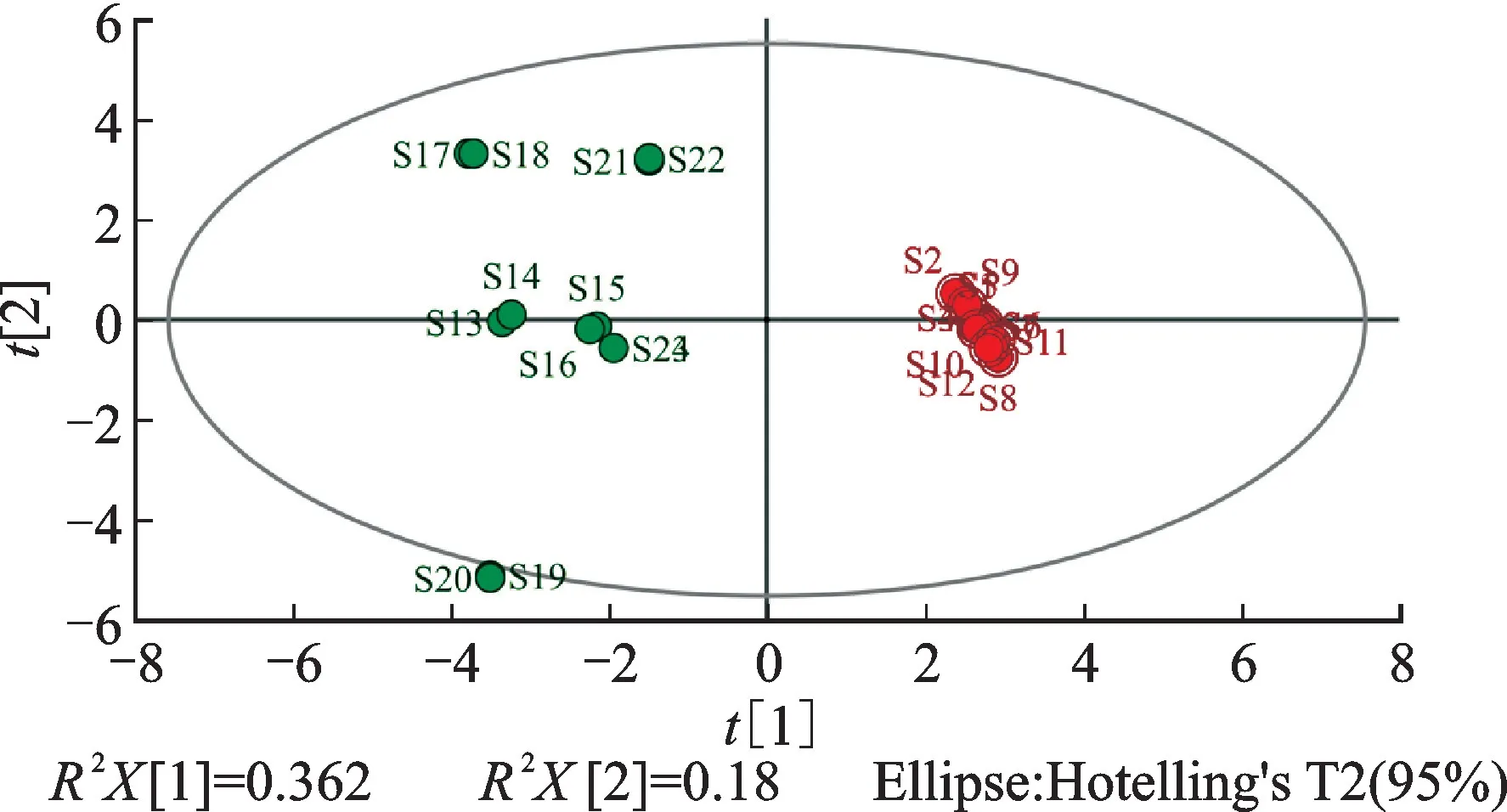
图4 24批小血藤主成分分析得分图Fig.4 Score chart of principal component analysis of 24 batches of Schisandra propinqua var.sinensis
2.4 OPLS-DA 分析
OPLS-DA 拟合效果的评价指标主要是累积解释能力参数(R2X、R2Y)和预测能力参数(Q2),若R2Y、Q2均大于0.5,则表示拟合效果较好,且越接近1越好[21]。将24批小血藤样品按来源分为陕南产地组、其他产地组,用SIMCA 14.1 统计软件进行OPLS-DA 分析,得分散点图见图5。由图5可知,陕南产地组与其他产地组分别分布于得分散点图的两侧,R2X=0.683,R2Y=0.998,Q2=0.994,R2Y、Q2均超过0.5。结果表明,OPLS-DA 预测模型可用于区分不同来源的小血藤,2组样品的化学成分含量存在差异。
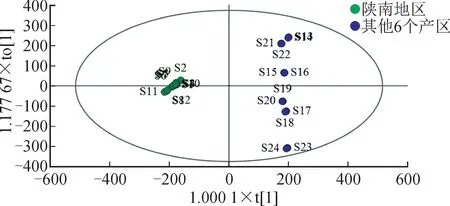
图5 OPLS-DA 得分散点图Fig.5 OPLS-DA score scatter plot
提取OPLS-DA 模型中22个共有峰峰面积的变量投影重要性(variable projection importance,VIP)值,并选择其中VIP 值大于1的共有峰[22],见图6。由图6可知,VIP值大于1的色谱峰分别为12号峰(芦丁,VIP值为3.05)、14号峰(紫云英苷,VIP值为1.84)、17 号峰(VIP 值为1.29)、6 号峰(VIP 值为1.07)、13号峰(VIP值为1.05),表明这5种化学成分是影响小血藤质量的差异标志物。
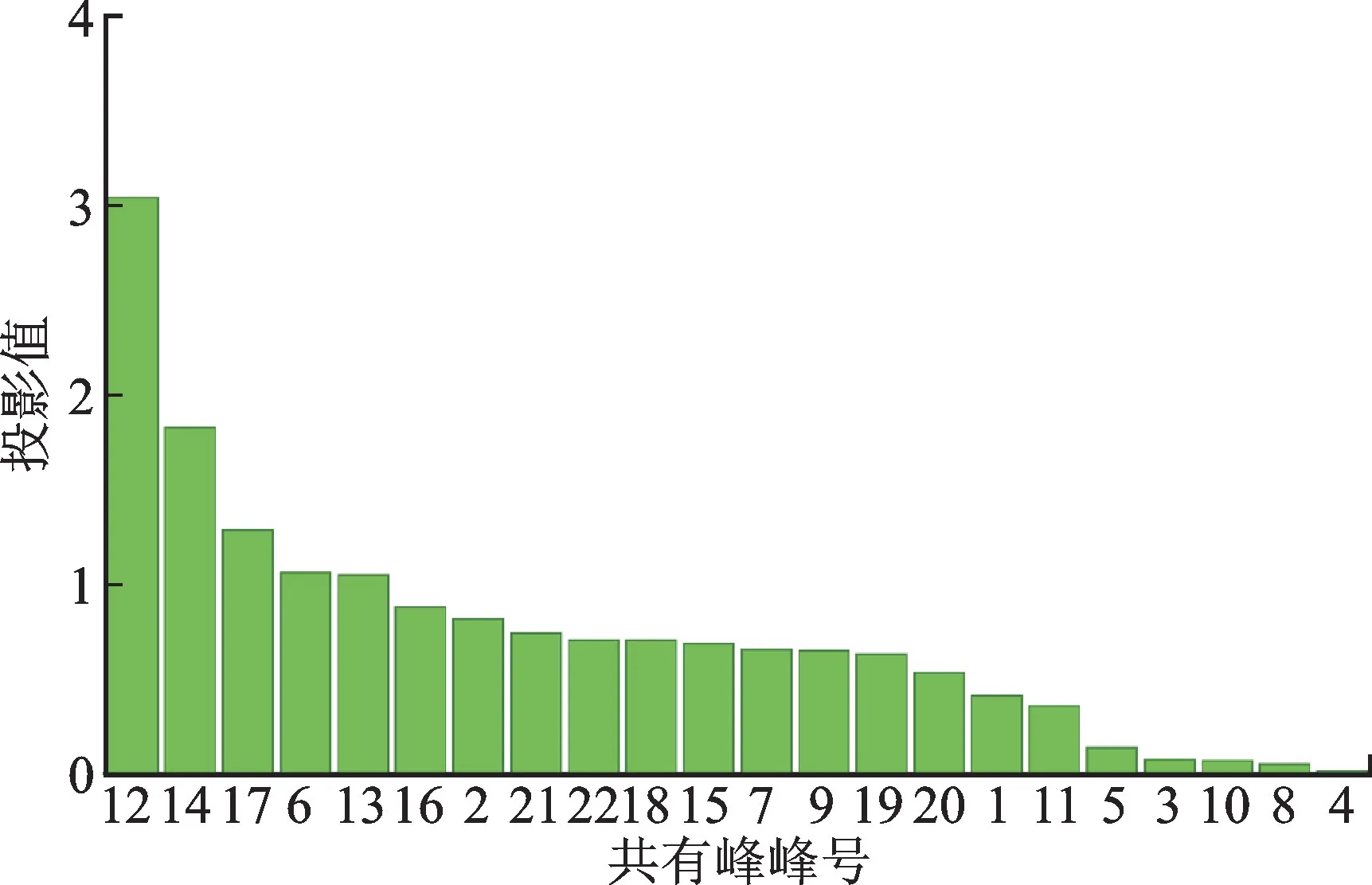
图6 24批样品OPLS-DA模型中22个共有峰的VIP值Fig.6 VIP values of 22 common peaks in OPLS-DA model of 24 batches of samples
2.5 含量测定
2.5.1 色谱条件 同2.1.1项色谱条件。
2.5.2 供试品溶液的制备 取样品适量,粉碎(过4号药典筛),精密称定上述粉末1 g,加入体积分数为50%的甲醇25 mL,称定质量,超声(功率250 W,频率33 kHz)提取45 min,放冷,再次称定质量,用体积分数为50%的甲醇补足减失的质量,混匀,经0.45 μm微孔滤膜过滤,取续滤液,即得供试品溶液。
2.5.3 混合对照品溶液的制备 分别精密称取对照品芦丁12.00 mg、紫云英苷14.00 mg、槲皮素16.60 mg,置于100 mL量瓶中,加甲醇制成上述3种成分质量浓度分别为117.60、137.20、162.68 μg·mL-1的混合对照品溶液,作为储备液。
2.5.4 标准曲线及线性范围 分别精密量取储备液0.01、0.05、0.10、0.25、0.50、1.00 mL,分别置于各个1 mL量瓶中,加甲醇定容至1 mL,分别得系列对照品溶液。进样测定,记录峰面积,考察对照品质量浓度(x)与峰面积(y)的线性关系,见表4。结果表明,各成分在相应质量浓度范围内,线性关系良好。

表4 线性方程与范围及相关系数Tab.4 Linear equations,ranges and correlation coefficients
2.5.5 系统适用性实验 取混合对照品溶液、供试品溶液和阴性对照溶液各适量,按2.2.1项下色谱条件进样测定,记录色谱图,见图7。
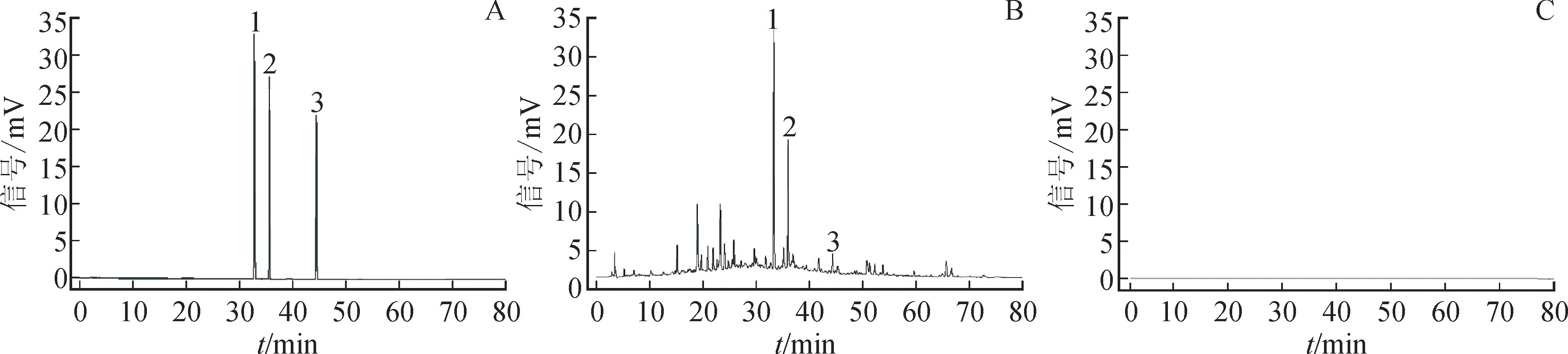
图7 混合对照品、供试品及阴性对照品的高效液相色谱图Fig.7 HPLC chromatograms of mixed control,test and negative control
2.5.6 精密度实验 取2.2.2 项下供试品溶液(S6),按2.2.1项下色谱条件连续进样测定6次,记录芦丁、紫云英苷、槲皮素峰面积。结果显示,芦丁、紫云英苷、槲皮素峰面积的RSD 值均小于2%,表明方法的精密度良好。
2.5.7 稳定性实验 取供试品溶液(S6),分别于室温下放置0、4、8、12、16、24 h,按2.1.1项下色谱条件进样,测定芦丁、紫云英苷、槲皮素峰面积。结果显示,芦丁、紫云英苷、槲皮素峰面积的RSD值均小于2%,表明供试品溶液于室温下放置24 h内稳定性良好。
2.5.8 重复性实验 取药材样品(S6)6份,按2.1.2项下方法制备供试品溶液,再按2.1.1项下色谱条件进样测定,记录峰面积并计算含量的RSD 值。结果显示,芦丁、紫云英苷、槲皮素峰面积的RSD 值均小于2%,见表5,表明方法的重复性良好。

表5 重复性实验结果Tab.5 Repeatability test results
2.5.9 加样回收率实验 取小血藤样品(S6)适量,共6份,按2.1.2 项下方法制备供试品溶液,再按2.1.1项下色谱条件进样测定,记录各峰面积。结果显示,芦丁、紫云英苷、槲皮素加样回收率的RSD 值均小于3%,见表6,表明方法的重复性良好。

表6 加样回收率实验结果Tab.6 Test results of sample addition recovery
2.5.10 含量测定 取24批小血藤样品,按2.1.2项下方法制备供试品溶液,再按2.1.1项下色谱条件进样测定,记录各成分峰面积,计算含量,见表7。结果显示,不同产地小血藤中各成分的含量有差异,陕南产小血藤中3种成分的含量较高,其他产地含量偏低。
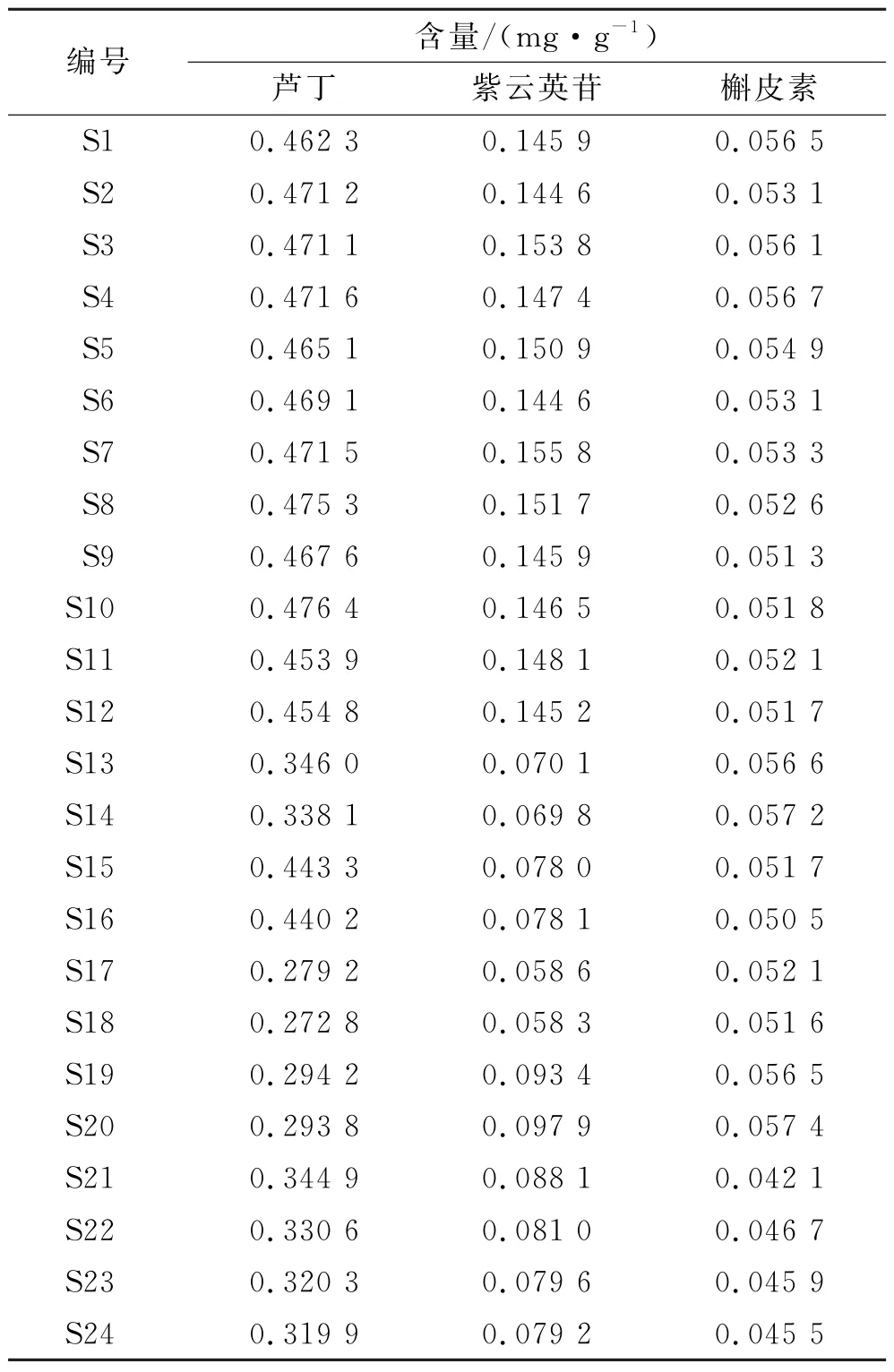
表7 24批样品含量测定结果Tab.7 Determination results of 24 batches of sample content
3 讨论
3.1 色谱条件
本研究通过二极管阵列在200~800 nm 波长范围内对供试品溶液进行扫描后发现,当检测波长为300 nm 时,各色谱峰均有较强吸收,且分离度较好,故选择300 nm 为检测波长。比较了以甲醇-磷酸水溶液(0.5、1、2 mL·L-1)、乙腈-磷酸水溶液(0.5、1、2 mL·L-1)、乙腈-甲酸溶液(0.5、1、2 mL·L-1)等为流动相的分离效果。结果显示,以乙腈-1 mL·L-1磷酸水溶液进行梯度洗脱时,色谱峰的分离度较好,故选择将乙腈-1 mL·L-1磷酸水溶液作为流动相。
3.2 制样方法
比较了加热回流、冷浸和超声(15、30、45、60 min)3种提取方法对样品色谱峰的影响。结果显示,样品经超声提取色谱信息丰富、色谱峰响应强、分离度良好且杂质干扰少,故选择超声提取制备供试品溶液。
3.3 统计分析
24批小血藤样品的相似度为0.745~0.985,其中陕南产区样品的相似度较高,表明样品的均一性较好;其他产区样品的相似度较低(均小于0.92),表明不同产区样品间质量存在差异。24批样品相对峰面积的RSD 值差异较大(RSD 值为0~99.82%),表明其含量存在差异。本研究结果显示,24批小血藤样品可分为2类,主成分分析结果与该结果基本一致。芦丁、紫云英苷、17号峰、6号峰、13号峰5种成分为影响小血藤药材质量的差异标志物。含量测定结果显示,24批样品中,芦丁、紫云英苷、槲皮素的含量分别在0.272 8~0.476 4、0.058 3~0.155 8、0.042 1~0.057 4 mg·g-1范围内,各样品间含量差异明显。导致该差异的原因可能是各产地的地理环境、贮存及运输条件等因素的不同[17]。
综上所述,本研究建立的HPLC 指纹图谱和含量测定方法简便、稳定性好,可为小血藤质量的评价及控制提供依据。不同产地小血藤中芦丁、紫云英苷等成分的含量不同,可作为小血藤的差异标志物。
